解题方法
1 . 过氧化钙是一种优良供氧剂。工业用储量丰富的大理石(主要成分 ,含有少量的
,含有少量的 、
、 、
、 、
、 等杂质)制备
等杂质)制备 的过程如下:
的过程如下:

Ⅰ.过氧化钙的制取
(1)滤渣1的主要成分是_______ (填写物质名称)。
(2)“沉淀1”加入氨水的主要目的是_______ 。
(3)“沉淀2”生成 的离子方程式为
的离子方程式为_______ ;此反应常用冰水浴控制温度在 左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高
左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高 的产率;其二,
的产率;其二,_______ 。
(4)用冰水洗涤 的方法是
的方法是_______ 。
Ⅱ.过氧化钙含量的测定
(5)称量 样品加入一定量
样品加入一定量 硫酸配成溶液,并立即与
硫酸配成溶液,并立即与 酸性
酸性 标准溶液反应。消耗
标准溶液反应。消耗 ,计算样品中
,计算样品中 的质量分数。(已知:
的质量分数。(已知: ,
,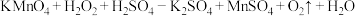 )
)_______ (请写出解题过程)。
 ,含有少量的
,含有少量的 、
、 、
、 、
、 等杂质)制备
等杂质)制备 的过程如下:
的过程如下:
Ⅰ.过氧化钙的制取
(1)滤渣1的主要成分是
(2)“沉淀1”加入氨水的主要目的是
(3)“沉淀2”生成
 的离子方程式为
的离子方程式为 左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高
左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高 的产率;其二,
的产率;其二,(4)用冰水洗涤
 的方法是
的方法是Ⅱ.过氧化钙含量的测定
(5)称量
 样品加入一定量
样品加入一定量 硫酸配成溶液,并立即与
硫酸配成溶液,并立即与 酸性
酸性 标准溶液反应。消耗
标准溶液反应。消耗 ,计算样品中
,计算样品中 的质量分数。(已知:
的质量分数。(已知: ,
,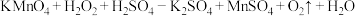 )
)
您最近一年使用:0次
2 . 工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO和SiO2,不考虑其它杂质)制备七水合硫酸亚铁(FeSO4·7H2O)晶体,流程如下:
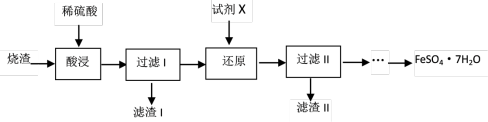
(1)为提高浸取率,可以采取的措施是___________ (填写其中的一条即可)。滤渣I的主要成分是___________ (填写化学式)
(2)如果滤渣II的成分是Fe,写出“还原”过程中发生反应的离子方程式___________ 。
(3)从分离出滤渣II后的滤液中得到产品,应进行的操作是蒸发浓缩、___________ 、过滤、洗涤、干燥。
(4)FeSO4·7H2O在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤I:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配制成250 mL溶液;
步骤II:取上述溶液25.00 mL于锥形瓶中,加入少量硫酸酸化,逐滴滴加0.0100 mol·L -1 KMnO4溶液,反应为:5Fe2++MnO +8H+=5Fe3++Mn2++4H2O。记录滴定终点时消耗KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应)。
+8H+=5Fe3++Mn2++4H2O。记录滴定终点时消耗KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应)。
步骤Ⅲ:重复“步骤II”2~3次,平均消耗KMnO4溶液的体积为20.00 mL。
①步骤I中,配制溶液需要的玻璃仪器有烧杯、玻璃棒、___________ 、胶头滴管。
②该补血剂中亚铁离子的含量为___________ mg/片(写出计算过程)。

(1)为提高浸取率,可以采取的措施是
(2)如果滤渣II的成分是Fe,写出“还原”过程中发生反应的离子方程式
(3)从分离出滤渣II后的滤液中得到产品,应进行的操作是蒸发浓缩、
(4)FeSO4·7H2O在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤I:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配制成250 mL溶液;
步骤II:取上述溶液25.00 mL于锥形瓶中,加入少量硫酸酸化,逐滴滴加0.0100 mol·L -1 KMnO4溶液,反应为:5Fe2++MnO
 +8H+=5Fe3++Mn2++4H2O。记录滴定终点时消耗KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应)。
+8H+=5Fe3++Mn2++4H2O。记录滴定终点时消耗KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应)。步骤Ⅲ:重复“步骤II”2~3次,平均消耗KMnO4溶液的体积为20.00 mL。
①步骤I中,配制溶液需要的玻璃仪器有烧杯、玻璃棒、
②该补血剂中亚铁离子的含量为
您最近一年使用:0次



