解题方法
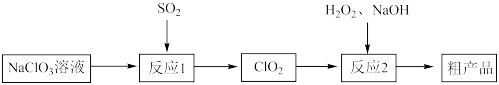
1 . 以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下:_______ (填化学式)。
②每有1mol NaClO3参加反应,理论上可生成ClO2的物质的量为_______ mol。
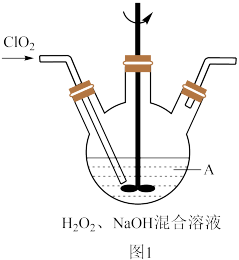
(2)反应2在如图1装置中发生(该反应放出大量的热,且温度高于60℃时NaClO2分解生成NaClO3和NaCl)_______ 。
②实际反应中发现消耗的NaOH比理论值偏少,原因可能是_______ 。
③通常会将该装置放置于冰水浴中,其目的是_______ 。
a.提高ClO2吸收率 b.防止NaClO2分解 c.提高反应速度
(3)ClO2是一种广谱型消毒剂,对一切经水体传播的病原微生物均有很好的杀灭效果。用ClO2处理过的水中ClO2、 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为 或Cl-的转化率与溶液的
或Cl-的转化率与溶液的 关系如图2所示。
关系如图2所示。
滴定步骤:①准确量取100mL水样加到碘量瓶中,调节水样的 为
为 ,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0,
,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0, 可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。
可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。
根据上述数据,测得该水样中的 浓度是多少
浓度是多少_____ ?
②每有1mol NaClO3参加反应,理论上可生成ClO2的物质的量为
(2)反应2在如图1装置中发生(该反应放出大量的热,且温度高于60℃时NaClO2分解生成NaClO3和NaCl)
②实际反应中发现消耗的NaOH比理论值偏少,原因可能是
③通常会将该装置放置于冰水浴中,其目的是
a.提高ClO2吸收率 b.防止NaClO2分解 c.提高反应速度
(3)ClO2是一种广谱型消毒剂,对一切经水体传播的病原微生物均有很好的杀灭效果。用ClO2处理过的水中ClO2、
 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为 或Cl-的转化率与溶液的
或Cl-的转化率与溶液的 关系如图2所示。
关系如图2所示。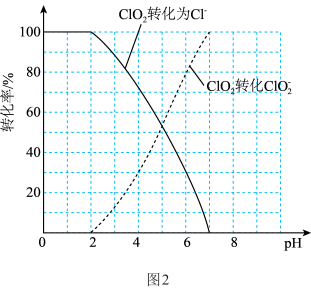
滴定步骤:①准确量取100mL水样加到碘量瓶中,调节水样的
 为
为 ,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0,
,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0, 可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。
可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。根据上述数据,测得该水样中的
 浓度是多少
浓度是多少
您最近一年使用:0次
名校
解题方法
2 . 常温下,青蒿素是一种无色针状晶体,易溶于有机溶剂,难溶于水,熔点约为156.5℃,易受湿、热的影响而分解。某实验小组对青蒿素的提取和组成进行了探究。
Ⅰ.提取流程:

(1)“破碎”的目的是________________ 。
(2) 操作a和操作b的名称分别是____________ 、____________ 。
Ⅱ.燃烧法测定最简式:
实验室用如图所示装置测定青蒿素(烃的含氧衍生物)中氧元素的质量分数。
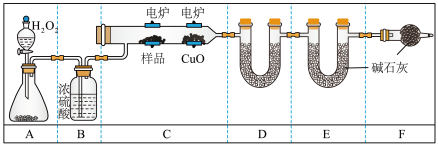
(3) A装置是提供实验所需的O2,B装置中浓硫酸的作用是_______________ ;C中CuO的作用是______________________ 。
(4) 燃烧m g青蒿素,图中D(装无水CaCl2)、E的质量分别增重a g、b g,则青蒿素中氧元素的质量分数可表示为_________ (只写计算式,用含有m、a、b的符号来表示,可不化简)。
(5)该装置也可以用来测其他有机物的最简式。
准确称取9.0 g某烃的含氧衍生物X的样品,经充分燃烧后,D管质量增加9.0g,E管质量增加17.6 g,则该有机物的实验式是_______ ,能不能确定分子式 ___________ (能确定写出分子式,不能确定填“否”)
Ⅰ.提取流程:

(1)“破碎”的目的是
(2) 操作a和操作b的名称分别是
Ⅱ.燃烧法测定最简式:
实验室用如图所示装置测定青蒿素(烃的含氧衍生物)中氧元素的质量分数。

(3) A装置是提供实验所需的O2,B装置中浓硫酸的作用是
(4) 燃烧m g青蒿素,图中D(装无水CaCl2)、E的质量分别增重a g、b g,则青蒿素中氧元素的质量分数可表示为
(5)该装置也可以用来测其他有机物的最简式。
准确称取9.0 g某烃的含氧衍生物X的样品,经充分燃烧后,D管质量增加9.0g,E管质量增加17.6 g,则该有机物的实验式是
您最近一年使用:0次
2020-11-19更新
|
253次组卷
|
2卷引用:江苏省淮安市高中校协作体2021-2022学年高二下学期期中考试化学试题
3 . 氯化铜在工农业生产中具有重要的用途。某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。回答下列问题:
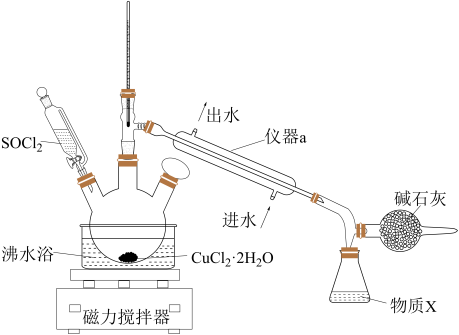
已知:①SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2 CuCl2+2SO2↑+4HCl↑
CuCl2+2SO2↑+4HCl↑
(1)仪器a的名称是______ ,锥形瓶中得到的物质X的化学式为______ 。
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是______ 。
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2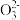 =S4
=S4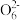 +2I-)。
+2I-)。
①滴定到终点时的现象是______ 。
②该试样中铜元素的百分含量为______ 。

已知:①SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2
 CuCl2+2SO2↑+4HCl↑
CuCl2+2SO2↑+4HCl↑(1)仪器a的名称是
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2
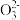 =S4
=S4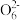 +2I-)。
+2I-)。①滴定到终点时的现象是
②该试样中铜元素的百分含量为
您最近一年使用:0次
2020-12-30更新
|
189次组卷
|
3卷引用:江苏省马坝高级中学2021-2022学年高二上学期期中考试化学(必修)试题



