山东省潍坊昌邑市潍坊实验中学2022-2023学年高二10月月考化学试题
山东
高二
阶段练习
2022-11-13
190次
整体难度:
适中
考查范围:
化学反应原理、有机化学基础、化学实验基础
山东省潍坊昌邑市潍坊实验中学2022-2023学年高二10月月考化学试题
山东
高二
阶段练习
2022-11-13
190次
整体难度:
适中
考查范围:
化学反应原理、有机化学基础、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 化学与生产、生活密切相关。下列做法或说法错误的是
| A.将煤气中毒患者移至空气流通处进行救治 |
| B.医用药品常在低温、干燥的环境中密封保存 |
| C.农业生产中草木灰和铵态氮肥混合使用以增加肥效 |
D. 和 和 溶液可作为焊接除锈剂 溶液可作为焊接除锈剂 |
【知识点】 盐类水解在生活、生产中的应用解读 蛋白质的变性
您最近一年使用:0次
2021-11-17更新
|
377次组卷
|
5卷引用:山东省潍坊(安丘市、诸城市、高密市)2021-2022学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
2. 煤气化过程中的主要反应:
 ,在恒温恒容密闭体系中进行反应,可作为判断反应是否达到平衡状态的依据是
,在恒温恒容密闭体系中进行反应,可作为判断反应是否达到平衡状态的依据是

 ,在恒温恒容密闭体系中进行反应,可作为判断反应是否达到平衡状态的依据是
,在恒温恒容密闭体系中进行反应,可作为判断反应是否达到平衡状态的依据是A. | B.容器内气体密度不变 |
C. | D.消耗1mol C同时生成1mol  |
【知识点】 化学平衡状态的判断方法解读
您最近一年使用:0次
2021-11-17更新
|
215次组卷
|
4卷引用:山东省潍坊(安丘市、诸城市、高密市)2021-2022学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
3. 学习小组对可逆反应
 进行探究。常温下,向盛有2mL0.01
进行探究。常温下,向盛有2mL0.01
 溶液的试管中滴加2滴0.01
溶液的试管中滴加2滴0.01 KSCN溶液,改变下列条件,试管中溶液颜色不会加深的是
KSCN溶液,改变下列条件,试管中溶液颜色不会加深的是

 进行探究。常温下,向盛有2mL0.01
进行探究。常温下,向盛有2mL0.01
 溶液的试管中滴加2滴0.01
溶液的试管中滴加2滴0.01 KSCN溶液,改变下列条件,试管中溶液颜色不会加深的是
KSCN溶液,改变下列条件,试管中溶液颜色不会加深的是| A.将试管放入冰水浴中 | B.加水稀释 |
C.加入1 KSCN溶液 KSCN溶液 | D.加入少量 固体 固体 |
【知识点】 浓度对化学平衡移动的影响解读 温度对化学平衡移动的影响解读
您最近一年使用:0次
2021-11-17更新
|
162次组卷
|
2卷引用:山东省潍坊(安丘市、诸城市、高密市)2021-2022学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
4. 《科学》杂志评出“十大科技突破”,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法正确的是
| A.升高温度,测得水的pH<7,显酸性 |
B.向水中加入 固体,水的电离平衡向正反应方向移动, 固体,水的电离平衡向正反应方向移动,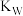 增大 增大 |
| C.Zn和稀硫酸制取氢气过程中,溶液中水的电离平衡向正反应方向移动 |
| D.25℃时,pH相同的氨水和纯碱溶液中水的电离程度相同 |
您最近一年使用:0次
2021-11-17更新
|
311次组卷
|
5卷引用:山东省潍坊(安丘市、诸城市、高密市)2021-2022学年高二上学期期中考试化学试题
单选题
|
较易(0.85)
名校
解题方法
5. 向 中加入少量
中加入少量 溶液,混合溶液有大量气泡逸出,查阅资料知
溶液,混合溶液有大量气泡逸出,查阅资料知 的分解机理如下:
的分解机理如下:
① 慢
慢
② 快
快
下列有关说法正确的是
 中加入少量
中加入少量 溶液,混合溶液有大量气泡逸出,查阅资料知
溶液,混合溶液有大量气泡逸出,查阅资料知 的分解机理如下:
的分解机理如下:①
 慢
慢②
 快
快下列有关说法正确的是
A.增大 不影响产生气体的速率 不影响产生气体的速率 |
B.第一步中 与 与 碰撞仅部分有效 碰撞仅部分有效 |
C. 是该反应的催化剂 是该反应的催化剂 |
| D.第二步的活化能较高 |
【知识点】 影响化学反应速率的内因解读
您最近一年使用:0次
2021-11-17更新
|
400次组卷
|
3卷引用:山东省潍坊(安丘市、诸城市、高密市)2021-2022学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
解题方法
6. 北京航空航天大学教授团队与中科院高能物理研究所合作,合成了两种单原子催化剂Y/NC和Sc/NC,实现常温常压下催化还原氮气合成氨气,反应历程与相对能量如图所示(*表示稀土单原子催化剂)。下列说法错误的是
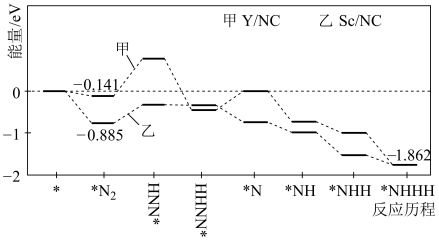

A. 的值甲>乙 的值甲>乙 |
| B.升高温度氨气的产率不一定提高 |
C.Sc/NC比Y/NC更有利于吸附 |
D.使用Y/NC单原子催化剂时,历程中决速步的反应为: |
您最近一年使用:0次
2021-11-17更新
|
219次组卷
|
2卷引用:山东省潍坊(安丘市、诸城市、高密市)2021-2022学年高二上学期期中考试化学试题
单选题
|
较易(0.85)
名校
7. 对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
| A.加水稀释相同的倍数后,两溶液的pH:醋酸>盐酸 |
| B.使温度都升高20℃后,两溶液的pH均减小 |
| C.加适量的醋酸钠晶体后,两溶液的pH均增大 |
| D.加足量的锌充分反应后,两溶液中产生的氢气:盐酸多 |
【知识点】 一元强酸与一元弱酸的比较解读
您最近一年使用:0次
2022-06-24更新
|
330次组卷
|
2卷引用:山东省泰安市第一中学2021-2022学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
名校
8. 关于合成氨工业的说法中错误的是
| A.混合气进行循环利用遵循绿色化学思想 |
| B.工业上采用高温条件的目的是为了提高平衡转化率 |
| C.对原料气进行压缩可增大原料气的转化率 |
| D.使用催化剂能加快该反应速率的原因是降低了活化能 |
您最近一年使用:0次
2021-11-17更新
|
198次组卷
|
4卷引用:山东省烟台市2021-2022学年高二上学期期中考试化学试题
单选题
|
较易(0.85)
名校
9. 向纯水中加入少量下列物质或改变下列条件,能促进水的电离,并能使溶液中c(OH-)>c(H+)的是
| A.NaHSO4固体 | B.将水加热煮沸 | C.NaClO固体 | D.氨气 |
您最近一年使用:0次
2021-11-12更新
|
564次组卷
|
6卷引用:山东省潍坊市2021-2022学年高二上学期第一学段期中监测化学试题
山东省潍坊市2021-2022学年高二上学期第一学段期中监测化学试题山东省菏泽市2022-2023学年高二上学期期中考试(B)化学试题山东省潍坊昌邑市潍坊实验中学2022-2023学年高二10月月考化学试题山东省济宁市兖州区2022-2023学年高二上学期期中考试化学试题(已下线)第11讲 水的电离 溶液的酸碱性与pH-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)山东省潍坊昌邑市第一中学2023-2024学年高二上学期10月月考化学试题
单选题
|
适中(0.65)
10. 在一定温度下可逆反应:
 。
。 温度时,向密闭容器中通入X,部分实验数据见下表:
温度时,向密闭容器中通入X,部分实验数据见下表:
下列说法中错误的是

 。
。 温度时,向密闭容器中通入X,部分实验数据见下表:
温度时,向密闭容器中通入X,部分实验数据见下表:| 时间/s | 0 | 50 | 100 | 150 |
 | 5.00 | 3.52 | 2.50 | 2.50 |
A.50s内, |
B. 温度下的平衡常数 温度下的平衡常数 ,平衡时X的转化率为50% ,平衡时X的转化率为50% |
C. 温度下的平衡常数为 温度下的平衡常数为 , , 温度下的平衡常数为 温度下的平衡常数为 ,若 ,若 ,则 ,则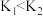 |
D. 时, 时, 的平衡常数为 的平衡常数为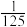 |
您最近一年使用:0次
2021-11-17更新
|
195次组卷
|
2卷引用:山东省烟台市2021-2022学年高二上学期期中考试化学试题
11. 下列实验能达到预期目的是
实验内容 | 实验目的(或结论) | |
A | 将 的 的 溶液和 溶液和 的 的 溶液等体积混合,充分反应后,取少许混合液滴加 溶液等体积混合,充分反应后,取少许混合液滴加 溶液 溶液 | 验证 与 与 的反应有一定限度 的反应有一定限度 |
B | 装有二氧化氮和四氧化二氮混合气体的装置,一球放入热水中,一球放入冰水混合物中 | 探究温度对化学反应速率的影响 |
C | 相同条件下,向一支试管中加入 和 和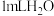 ,向另一支试管中加入 ,向另一支试管中加入 和 和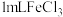 溶液,观察并比较实验现象 溶液,观察并比较实验现象 | 探究 对 对 分解速率的影响 分解速率的影响 |
D | 室温下,用pH试纸测得CH3COONH4溶液显中性 | CH3COONH4溶液没有发生水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
二、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
解题方法
12. 下列说法不正确的是
| A.相同温度下,pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) |
B.CH3COOH溶液加水稀释后,溶液中 的值减小 的值减小 |
| C.相同温度下,pH相等的氨水和NaOH溶液中,n(OH-)相等 |
| D.含有CH3COOH与CH3COONa的混合液一定呈酸性 |
您最近一年使用:0次
2022-08-23更新
|
215次组卷
|
2卷引用:山东省东营市第一中学2021-2022学年高二上学期期中考试化学试题
多选题
|
适中(0.65)
解题方法
13. 加热 溶液,测得溶液pH发生如下变化:
溶液,测得溶液pH发生如下变化:
下列判断正确的是
 溶液,测得溶液pH发生如下变化:
溶液,测得溶液pH发生如下变化:| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
A.20℃时,溶液中 |
B.50℃时,溶液中 |
C.加热过程中,溶液中 的值逐渐增大 的值逐渐增大 |
D.将 溶液蒸干得到NaOH固体 溶液蒸干得到NaOH固体 |
【知识点】 水的离子积常数解读 影响盐类水解程度的主要因素 盐类水解的应用
您最近一年使用:0次
2021-11-17更新
|
228次组卷
|
2卷引用:山东省潍坊(安丘市、诸城市、高密市)2021-2022学年高二上学期期中考试化学试题
三、单选题 添加题型下试题
单选题
|
适中(0.65)
14. 工业生产硝酸过程中,反应Ⅰ、Ⅱ均会在氧化炉内发生。不同温度下,反应Ⅰ、Ⅱ的化学平衡常数如下表所示。下列说法正确的是
| 温度(K) | 化学平衡常数 | |
| 反应Ⅰ:4NH3+5O2⇌4NO+6H2O | 反应Ⅱ:4NH3+3O2⇌2N2+6H2O | |
| 500 | 1.1×1026 | 7.1×1034 |
| 700 | 2.1×1019 | 2.6×1025 |
| A.反应Ⅰ、Ⅱ的ΔH均大于0 |
| B.从体系中分离出H2O,会使反应Ⅰ、Ⅱ平衡正向移动,且反应速率加快 |
| C.改变氧化炉的压强可促进反应Ⅰ而抑制反应Ⅱ |
| D.使用选择性催化反应Ⅰ的催化剂,可增大氧化炉中NO的含量 |
您最近一年使用:0次
四、多选题 添加题型下试题
多选题
|
适中(0.65)
15. 某温度下,将相同浓度的 和
和 分别加水稀释,溶液中微粒的分布分数
分别加水稀释,溶液中微粒的分布分数 [
[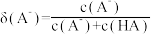 ,其中HA、
,其中HA、 分别表示相应的酸和酸根离子]随加水体积的变化如图所示。下列叙述错误的是
分别表示相应的酸和酸根离子]随加水体积的变化如图所示。下列叙述错误的是

 和
和 分别加水稀释,溶液中微粒的分布分数
分别加水稀释,溶液中微粒的分布分数 [
[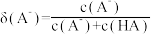 ,其中HA、
,其中HA、 分别表示相应的酸和酸根离子]随加水体积的变化如图所示。下列叙述错误的是
分别表示相应的酸和酸根离子]随加水体积的变化如图所示。下列叙述错误的是
A.由水电离出的 :c<a<b :c<a<b |
B.从b到c,溶液中 保持不变 保持不变 |
C.等浓度的 溶液和 溶液和 溶液的pH: 溶液的pH: |
D.用相同浓度的NaOH溶液分别中和等体积等pH的 和 和 , , 消耗NaOH溶液的体积比 消耗NaOH溶液的体积比 小 小 |
【知识点】 一元强酸与一元弱酸的比较解读 电离平衡常数及影响因素解读
您最近一年使用:0次
2021-11-17更新
|
365次组卷
|
3卷引用:山东省潍坊(安丘市、诸城市、高密市)2021-2022学年高二上学期期中考试化学试题
山东省潍坊(安丘市、诸城市、高密市)2021-2022学年高二上学期期中考试化学试题山东省潍坊昌邑市潍坊实验中学2022-2023学年高二10月月考化学试题(已下线)河北省部分学校2022-2023学年高三上学期期末考试变式汇编(10-13)
五、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
16. 硫酸和醋酸都是重要的化工原料,在生产、科研中用途广泛。回答下列问题:
(1)下列能说明硫酸是强酸、醋酸是弱酸的事实有___________ (填序号)。
a.25℃,0.05mol·L-1H2SO4的pH=1,0.1mol·L-1CH3COOH的pH≈2.8
b.25℃,0.1mol·L-1Na2SO4溶液的pH=7,0.1mol·L-1CH3COONa溶液的pH>7
c.温度相同时,1mol·L-1H2SO4溶液的导电能力强于1mol·L-1CH3COOH溶液的导电能力
d.中和等物质的量的H2SO4和CH3COOH,前者消耗NaOH的物质的量是后者两倍
(2)某兴趣小组设计了如下实验,探究不同条件对KI溶液(硫酸酸化)被空气中O2氧化反应速率的影响:
①请完成下表(硫酸、KI溶液体积均为5mL,淀粉溶液用量相同):
c=___________ ,T=___________ 。
②该实验中应该观察记录___________ ,为此,该实验中三种溶液混合的顺序不合理的是___________ 。
a.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
b.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
c.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
(3)实验表明,液态时纯硫酸的导电能力强于纯水。液态电解质都能像水那样自身电离而建立电离平衡。纯硫酸在液态时自身电离的方程式为___________ ,它在25℃时的离子积常数K(H2SO4)___________ Kw(填“<”、“>”或“=”)。
(1)下列能说明硫酸是强酸、醋酸是弱酸的事实有
a.25℃,0.05mol·L-1H2SO4的pH=1,0.1mol·L-1CH3COOH的pH≈2.8
b.25℃,0.1mol·L-1Na2SO4溶液的pH=7,0.1mol·L-1CH3COONa溶液的pH>7
c.温度相同时,1mol·L-1H2SO4溶液的导电能力强于1mol·L-1CH3COOH溶液的导电能力
d.中和等物质的量的H2SO4和CH3COOH,前者消耗NaOH的物质的量是后者两倍
(2)某兴趣小组设计了如下实验,探究不同条件对KI溶液(硫酸酸化)被空气中O2氧化反应速率的影响:
①请完成下表(硫酸、KI溶液体积均为5mL,淀粉溶液用量相同):
| 实验编号 | T/K | c(KI)/mol·Lˉ1 | c(H2SO4)/mol·Lˉ1 | 实验目的 |
| I | 298 | 1 | 0.1 | 实验I和II探究温度对该反应速率的影响;实验I和III探究反应物浓度对该反应速率的影响 |
| II | 308 | 1 | c | |
| III | T | 1 | 0.2 |
②该实验中应该观察记录
a.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
b.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
c.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
(3)实验表明,液态时纯硫酸的导电能力强于纯水。液态电解质都能像水那样自身电离而建立电离平衡。纯硫酸在液态时自身电离的方程式为
您最近一年使用:0次
2021-11-12更新
|
267次组卷
|
3卷引用:山东省潍坊市2021-2022学年高二上学期第一学段期中监测化学试题
六、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
名校
17. 一定温度下,向一容积为2L的恒容密闭容器中充入0.4 molSO2和0.2mol O2发生反应: 2SO2(g)+O2(g) 2SO3(g) △H=-196 kJ/mol。 当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) △H=-196 kJ/mol。 当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是_______ (填字母)。
a. SO2、O2、SO3三者的浓度之比为2:1:2
b.容器内气体的压强不再变化
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)有利于提高SO2的平衡转化率的措施有:_______ (填字母)
a.使用催化剂 b.降低温度 c.及时分离出SO3
(3)①SO2的平衡转化率为_______ 。
②此温度下该反应的平衡常数K=_______ 。
(4)如图所示平衡时SO3的体积分数随压强和温度变化的曲线,则:
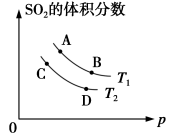
①温度关系:T1_______ T2(填“>”“<”或“=”,下同)
②平衡常数文关系:KA_______ KB,KA _______ KD。
 2SO3(g) △H=-196 kJ/mol。 当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) △H=-196 kJ/mol。 当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:(1)判断该反应达到平衡状态的标志是
a. SO2、O2、SO3三者的浓度之比为2:1:2
b.容器内气体的压强不再变化
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)有利于提高SO2的平衡转化率的措施有:
a.使用催化剂 b.降低温度 c.及时分离出SO3
(3)①SO2的平衡转化率为
②此温度下该反应的平衡常数K=
(4)如图所示平衡时SO3的体积分数随压强和温度变化的曲线,则:

①温度关系:T1
②平衡常数文关系:KA
您最近一年使用:0次
2022-06-24更新
|
177次组卷
|
2卷引用:山东省泰安市第一中学2021-2022学年高二上学期期中考试化学试题
解答题-工业流程题
|
适中(0.65)
18. 亚硫酸钠在印染、造纸等领域应用广泛。利用工业废碱渣(主要成分 )吸收硫酸厂尾气中的
)吸收硫酸厂尾气中的 制备无水
制备无水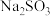 的流程如下:
的流程如下:

回答下列问题:
(1)常温下, 溶液显碱性的理由是
溶液显碱性的理由是_______ (用离子方程式回答);其溶液中:
_______ 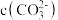 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)“母液”溶质中的盐主要是_______ (填化学式),常温下该物质的稀溶液中阴离子浓度由大到小的顺序为_______ 。
(3)常温下,向某浓度的亚硫酸溶液中缓慢加入 粉末也能制得
粉末也能制得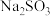 ,测得反应过程中溶液的pH与离子浓度的关系如图所示。
,测得反应过程中溶液的pH与离子浓度的关系如图所示。

①表示pH与 的变化关系的曲线是
的变化关系的曲线是_______ (填“Ⅰ”或“Ⅱ”)。
② 的
的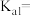
_______ 。
 )吸收硫酸厂尾气中的
)吸收硫酸厂尾气中的 制备无水
制备无水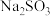 的流程如下:
的流程如下:
回答下列问题:
(1)常温下,
 溶液显碱性的理由是
溶液显碱性的理由是
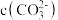 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)“母液”溶质中的盐主要是
(3)常温下,向某浓度的亚硫酸溶液中缓慢加入
 粉末也能制得
粉末也能制得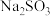 ,测得反应过程中溶液的pH与离子浓度的关系如图所示。
,测得反应过程中溶液的pH与离子浓度的关系如图所示。
①表示pH与
 的变化关系的曲线是
的变化关系的曲线是②
 的
的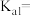
您最近一年使用:0次
2021-11-17更新
|
211次组卷
|
3卷引用:山东省潍坊(安丘市、诸城市、高密市)2021-2022学年高二上学期期中考试化学试题
七、填空题 添加题型下试题
填空题
|
适中(0.65)
19. 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH1
Fe2O3(s)+ 1/3CO(g)=2/3Fe3O4(s)+ 1/3CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH4
上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
1600℃时固体物质的主要成分为_________
(2)铁系金属常用作CO加氢反应的催化剂。已知某种催化剂可用来催化反应CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH<0。在T℃,压强为p时将1mol CO和3mol H2加入容积为1L的密闭容器中。实验测得CO的体积分数χ(CO)如下表:
①前10min内,CO的平均反应速率υ(CO)=_________ (保留两位有效数字)。
②达到平衡时,体系的总压强p与初始压强p0之比,p:p0=_________ ;
③如图是该反应CO的平衡转化率与温度、压强的关系。

图中温度T1、T2、T3由高到低的顺序是_________ ,理由是 _________ 。
④45min时,保持容器的温度和体积不变,再加入1mol CO和3mol H2,再次达到平衡时,CO的平衡转化率_________ (填“>”、“<”或“=”)30min时CO的平衡转化率。
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH1
Fe2O3(s)+ 1/3CO(g)=2/3Fe3O4(s)+ 1/3CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH4
上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600℃时固体物质的主要成分为
(2)铁系金属常用作CO加氢反应的催化剂。已知某种催化剂可用来催化反应CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH<0。在T℃,压强为p时将1mol CO和3mol H2加入容积为1L的密闭容器中。实验测得CO的体积分数χ(CO)如下表:
| t/min | 0 | 10 | 20 | 30 | 35 |
| χ(CO) | 0.25 | 0.20 | 0.17 | 0.15 | 0.15 |
①前10min内,CO的平均反应速率υ(CO)=
②达到平衡时,体系的总压强p与初始压强p0之比,p:p0=
③如图是该反应CO的平衡转化率与温度、压强的关系。

图中温度T1、T2、T3由高到低的顺序是
④45min时,保持容器的温度和体积不变,再加入1mol CO和3mol H2,再次达到平衡时,CO的平衡转化率
您最近一年使用:0次
八、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
20. 金矿提金时,用NaCN溶液浸取金生成 ,再用锌置换出金,产生的含氰废水、废气需处理后排放。已知:氢氰酸(HCN)有剧毒,易挥发,25℃时
,再用锌置换出金,产生的含氰废水、废气需处理后排放。已知:氢氰酸(HCN)有剧毒,易挥发,25℃时 。回答下列问题:
。回答下列问题:
(1) 存在着两步电离平衡,其第二步电离方程式为
存在着两步电离平衡,其第二步电离方程式为_______ 。
(2)配制NaCN溶液时,将NaCN固体溶于NaOH溶液中,再用蒸馏水稀释配成溶液。原因是_______ (用离子方程式表示)。
(3) 可做
可做 氧化废水中
氧化废水中 的催化剂,氧化过程中总氰化物(
的催化剂,氧化过程中总氰化物( 、HCN等)去除率随溶液初始pH变化如图所示。
、HCN等)去除率随溶液初始pH变化如图所示。

①在酸性条件下, 也能氧化
也能氧化 但实际处理废水时却不在酸性条件下进行的原因是
但实际处理废水时却不在酸性条件下进行的原因是_______ 。
②当溶液初始pH>10时,总氰化物去除率下降的原因可能是_______ 。
(4)利用反应
 处理废气中HCN。将物质的量均为1 mol的HCN和
处理废气中HCN。将物质的量均为1 mol的HCN和 混合气体通入密闭容器中发生反应,HCN的去除率随温度的变化曲线如图所示。处理HCN时最适宜的温度为
混合气体通入密闭容器中发生反应,HCN的去除率随温度的变化曲线如图所示。处理HCN时最适宜的温度为_______ ,此温度下反应进行10min达平衡,该反应的
_______ 。

 ,再用锌置换出金,产生的含氰废水、废气需处理后排放。已知:氢氰酸(HCN)有剧毒,易挥发,25℃时
,再用锌置换出金,产生的含氰废水、废气需处理后排放。已知:氢氰酸(HCN)有剧毒,易挥发,25℃时 。回答下列问题:
。回答下列问题:(1)
 存在着两步电离平衡,其第二步电离方程式为
存在着两步电离平衡,其第二步电离方程式为(2)配制NaCN溶液时,将NaCN固体溶于NaOH溶液中,再用蒸馏水稀释配成溶液。原因是
(3)
 可做
可做 氧化废水中
氧化废水中 的催化剂,氧化过程中总氰化物(
的催化剂,氧化过程中总氰化物( 、HCN等)去除率随溶液初始pH变化如图所示。
、HCN等)去除率随溶液初始pH变化如图所示。
①在酸性条件下,
 也能氧化
也能氧化 但实际处理废水时却不在酸性条件下进行的原因是
但实际处理废水时却不在酸性条件下进行的原因是②当溶液初始pH>10时,总氰化物去除率下降的原因可能是
(4)利用反应

 处理废气中HCN。将物质的量均为1 mol的HCN和
处理废气中HCN。将物质的量均为1 mol的HCN和 混合气体通入密闭容器中发生反应,HCN的去除率随温度的变化曲线如图所示。处理HCN时最适宜的温度为
混合气体通入密闭容器中发生反应,HCN的去除率随温度的变化曲线如图所示。处理HCN时最适宜的温度为

您最近一年使用:0次
2021-11-17更新
|
184次组卷
|
2卷引用:山东省潍坊(安丘市、诸城市、高密市)2021-2022学年高二上学期期中考试化学试题
试卷分析
整体难度:适中
考查范围:化学反应原理、有机化学基础、化学实验基础
试卷题型(共 20题)
题型
数量
单选题
12
多选题
3
填空题
2
解答题
3
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 盐类水解在生活、生产中的应用 蛋白质的变性 | |
| 2 | 0.65 | 化学平衡状态的判断方法 | |
| 3 | 0.65 | 浓度对化学平衡移动的影响 温度对化学平衡移动的影响 | |
| 4 | 0.65 | 化学平衡的移动 水的电离 水的离子积常数 盐类水解规律理解及应用 | |
| 5 | 0.85 | 影响化学反应速率的内因 | |
| 6 | 0.65 | 盖斯定律的应用 活化能及其对反应速率的影响 温度对化学平衡移动的影响 | |
| 7 | 0.85 | 一元强酸与一元弱酸的比较 | |
| 8 | 0.65 | 催化剂对化学反应速率的影响 化学平衡的移动及其影响因素 转化率的相关计算及判断 | |
| 9 | 0.85 | 水的电离 影响水电离的因素 | |
| 10 | 0.65 | 化学反应速率计算 化学平衡常数 化学平衡的有关计算 | |
| 11 | 0.65 | 影响化学反应速率的因素 盐类水解规律理解及应用 物质性质的探究 物质性质实验方案的设计 | |
| 14 | 0.65 | 影响化学反应速率的因素 浓度对化学反应速率的影响 催化剂对化学反应速率的影响 化学平衡的移动及其影响因素 | |
| 二、多选题 | |||
| 12 | 0.65 | 弱电解质的电离平衡 弱电解质电离平衡的影响因素 浓度对电离平衡的影响 盐溶液的酸碱性判断 | |
| 13 | 0.65 | 水的离子积常数 影响盐类水解程度的主要因素 盐类水解的应用 | |
| 15 | 0.65 | 一元强酸与一元弱酸的比较 电离平衡常数及影响因素 | |
| 三、填空题 | |||
| 16 | 0.65 | 浓度对化学反应速率的影响 温度对化学反应速率的影响 水的电离 强电解质与弱电解质 | |
| 19 | 0.65 | 化学反应速率计算 化学平衡的移动 温度对化学平衡移动的影响 | |
| 四、解答题 | |||
| 17 | 0.65 | 化学平衡状态的判断方法 温度对化学平衡移动的影响 化学平衡常数的影响因素及应用 化学平衡常数的有关计算 | 原理综合题 |
| 18 | 0.65 | 水解的离子方程式书写 盐类水解规律理解及应用 盐溶液中离子浓度大小的比较 弱电解质的电离平衡常数 | 工业流程题 |
| 20 | 0.65 | 与转化率变化有关图像的分析 弱电解质的电离方程式 电离平衡常数及影响因素 弱电解质的电离平衡常数 | 原理综合题 |



