化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。
Ⅰ.有甲、乙两个容积相等的恒容密闭容器,发生反应3A(g)+B(g) xC(g) ΔH=Q kJ/mol,回答下列问题:
xC(g) ΔH=Q kJ/mol,回答下列问题:
(1)下列各项能作为判断该反应达到化学平衡状态的依据是___________ (填序号)
①化学反应速率:v(A)=3v(B)
②混合气体的密度保持不变
③有3mol A消耗的同时有1mol B生成
④C的浓度保持不变
(2)根据试验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q___________ 0(填“大于”或“小于”)
(3)向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C,将两容器的温度恒定在770K,使反应3A(g)+B(g) xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2。
xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2。
①若平衡时,甲、乙两容器中A的物质的量相等,则x=___________ ;
②平衡时甲中A的体积分数为___________ ;
③若平衡时两容器的压强不相等,则两容器中压强之比为___________ 。
Ⅱ.请回答下列问题:
(4)pH=3的盐酸aL,分别与下列3种溶液混合,充分反应后溶液呈中性:
①pH=11的氨水bL;②物质的量浓度为1×10-3mol/L氨水cL;
③c(OH-)=1×10-3mol/L的Ba(OH)2溶液dL;
试判断a、b、c、d的大小关系正确的是___________
(5)已知室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,两溶液中c(H+)·c(OH-)=___________ ;各取5mL上述溶液,分别加水稀释至50mL,pH较大的是___________ 溶液;各取5mL上述溶液,分别加热到90℃,pH较小的是___________ 溶液。
(6)同浓度的下列溶液:①NH4Al(SO4)2;②NH4Cl;③NH3·H2O;④CH3COONH4,其中c(NH )由大到小的顺序是:
)由大到小的顺序是:___________ (填编号)。
Ⅲ.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm—),称为难溶电解质的溶度积。
(7)在25℃,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是___________ ;
(8)下列叙述不正确的是___________ (填字母)
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.25℃时,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同。
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
Ⅰ.有甲、乙两个容积相等的恒容密闭容器,发生反应3A(g)+B(g)
 xC(g) ΔH=Q kJ/mol,回答下列问题:
xC(g) ΔH=Q kJ/mol,回答下列问题:(1)下列各项能作为判断该反应达到化学平衡状态的依据是
①化学反应速率:v(A)=3v(B)
②混合气体的密度保持不变
③有3mol A消耗的同时有1mol B生成
④C的浓度保持不变
(2)根据试验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q
(3)向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C,将两容器的温度恒定在770K,使反应3A(g)+B(g)
 xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2。
xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2。①若平衡时,甲、乙两容器中A的物质的量相等,则x=
②平衡时甲中A的体积分数为
③若平衡时两容器的压强不相等,则两容器中压强之比为
Ⅱ.请回答下列问题:
(4)pH=3的盐酸aL,分别与下列3种溶液混合,充分反应后溶液呈中性:
①pH=11的氨水bL;②物质的量浓度为1×10-3mol/L氨水cL;
③c(OH-)=1×10-3mol/L的Ba(OH)2溶液dL;
试判断a、b、c、d的大小关系正确的是___________
| A.a=b>c>d | B.b>a=d>c | C.c>a>d>b | D.c>a=d>b |
(6)同浓度的下列溶液:①NH4Al(SO4)2;②NH4Cl;③NH3·H2O;④CH3COONH4,其中c(NH
 )由大到小的顺序是:
)由大到小的顺序是:Ⅲ.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm—),称为难溶电解质的溶度积。
(7)在25℃,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是
(8)下列叙述不正确的是
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.25℃时,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同。
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
11-12高三上·黑龙江牡丹江·期末 查看更多[1]
(已下线)2011届黑龙江省牡丹江一中高三上学期期末考试化学试卷
更新时间:2016-12-09 01:36:37
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。请回答下列问题:
(1)已知下列反应的热化学方程式:
①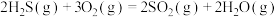

②
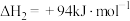
③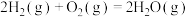
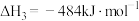
计算 热分解反应④
热分解反应④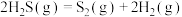 的
的
_______  。
。
(2)较普遍采用的 处理方法是克劳斯工艺,即利用反应①和②生成单质硫。另一种方法是利用反应④高温热分解
处理方法是克劳斯工艺,即利用反应①和②生成单质硫。另一种方法是利用反应④高温热分解 。相比克劳斯工艺,高温热分解方法的缺点是
。相比克劳斯工艺,高温热分解方法的缺点是_______ 。
(3)在1470K条件下,在1L恒容容器中充入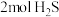 和3mol Ar进行
和3mol Ar进行 热分解反应。5min后达到平衡,混合气中
热分解反应。5min后达到平衡,混合气中 与
与 的体积分数相等,在5min内用
的体积分数相等,在5min内用 表示该反应的速率
表示该反应的速率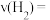
_______  ,
, 平衡转化率为
平衡转化率为_______ ,平衡常数
_______ 。
(4)在1373K、压强恒定100kPa的条件下,对于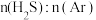 分别为4:1、1:1、1:4、1:9、1:19的
分别为4:1、1:1、1:4、1:9、1:19的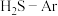 混合气,发生热分解反应过程中
混合气,发生热分解反应过程中 转化率随时间的变化如下图所示。请回答下列问题:
转化率随时间的变化如下图所示。请回答下列问题:
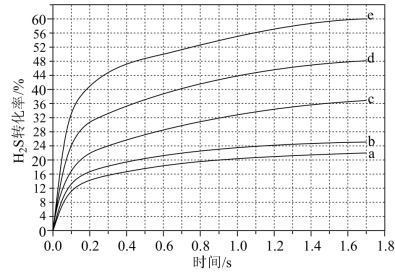
①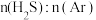 越小,
越小, 平衡转化率
平衡转化率_______ (填“越大”或“越小”或“不变”),理由是_______ 。
②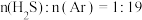 对应图中曲线
对应图中曲线_______ (填字母)。
(1)已知下列反应的热化学方程式:
①
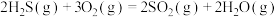

②

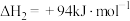
③
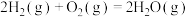
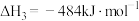
计算
 热分解反应④
热分解反应④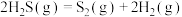 的
的
 。
。(2)较普遍采用的
 处理方法是克劳斯工艺,即利用反应①和②生成单质硫。另一种方法是利用反应④高温热分解
处理方法是克劳斯工艺,即利用反应①和②生成单质硫。另一种方法是利用反应④高温热分解 。相比克劳斯工艺,高温热分解方法的缺点是
。相比克劳斯工艺,高温热分解方法的缺点是(3)在1470K条件下,在1L恒容容器中充入
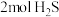 和3mol Ar进行
和3mol Ar进行 热分解反应。5min后达到平衡,混合气中
热分解反应。5min后达到平衡,混合气中 与
与 的体积分数相等,在5min内用
的体积分数相等,在5min内用 表示该反应的速率
表示该反应的速率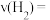
 ,
, 平衡转化率为
平衡转化率为
(4)在1373K、压强恒定100kPa的条件下,对于
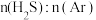 分别为4:1、1:1、1:4、1:9、1:19的
分别为4:1、1:1、1:4、1:9、1:19的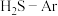 混合气,发生热分解反应过程中
混合气,发生热分解反应过程中 转化率随时间的变化如下图所示。请回答下列问题:
转化率随时间的变化如下图所示。请回答下列问题:
①
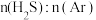 越小,
越小, 平衡转化率
平衡转化率②
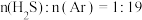 对应图中曲线
对应图中曲线
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
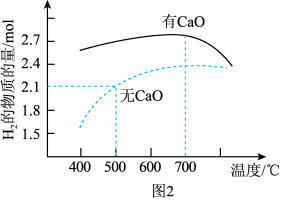
【推荐2】甲烷是一种重要的化工原料。据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①
CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②
二氧化碳重整:CH4(g)+CO2(g) 2CO(g)+2H2(g)ΔH3③
2CO(g)+2H2(g)ΔH3③
则反应①自发进行的条件是___ ,ΔH3=___ kJ·mol-1。
(2)氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为:N2(g)+3H2(g) 2NH3(g),在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。
2NH3(g),在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。
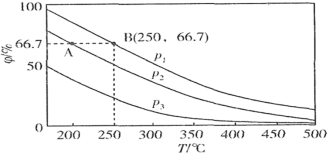
①其中,p1、p2和p3由大到小的顺序是___ ,其原因是___ 。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)___ vB(N2)(填“>”“<”或“=”)。
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L。Kp为用分压表示的平衡常数,则平衡常数Kp=___ (分压=总压×物质的量分数,计算结果保留两位小数)。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②二氧化碳重整:CH4(g)+CO2(g)
 2CO(g)+2H2(g)ΔH3③
2CO(g)+2H2(g)ΔH3③则反应①自发进行的条件是
(2)氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为:N2(g)+3H2(g)
 2NH3(g),在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。
2NH3(g),在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。
①其中,p1、p2和p3由大到小的顺序是
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L。Kp为用分压表示的平衡常数,则平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】乙烯是重要的工业原料,通过以下途径分别制备乙醇、乙醛等有机化合物,请回答下列问题:
I.(1)乙烯气相直接水合法生成乙醇
①2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9 kJ·mol-1
②2CH3OH(g)=C2H4(g)+2H2O(g) △H2=-29.1 kJ·mol-1
③C2H5OH(g)=CH3OCH3(g) △H3=+50.7 kJ·mol-1
乙烯气相直接水合法生成乙醇的热化学方程式为___________ 。
(2)已知等物质的量的C2H4和H2O的混合气体在一定的条件下反应,乙烯的平衡转化率与温度、压强的关系如图。
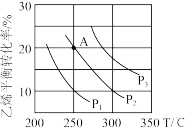
①列式计算乙烯水合制乙醇反应在图中A点(P2=7.85MPa)的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强(P1,P2,P3)由小到大顺序为___________ 。
③已知:C2H4(g)+H2O(g)=C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到350℃的过程中,下列推断合理的是___________ (填选项字母)
a.k正增大,k逆减小 b.k正减小,k逆增大
c.k正增大的倍数大于k逆 d.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率___________ 10%(填“>”“<”或“=”)
(3)乙烯与PdCl2发生氧化反应生成CH3CHO和Pd等化合物,其化学反应方程式为:_______ 。
(4)乙烯氧化生成乙醛的过程设计成如图所示的燃料电池,下列叙述正确的是________ 。
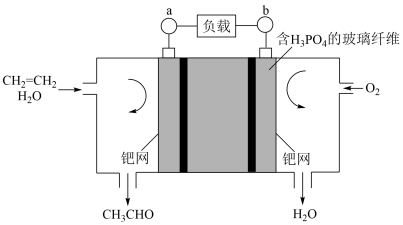
A.电子移动方向:由电极b经过负载至电极a
B.负极的电极反应式为CH2=CH2+H2O+2e-=CH3CHO+2OH-
C.当有0.1 mol O2反应时,会有0.4 mol H+迁移
D.a极是负极,b极是正极
I.(1)乙烯气相直接水合法生成乙醇
①2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9 kJ·mol-1
②2CH3OH(g)=C2H4(g)+2H2O(g) △H2=-29.1 kJ·mol-1
③C2H5OH(g)=CH3OCH3(g) △H3=+50.7 kJ·mol-1
乙烯气相直接水合法生成乙醇的热化学方程式为
(2)已知等物质的量的C2H4和H2O的混合气体在一定的条件下反应,乙烯的平衡转化率与温度、压强的关系如图。

①列式计算乙烯水合制乙醇反应在图中A点(P2=7.85MPa)的平衡常数Kp=
②图中压强(P1,P2,P3)由小到大顺序为
③已知:C2H4(g)+H2O(g)=C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到350℃的过程中,下列推断合理的是
a.k正增大,k逆减小 b.k正减小,k逆增大
c.k正增大的倍数大于k逆 d.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率
(3)乙烯与PdCl2发生氧化反应生成CH3CHO和Pd等化合物,其化学反应方程式为:
(4)乙烯氧化生成乙醛的过程设计成如图所示的燃料电池,下列叙述正确的是

A.电子移动方向:由电极b经过负载至电极a
B.负极的电极反应式为CH2=CH2+H2O+2e-=CH3CHO+2OH-
C.当有0.1 mol O2反应时,会有0.4 mol H+迁移
D.a极是负极,b极是正极
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】羰基硫(COS)是一种粮食熏蒸剂,能防治某些昆虫、线虫和真菌的危害。在容积不变的密闭容器中,将CO和 混合加热并达到下列平衡:
混合加热并达到下列平衡: 。
。
(1)若反应前CO的物质的量为10mol,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1。
①反应前 的物质的量为
的物质的量为_______ ,达到平衡时 的转化率为
的转化率为_______ (计算结果保留3位有效数字)。
②保持其他条件不变,向容器中通入更多CO气体,此时正反应速率_______ (填“增大”“减小”或“不变”)。
(2)在不同温度下达到化学平衡时, 的转化率如图所示,则该反应是
的转化率如图所示,则该反应是_______ (填“吸热”或“放热”)反应。

(3)在某温度下,向1L的密闭容器中通入10molCO和 ,平衡时测得CO的转化率为60%,则该温度下反应的平衡常数为
,平衡时测得CO的转化率为60%,则该温度下反应的平衡常数为_______ 。
(4)因 有剧毒,含有
有剧毒,含有 的尾气需要经过处理再排放。一种处理方法是先用
的尾气需要经过处理再排放。一种处理方法是先用 溶液吸收含
溶液吸收含 的尾气,所得溶液用惰性电极电解,阳极区所得溶液循环利用,其工作原理如图所示。
的尾气,所得溶液用惰性电极电解,阳极区所得溶液循环利用,其工作原理如图所示。

①反应池中发生反应的离子方程式是_______ 。
②阳极的电极反应式为_______ 。
 混合加热并达到下列平衡:
混合加热并达到下列平衡: 。
。(1)若反应前CO的物质的量为10mol,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1。
①反应前
 的物质的量为
的物质的量为 的转化率为
的转化率为②保持其他条件不变,向容器中通入更多CO气体,此时正反应速率
(2)在不同温度下达到化学平衡时,
 的转化率如图所示,则该反应是
的转化率如图所示,则该反应是
(3)在某温度下,向1L的密闭容器中通入10molCO和
 ,平衡时测得CO的转化率为60%,则该温度下反应的平衡常数为
,平衡时测得CO的转化率为60%,则该温度下反应的平衡常数为(4)因
 有剧毒,含有
有剧毒,含有 的尾气需要经过处理再排放。一种处理方法是先用
的尾气需要经过处理再排放。一种处理方法是先用 溶液吸收含
溶液吸收含 的尾气,所得溶液用惰性电极电解,阳极区所得溶液循环利用,其工作原理如图所示。
的尾气,所得溶液用惰性电极电解,阳极区所得溶液循环利用,其工作原理如图所示。
①反应池中发生反应的离子方程式是
②阳极的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】工业上H2O2是一种重要的绿色氧化还原试剂,某小组对H2O2的催化分解实验进行探究。回答下列问题:
(1)在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。实验装置如图所示:

①写出H2O2溶液在Fe3+催化下分解的化学方程式________ ;除了图中所示仪器之外,该实验还必需的仪器是________ 。
②请写出下面表格中I、II、III的实验记录内容或数据:
I=________ ,II=________ ,III=________ 。
(2)利用图1和图2中的信息,按图3装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到A瓶中气体颜色比B瓶中的_______ (填“深”或“浅”),其原因是________ 。

(3)该小组预测同为第四周期VIII族的Fe、Co、Ni可能有相似的催化作用。查阅资料:CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知_______ 法制取得到的催化剂活性更高,推测Co2+、Ni2+两种离子中催化效果更好的是________ 。

(1)在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。实验装置如图所示:

①写出H2O2溶液在Fe3+催化下分解的化学方程式
②请写出下面表格中I、II、III的实验记录内容或数据:
| 实验序号 | 0.1 mol•L-1 Fe2(SO4)3 溶液的体积/mL | Ⅱ | 30% H2O2溶液的体积/mL | 蒸馏水的体积/mL | O2的体积/mL |
1 | Ⅰ | b | c | d | e |
2 | a | b | d | Ⅲ | f |
(2)利用图1和图2中的信息,按图3装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到A瓶中气体颜色比B瓶中的

(3)该小组预测同为第四周期VIII族的Fe、Co、Ni可能有相似的催化作用。查阅资料:CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】将 和
和 两种引发温室效应的气体转化为合成气(
两种引发温室效应的气体转化为合成气( 和
和 ),可以实现能量综合利用,对环境保护具有十分重要的意义。
),可以实现能量综合利用,对环境保护具有十分重要的意义。
(1)利用 在一定条件下重整的技术可得到富含
在一定条件下重整的技术可得到富含 的气体,重整过程中的催化转化原理如图所示。
的气体,重整过程中的催化转化原理如图所示。
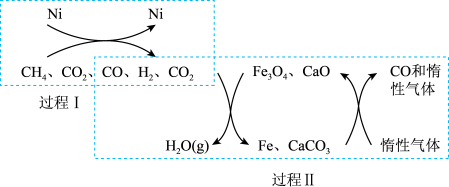
已知:i.
ii.
①过程I反应的化学方程式为_______ 。
②该技术总反应的热化学方程式为_______ 。
③反应i甲烷含量随温度变化如图1,图中 四条曲线中的两条代表压强分别为
四条曲线中的两条代表压强分别为 时甲烷含量曲线,其中表示
时甲烷含量曲线,其中表示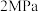 的是
的是_______
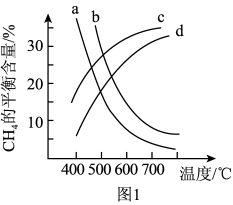
(2)甲烷的水蒸气重整涉及以下反应
I.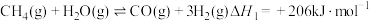
II.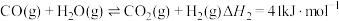
在一密闭体积可变容器中,通入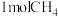 和
和 发生甲烷的水蒸气重整反应。
发生甲烷的水蒸气重整反应。
①反应I的平衡常数的表达式为_______ 。
反应II平衡常数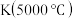
_______ 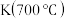 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②压强为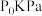 时,分别在加
时,分别在加 和不加
和不加 时,平衡体系
时,平衡体系 的物质的量随温度变化如图2所示。温度低于700℃时,加入
的物质的量随温度变化如图2所示。温度低于700℃时,加入 可明显提高混合气中
可明显提高混合气中 的量,原因是
的量,原因是_______ 。
 和
和 两种引发温室效应的气体转化为合成气(
两种引发温室效应的气体转化为合成气( 和
和 ),可以实现能量综合利用,对环境保护具有十分重要的意义。
),可以实现能量综合利用,对环境保护具有十分重要的意义。(1)利用
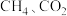 在一定条件下重整的技术可得到富含
在一定条件下重整的技术可得到富含 的气体,重整过程中的催化转化原理如图所示。
的气体,重整过程中的催化转化原理如图所示。
已知:i.
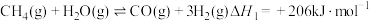
ii.
①过程I反应的化学方程式为
②该技术总反应的热化学方程式为
③反应i甲烷含量随温度变化如图1,图中
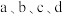 四条曲线中的两条代表压强分别为
四条曲线中的两条代表压强分别为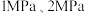 时甲烷含量曲线,其中表示
时甲烷含量曲线,其中表示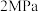 的是
的是
(2)甲烷的水蒸气重整涉及以下反应
I.
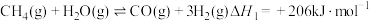
II.
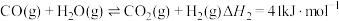
在一密闭体积可变容器中,通入
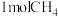 和
和 发生甲烷的水蒸气重整反应。
发生甲烷的水蒸气重整反应。①反应I的平衡常数的表达式为
反应II平衡常数
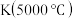
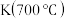 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②压强为
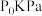 时,分别在加
时,分别在加 和不加
和不加 时,平衡体系
时,平衡体系 的物质的量随温度变化如图2所示。温度低于700℃时,加入
的物质的量随温度变化如图2所示。温度低于700℃时,加入 可明显提高混合气中
可明显提高混合气中 的量,原因是
的量,原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】亚磷酸(H3PO3)与足量的NaOH溶液反应生成(Na2HPO3)。
(1)亚磷酸是_______ 元酸。
(2)PCl3水解可制取亚磷酸,反应的化学方程式是_______ 。
(3)在H3PO3溶液中存在电离平衡: H3PO3 H++H2PO
H++H2PO
①某温度下0.10mol·L-1H3PO3溶液pH=1.6,即溶液中c(H+)=2.5 10-2 mol·L-1,求该温度下,上述电离平衡的平衡常数K=
10-2 mol·L-1,求该温度下,上述电离平衡的平衡常数K=_______  只考虑H3PO3的第一步电离,结果保留两位有效数字
只考虑H3PO3的第一步电离,结果保留两位有效数字 。
。
②Na2HPO3溶液中离子浓度由大到小的顺序是_______
(4)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:

①阴极的电极反应为_______ ;
②产品室中反应的离子方程式为_______ 。
(5)亚磷酸具有强还原性,可将 还原为金属单质,亚磷酸与硫酸铜溶液反应的化学方程式为
还原为金属单质,亚磷酸与硫酸铜溶液反应的化学方程式为_______ 。
(1)亚磷酸是
(2)PCl3水解可制取亚磷酸,反应的化学方程式是
(3)在H3PO3溶液中存在电离平衡: H3PO3
 H++H2PO
H++H2PO
①某温度下0.10mol·L-1H3PO3溶液pH=1.6,即溶液中c(H+)=2.5
 10-2 mol·L-1,求该温度下,上述电离平衡的平衡常数K=
10-2 mol·L-1,求该温度下,上述电离平衡的平衡常数K= 只考虑H3PO3的第一步电离,结果保留两位有效数字
只考虑H3PO3的第一步电离,结果保留两位有效数字 。
。②Na2HPO3溶液中离子浓度由大到小的顺序是
(4)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:

①阴极的电极反应为
②产品室中反应的离子方程式为
(5)亚磷酸具有强还原性,可将
 还原为金属单质,亚磷酸与硫酸铜溶液反应的化学方程式为
还原为金属单质,亚磷酸与硫酸铜溶液反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】在常温25℃下,回答下列问题:
(1) 的水解常数
的水解常数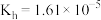 。含等物质的量浓度的
。含等物质的量浓度的 与
与 的混合溶液显
的混合溶液显________ (填“酸”“碱”或“中”)性,该溶液中各离子浓度由大到小的顺序为________________________ 。
(2) 可用氨水吸收生成
可用氨水吸收生成 ,将
,将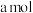
 溶于水,溶液显酸性,原因是
溶于水,溶液显酸性,原因是________________ (用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为________  (
( 的电离平衡常数取
的电离平衡常数取 )。
)。
(3)向氨水中加入 稀硫酸至溶液正好呈中性,则
稀硫酸至溶液正好呈中性,则
________ (填“>”“<”或“=”)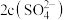 ,此时混合溶液中
,此时混合溶液中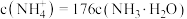 ,则
,则 的电离常数
的电离常数 为
为________ 。
氨气的催化氧化是工业制取硝酸的重要步骤,假设只会发生以下两个竞争反应Ⅰ、Ⅱ。
反应Ⅰ: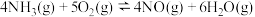

反应Ⅱ: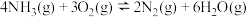

为分析某催化剂对该反应的选择性,将
 和
和
 充入2L密闭容器中,在不同温度,相同时间下,测得有关物质的量关系如图所示。
充入2L密闭容器中,在不同温度,相同时间下,测得有关物质的量关系如图所示。

(4)该催化剂在低温时对反应________ (填“Ⅰ”或“Ⅱ”)的选择性更好。
(5)高于840℃时, 的产率降低的可能原因是________。
的产率降低的可能原因是________。
(6) 也是造成水体富营养化的重要原因之一,用
也是造成水体富营养化的重要原因之一,用 溶液氧化可除去氨。为了提高氨的去除率,在实际工艺过程中温度控制在15℃~30℃时,其可能的原因是
溶液氧化可除去氨。为了提高氨的去除率,在实际工艺过程中温度控制在15℃~30℃时,其可能的原因是__________________________________ 。
(1)
 的水解常数
的水解常数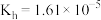 。含等物质的量浓度的
。含等物质的量浓度的 与
与 的混合溶液显
的混合溶液显(2)
 可用氨水吸收生成
可用氨水吸收生成 ,将
,将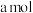
 溶于水,溶液显酸性,原因是
溶于水,溶液显酸性,原因是 (
( 的电离平衡常数取
的电离平衡常数取 )。
)。(3)向氨水中加入
 稀硫酸至溶液正好呈中性,则
稀硫酸至溶液正好呈中性,则
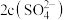 ,此时混合溶液中
,此时混合溶液中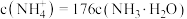 ,则
,则 的电离常数
的电离常数 为
为氨气的催化氧化是工业制取硝酸的重要步骤,假设只会发生以下两个竞争反应Ⅰ、Ⅱ。
反应Ⅰ:
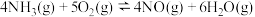

反应Ⅱ:

为分析某催化剂对该反应的选择性,将

 和
和
 充入2L密闭容器中,在不同温度,相同时间下,测得有关物质的量关系如图所示。
充入2L密闭容器中,在不同温度,相同时间下,测得有关物质的量关系如图所示。
(4)该催化剂在低温时对反应
(5)高于840℃时,
 的产率降低的可能原因是________。
的产率降低的可能原因是________。A. 溶于水 溶于水 | B.反应活化能增大 |
| C.反应Ⅰ的平衡常数变小 | D.催化剂活性降低 |
(6)
 也是造成水体富营养化的重要原因之一,用
也是造成水体富营养化的重要原因之一,用 溶液氧化可除去氨。为了提高氨的去除率,在实际工艺过程中温度控制在15℃~30℃时,其可能的原因是
溶液氧化可除去氨。为了提高氨的去除率,在实际工艺过程中温度控制在15℃~30℃时,其可能的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。回答下列问题
(1)利用甲烷催化可还原NOx,相关反应如下
N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H=-1160kJ·mol-1
写出常温常压下,甲烷完全燃烧的热化学方程式:_______ 。
(2)在催化剂条件下,可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g)。分别在T1、T2两个温度下,向容积均为2L的甲、乙两个恒容密闭容器中分别充入0.20 mol NO(g)和0.20 mol CO(g)。反应过程中两容器中CO2的物质的量浓度随时间的变化关系如图所示。

①甲容器中,用NO表示5min内反应速率为_____ 。
②T1___ (填“>”或“<”)T2,该反应是_____ (填“吸热”或“放热”)反应。
③T2温度时,该反应的平衡常数是_____ L/mol(结果保留小数点后两位),与T2时相比,T1温度时的平衡常数更___ (填“大”或“小”)。
④乙容器达到平衡后,再充入0.10mlNO和0.10molCO2,此时υ(正)___ (填“>”或“<”)v(逆)。
(3)NO2和NO的混合物可被NaOH吸收生成NaNO2。已知HNO2是一元弱酸,写出NaNO2溶液中离子浓度的大小关系:___ 。常温下,pH=9的NaNO2溶液中,c(Na+)—c(NO2-)=_______ (列出数学计算式)。
(1)利用甲烷催化可还原NOx,相关反应如下
N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H=-1160kJ·mol-1
写出常温常压下,甲烷完全燃烧的热化学方程式:
(2)在催化剂条件下,可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g)。分别在T1、T2两个温度下,向容积均为2L的甲、乙两个恒容密闭容器中分别充入0.20 mol NO(g)和0.20 mol CO(g)。反应过程中两容器中CO2的物质的量浓度随时间的变化关系如图所示。

①甲容器中,用NO表示5min内反应速率为
②T1
③T2温度时,该反应的平衡常数是
④乙容器达到平衡后,再充入0.10mlNO和0.10molCO2,此时υ(正)
(3)NO2和NO的混合物可被NaOH吸收生成NaNO2。已知HNO2是一元弱酸,写出NaNO2溶液中离子浓度的大小关系:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】电化学知识在物质制备领域的应用前景看好。
(1)从环境保护的角度看,制备一种新型多功能水处理剂高铁酸钠(Na2FeO4)较好的方法为电解法,其装置如图①所示。其总反应方程式为:Fe+2OH-+2H2O= +3H2↑。
+3H2↑。

①电解过程中Fe作______ 极,电极反应式为_________ ;离子交换膜为______ 离子交换膜(填“阳”、“阴”);电解时阳极区pH_____ 、阴极区pH_____ (填升高、降低、不变)。
②“镁一次氯酸盐”燃料电池也可为图①装置提供电能,该电池电极为镁合金和铂合金,其工作原理如图②所示。b为该燃料电池的______ (填“正”或“负”)极。当有49.8gNa2FeO4生成时消耗C1O-的物质的量为_____ mol;若用此燃料电池,采用电解法来处理酸性含铬废水(主要含有 )。处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-8mol/L时,Cr3+沉淀完全,此时溶液的pH=
)。处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-8mol/L时,Cr3+沉淀完全,此时溶液的pH=________ (已知Ksp[Cr(OH)3]=1.0×10-32)

(2)电解Na2SO4溶液生产H2SO4和烧碱的装置如图③所示(已知:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过),其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为2:1。则丁为________ ;c极的电极反应式为________ ;电解一段时间,当产生0.2mol气体乙时,通过离子交换膜e的离子的质量为_____ g。
(1)从环境保护的角度看,制备一种新型多功能水处理剂高铁酸钠(Na2FeO4)较好的方法为电解法,其装置如图①所示。其总反应方程式为:Fe+2OH-+2H2O=
 +3H2↑。
+3H2↑。
①电解过程中Fe作
②“镁一次氯酸盐”燃料电池也可为图①装置提供电能,该电池电极为镁合金和铂合金,其工作原理如图②所示。b为该燃料电池的
 )。处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-8mol/L时,Cr3+沉淀完全,此时溶液的pH=
)。处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-8mol/L时,Cr3+沉淀完全,此时溶液的pH=
(2)电解Na2SO4溶液生产H2SO4和烧碱的装置如图③所示(已知:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过),其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为2:1。则丁为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
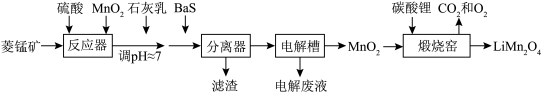
【推荐2】LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如图:
已知:①Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.0×10-32,Ksp[Ni(OH)2]=5.5×10-16。
②已知亚铁离子沉淀的pH范围是8~9之间
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为___________ ,硫酸不能太浓且反应温度不宜太高,原因是___________ 。
(2)加入少量二氧化锰的作用是把亚铁离子氧化成正三价铁离子,写出该反应的离子方程式___________ ,不用双氧水氧化亚铁离子的原因是___________ 。
(3)溶矿反应完成后,调pH≈7,可完全沉淀的离子是___________ ,通过列式计算说明理由___________ (离子浓度小于10-5mol/L即可认为完全沉淀)。
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有___________ 。
(5)煅烧窑中,生成LiMn2O4反应的化学方程式是___________ 。

已知:①Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.0×10-32,Ksp[Ni(OH)2]=5.5×10-16。
②已知亚铁离子沉淀的pH范围是8~9之间
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为
(2)加入少量二氧化锰的作用是把亚铁离子氧化成正三价铁离子,写出该反应的离子方程式
(3)溶矿反应完成后,调pH≈7,可完全沉淀的离子是
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有
(5)煅烧窑中,生成LiMn2O4反应的化学方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】孔雀石主要成分是 ,还含少量
,还含少量 及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:

有关物质沉淀的pH数据如下:
(1)步骤Ⅰ加稀硫酸充分反应,提高步骤Ⅰ反应速率的措施是_______ (写一条即可)。
(2)步骤Ⅱ中试剂①应选用试剂_______ (填代号)。
a. b.稀
b.稀 c.双氧水 d.氯水
c.双氧水 d.氯水
相关反应的离子方程式为:_______ 。
(3)步骤Ⅲ加入CuO调节溶液的pH至_______ (填写范围),目的是_______ 。
(4)从滤液3中获得干燥的硫酸铜晶体的操作是_______ 。
(5)常温下 的
的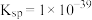 ,若要将溶液中的
,若要将溶液中的 转化为
转化为 沉淀,使溶液中
沉淀,使溶液中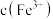 降低至
降低至 ,必须将溶液调节至
,必须将溶液调节至
_______ 。
(6)用 和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的
和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的 可以产生
可以产生 金属铜,则该反应的化学方程式为
金属铜,则该反应的化学方程式为_______ 。
 ,还含少量
,还含少量 及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
有关物质沉淀的pH数据如下:
| 物质 |  开始沉淀 开始沉淀 |  完全沉淀 完全沉淀 |
 | 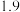 |  |
 | 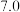 |  |
 |  | 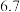 |
(1)步骤Ⅰ加稀硫酸充分反应,提高步骤Ⅰ反应速率的措施是
(2)步骤Ⅱ中试剂①应选用试剂
a.
 b.稀
b.稀 c.双氧水 d.氯水
c.双氧水 d.氯水相关反应的离子方程式为:
(3)步骤Ⅲ加入CuO调节溶液的pH至
(4)从滤液3中获得干燥的硫酸铜晶体的操作是
(5)常温下
 的
的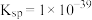 ,若要将溶液中的
,若要将溶液中的 转化为
转化为 沉淀,使溶液中
沉淀,使溶液中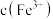 降低至
降低至 ,必须将溶液调节至
,必须将溶液调节至
(6)用
 和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的
和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的 可以产生
可以产生 金属铜,则该反应的化学方程式为
金属铜,则该反应的化学方程式为
您最近一年使用:0次



