1 . 室温下,探究0.1 mol·L-1 Na2SO3溶液的性质,下列实验方案能达到探究目的的是
| 选项 | 探究目的 | 实验方案 |
| A | 溶液中是否含有 | 向2 mL Na2SO3溶液中滴加几滴稀硝酸酸化,再滴加Ba(NO3)2溶液,观察沉淀生成情况 |
| B |  是否具有漂白性 是否具有漂白性 | 向溴水中滴加足量Na2SO3溶液,观察溶液颜色变化 |
| C |  是否有还原性 是否有还原性 | 向2 mL Na2SO3溶液中滴加5~6滴酸性KMnO4溶液,观察溶液颜色变化 |
| D |  是否有氧化性 是否有氧化性 | 向2 mL Na2SO3溶液中滴加几滴Na2S溶液,观察沉淀生成情况 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 焦亚硫酸钠(Na2S2O5)常用作葡萄酒、果脯等食品的抗氧化剂。
I.焦亚硫酸钠的制备
已知:①Na2S2O5在空气中、受热时均易分解。
②生成Na2S2O5的化学方程式为2NaHSO3=Na2S2O5+H2O。
③水溶液中H2SO3、HSO 、SO
、SO 的物质的量分数随pH的分布如图1所示。
的物质的量分数随pH的分布如图1所示。
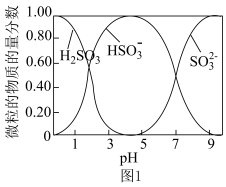
(1)SO2与Na2CO3过饱和溶液反应生成NaHSO3和CO2,其离子方程式为___________ 。
(2)实验室制备少量Na2S2O5的装置如图2所示,请补充完整相应实验方案:在不断搅拌下,控制反应温度在40℃左右,___________ ,20℃静置结晶,经减压抽滤、洗涤、25~30 ℃干燥,可获得Na2S2O5固体。
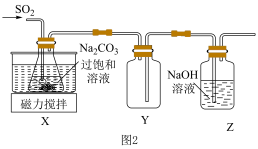
(3)实验制得的Na2S2O5固体中含有一定量的Na2SO4,其原因是___________ 。
Ⅱ.焦亚硫酸钠含量的测定
工业焦亚硫酸钠优质品要求质量分数≥96.5%。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为:
Na2S2O5+CH3COOH+I2+H2O—H2SO4+HI+CH3COONa(未配平);
I2+2Na2S2O3=Na2S4O6+2NaI。
准确称取0.1950g样品,快速置于预先加入30.00 mL 0.100 0 mol·L-1碘标准液及20 mL水的250 mL碘量瓶中,加入5 mL乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处放置5 min;用0.1000 mol·L-1 Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00 mL。
(4)滴定终点现象是___________ 。
(5)通过计算判断该样品是否为优质品是___________ (写出计算过程)。
I.焦亚硫酸钠的制备
已知:①Na2S2O5在空气中、受热时均易分解。
②生成Na2S2O5的化学方程式为2NaHSO3=Na2S2O5+H2O。
③水溶液中H2SO3、HSO
 、SO
、SO 的物质的量分数随pH的分布如图1所示。
的物质的量分数随pH的分布如图1所示。
(1)SO2与Na2CO3过饱和溶液反应生成NaHSO3和CO2,其离子方程式为
(2)实验室制备少量Na2S2O5的装置如图2所示,请补充完整相应实验方案:在不断搅拌下,控制反应温度在40℃左右,

(3)实验制得的Na2S2O5固体中含有一定量的Na2SO4,其原因是
Ⅱ.焦亚硫酸钠含量的测定
工业焦亚硫酸钠优质品要求质量分数≥96.5%。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为:
Na2S2O5+CH3COOH+I2+H2O—H2SO4+HI+CH3COONa(未配平);
I2+2Na2S2O3=Na2S4O6+2NaI。
准确称取0.1950g样品,快速置于预先加入30.00 mL 0.100 0 mol·L-1碘标准液及20 mL水的250 mL碘量瓶中,加入5 mL乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处放置5 min;用0.1000 mol·L-1 Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00 mL。
(4)滴定终点现象是
(5)通过计算判断该样品是否为优质品是
您最近一年使用:0次
解题方法
3 . 如表所示有关物质检验的实验结论正确的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
| B | 向某溶液中加入盐酸,将生成的气体通入品红溶液中,品红溶液褪色 | 该溶液一定含有 |
| C | 用洁净的铂丝棒蘸取某溶液在无色火焰上灼烧,未观察到紫色 | 该溶液中不含有K+ |
| D | 将SO2通入Na2CO3溶液中生成的气体,先通入足量的酸性KMnO4溶液,再通入澄清石灰水中有浑浊 | 说明酸性H2SO3>H2CO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-05-20更新
|
103次组卷
|
2卷引用:江苏省无锡先锋高级中2020-2021学年高一下学期第一次月考化学试题
4 . 下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 | 部分Na2SO3被氧化 |
| B | 向蓝色石蕊试纸上滴加新制氯水,试纸边缘呈红色,中间为白色 | 氯水既有酸性又有还原性 |
| C | 取5mL0.1mol•L−1KI溶液,加入1mL0.1mol•L−1FeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变成血红色 | Fe3+与I-所发生的反应为可逆逆反应 |
| D | 向盛有5mLAgNO3溶液的试管中滴入几滴等浓度的NaCl溶液,产生白色沉淀,继续滴加几滴NaI溶液有黄色沉淀产生 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 化学还原法是处理含Cr2O 的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
Cr2O
 Cr3+
Cr3+ Cr(OH)3
Cr(OH)3
已知:①Na2S2O5+H2O=2NaHSO3
②“COD”是指化学需氧量,反映了水样中较强还原性物质含量的多少。水中还原性物质越少,则COD越低,表明水质污染程度越小。
(1)取含Cr2O 的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
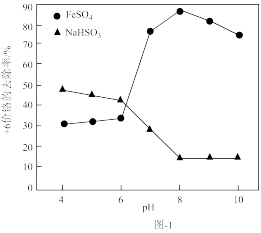
①在酸性条件下,请写出NaHSO3与Cr2O 反应的离子方程式:
反应的离子方程式:___ 。
②分析比较亚铁盐和亚硫酸盐去除+6价Cr的效果。
Ⅰ.亚铁盐在中性和碱性条件下,对+6价Cr的去除效果优于酸性条件下的去除效果,亚硫酸盐则相反;
Ⅱ.___ 。
(2)用焦亚硫酸钠(Na2S2O5)处理废水后,可能会使废水中的COD增大。在焦亚硫酸钠与废水中铬元素不同质量比的情况下,加H2SO4与未加H2SO4处理含铬废水后其COD对比变化如图-2所示。
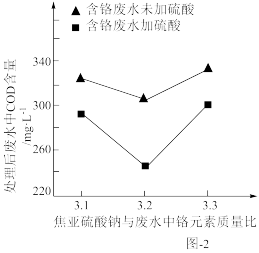
①未加H2SO4时,随着Na2S2O5质量增大,废水COD增大的原因是___ 。
②在焦亚硫酸钠与废水质量比相同的情况下,加H2SO4时,与未加H2SO4相比,废水COD均有所下降,原因可能是___ 。
(3)三价铬[Cr(Ⅲ)]在水溶液中的存在形态随pH的变化如图-3所示,为尽可能除去铬元素实现达标排放,沉淀过程中pH要控制在___ ;若pH过高,溶液中残留铬量增大,其原因为___ 。
 的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
的工业废水常用的方法,主要分为“还原”和“沉淀”两步:Cr2O

 Cr3+
Cr3+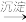 Cr(OH)3
Cr(OH)3已知:①Na2S2O5+H2O=2NaHSO3
②“COD”是指化学需氧量,反映了水样中较强还原性物质含量的多少。水中还原性物质越少,则COD越低,表明水质污染程度越小。
(1)取含Cr2O
 的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
①在酸性条件下,请写出NaHSO3与Cr2O
 反应的离子方程式:
反应的离子方程式:②分析比较亚铁盐和亚硫酸盐去除+6价Cr的效果。
Ⅰ.亚铁盐在中性和碱性条件下,对+6价Cr的去除效果优于酸性条件下的去除效果,亚硫酸盐则相反;
Ⅱ.
(2)用焦亚硫酸钠(Na2S2O5)处理废水后,可能会使废水中的COD增大。在焦亚硫酸钠与废水中铬元素不同质量比的情况下,加H2SO4与未加H2SO4处理含铬废水后其COD对比变化如图-2所示。

①未加H2SO4时,随着Na2S2O5质量增大,废水COD增大的原因是
②在焦亚硫酸钠与废水质量比相同的情况下,加H2SO4时,与未加H2SO4相比,废水COD均有所下降,原因可能是
(3)三价铬[Cr(Ⅲ)]在水溶液中的存在形态随pH的变化如图-3所示,为尽可能除去铬元素实现达标排放,沉淀过程中pH要控制在

您最近一年使用:0次
2020-11-19更新
|
489次组卷
|
5卷引用:江苏省无锡市2021届高三上学期期中考试化学(选修)试题
江苏省无锡市2021届高三上学期期中考试化学(选修)试题江苏省无锡市2020-2021学年高三上学期期中考试化学试题江苏省徐州市王杰中学2021届高三12月份阶段性检测化学试题(已下线)化学-2023年高考押题预测卷01(江苏卷)(含考试版、全解全析、参考答案、答题卡)江苏省前黄高级中学2022-2023学年高三下学期二模适应性考试化学试题



