1 . 室温下,探究向5mL0.50mol/LNa2SO3溶液中滴加2滴0.50mol/LFeCl3溶液后的产物,下列实验方案和结论不正确的是
| 选项 | 实验方案 | 实验结论 |
| A | 取反应后的上层清液,先加入盐酸,后加入BaCl2溶液,没有白色沉淀生成。 | 没有生成Na2SO4 |
| B | 滴加FeCl3溶液后,立即用激光灯照射,观察到一条光亮的通路。 | 生成了Fe(OH)3胶体 |
| C | 向反应后的溶液中滴加几滴酸性KMnO4溶液,紫红色褪去。 | 混合液含有Fe2+ |
| D | 将等体积的Na2SO3溶液和FeCl3溶液混合放置一小时后,溶液变为淡绿色。 | Na2SO3能还原FeCl3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 实验室模拟“镁法工业烟气脱硫”并制备MgSO4∙H2O,其实验过程可表示如下:

(1)在搅拌下向氧化镁浆料[主要成分为Mg(OH)2]中匀速缓慢通入SO2气体,生成 。
。
①“吸收”过程中,发生的主要反应的化学方程式为___________ ;
②64gSO2在标准状况下的体积约为___________ L;
③NaOH溶液也可以用于捕集SO2,配制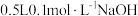 溶液,需NaOH
溶液,需NaOH___________ g;
(2)在催化剂作用下MgSO3被O2氧化为MgSO4。“氧化”过程若转移1mole⁻,则消耗标准状况下O2的体积约为___________ L;
(3)制取MgSO4∙H2O晶体。将氧化后溶液蒸发浓缩、降温至室温结晶,___________ (填写操作步骤),洗涤,干燥,制得MgSO4∙H2O晶体;
(4)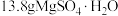 中所含Mg2+的物质的量为
中所含Mg2+的物质的量为___________ mol。

(1)在搅拌下向氧化镁浆料[主要成分为Mg(OH)2]中匀速缓慢通入SO2气体,生成
 。
。①“吸收”过程中,发生的主要反应的化学方程式为
②64gSO2在标准状况下的体积约为
③NaOH溶液也可以用于捕集SO2,配制
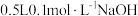 溶液,需NaOH
溶液,需NaOH(2)在催化剂作用下MgSO3被O2氧化为MgSO4。“氧化”过程若转移1mole⁻,则消耗标准状况下O2的体积约为
(3)制取MgSO4∙H2O晶体。将氧化后溶液蒸发浓缩、降温至室温结晶,
(4)
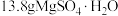 中所含Mg2+的物质的量为
中所含Mg2+的物质的量为
您最近一年使用:0次
2023-11-09更新
|
170次组卷
|
2卷引用:江苏省扬州市江都区2023-2024学年高一上学期期中考试化学试题
解题方法
3 . 下列物质的性质与用途具有对应关系的是
| A.NaHCO3受热易分解,可用于缓解胃酸过多 |
| B.Na2SO3具有还原性,可用作脱氧剂 |
| C.NaOH具有强碱性,可用作干燥剂 |
| D.Na2O2为淡黄色固体,可用作供氧剂 |
您最近一年使用:0次
4 . 下列物质的性质与用途对应关系,说法错误的是
| A.常温下浓硫酸能钝化铝,可用铝槽车贮运浓硫酸 |
| B.钠钾合金常温下呈液态,导热性好,可用于快中子反应堆的热交换剂 |
| C.Na2SO3具有还原性,可用于废水脱氯(Cl2) |
| D.NaHCO3能与碱反应,可用作抗酸药 |
您最近一年使用:0次
5 . 下列钠的化合物的性质与用途具有对应关系的是
A. 易溶于水,可用于工业电解制备钠 易溶于水,可用于工业电解制备钠 |
B. 有强氧化性,可用于消毒杀菌 有强氧化性,可用于消毒杀菌 |
C. 有还原性,可用于漂白纸浆 有还原性,可用于漂白纸浆 |
D. 受热易分解,可用于制胃酸中和剂 受热易分解,可用于制胃酸中和剂 |
您最近一年使用:0次
真题
名校
6 . 工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是
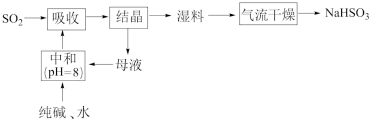
| A.吸收过程中有气体生成 | B.结晶后母液中含有NaHCO3 |
| C.气流干燥湿料时温度不宜过高 | D.中和后溶液中含Na2SO3和NaHCO3 |
您最近一年使用:0次
2021-06-29更新
|
13524次组卷
|
39卷引用:江苏省扬州市广陵区名校2022-2023学年高一上学期12月月考化学试题
江苏省扬州市广陵区名校2022-2023学年高一上学期12月月考化学试题2021年新高考山东化学高考真题(已下线)课时22 硫及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题12 硫及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练江西省赣县第三中学2021-2022学年高二上学期入学考试化学试题(已下线)专题12 工艺流程选择题-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)第四单元 非金属及其化合物(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)安徽省合肥市第一中学2021-2022学年高三上学期10月月考化学试题内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题2021年山东高考化学试题变式题1-10(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)卷09 物质的分离、提纯-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)卷05 工艺流程型选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)卷05 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷03题 元素化合物的性质-备战2022年高考化学临考题号押题(新高考通版)上海市奉贤区2022届高三下学期等级考二模化学试题(已下线)微专题21 二氧化硫性质四重性探究-备战2023年高考化学一轮复习考点微专题(已下线)第13讲 硫及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第12练 硫及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)微专题30 非金属及其化合物制备流程与实验探究(S、Se、Te、Cl、Br、I)-备战2023年高考化学一轮复习考点微专题新疆乌鲁木齐市第八中学2022-2023学年高三上学期第一次月考化学试题(已下线)易错点34 化学实验方案的设计与评价-备战2023年高考化学考试易错题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)专题14 工艺流程选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)第四章 非金属及其化合物 第20讲 硫及其氧化物(已下线)上海市静安区2022-2023学年高三下学期二模变式题(选择题11-15)(已下线)专题10 物质的反应及转化(已下线)专题10 物质的反应及转化(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 硫及其重要化合物(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)四川省宜宾市叙州区第一中学校2022-2023学年高一下学期6月期末考试化学试题新疆石河子第一中学2023-2024学年高三上学期第三次月考化学试题山东省潍坊市昌乐二中2023-2024学年高三上学期第一次月考化学试题北京市中国人民大学附属中学2023-2024学年高三上学期11月统练三 化学试题天津市第一中学2023-2024学年高二上学期11月期中考试化学试题河南省信阳高级中学2023-2024学年高三上学期1月月考理综试题-高中化学江苏省常州市田家炳2高级中学023-2024学年高一上学期12月阶段性调研化学学科试卷
解题方法
7 . 对下列实验现象或事实解释不 正确的是
| 选项 | 实验现象或事实 | 解释 |
| A | N2转化为N,通常需要高温或放电条件 | N2分子中叁键的键能大 |
| B | 干冰用作制冷剂 | 干冰升华吸热,导致环境温度降低 |
| C | 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 | 部分Na2SO3被氧化 |
| D | 0.1mol·L-1H2C2O4溶液和0.1mol·L-1 HNO3溶液的pH分别为1.3和1.0 | N的非金属性强于C |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . Na2S2O3俗称大苏打(海波),是重要的化工原料,无色易溶于水,不溶于乙醇,在中性或碱性环境中稳定,在40~45 ℃熔化,48 ℃分解。实验室用Na2SO3和过量硫粉(不溶于水,可溶于乙醇)在水溶液中加热反应制取Na2S2O3·5H2O晶体【Na2SO3(aq)+S(s)  Na2S2O3(aq)】的步骤如下:
Na2S2O3(aq)】的步骤如下:
① 称取一定量的Na2SO3于烧杯中,溶于水。
② ②另取过量的硫粉,用少许乙醇润湿后,加到上述溶液中。
③ 如图2所示(部分装置略去),水浴加热,微沸,反应后趁热过滤。
④ 滤液在经过相关实验操作后析出Na2S2O3·5H2O晶体。
⑤ 进行减压过滤并低温干燥。
(图1是有关物质的溶解度曲线)
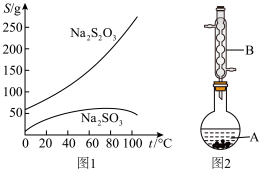
(1) 图2中,仪器B的名称是___________ 。
(2) 实验步骤②中,加入的硫粉用乙醇润湿的目的是___________ 。
(3) 实验步骤③中,趁热过滤的原因是___________ 。
(4) 实验步骤④中,应采取的相关实验操作为___________ 。
(5) 实验步骤⑤中,采用低温干燥的目的是___________ 。
(6) 产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是___________ 。
(7) 准确称取2.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol·L-1碘的标准溶液滴定。反应原理为2S2O +I2=S4O
+I2=S4O +2I-。滴定至终点时,溶液颜色的变化是
+2I-。滴定至终点时,溶液颜色的变化是___________ 。消耗碘的标准溶液体积为36.00 mL,产品的纯度为___________ 。
 Na2S2O3(aq)】的步骤如下:
Na2S2O3(aq)】的步骤如下:① 称取一定量的Na2SO3于烧杯中,溶于水。
② ②另取过量的硫粉,用少许乙醇润湿后,加到上述溶液中。
③ 如图2所示(部分装置略去),水浴加热,微沸,反应后趁热过滤。
④ 滤液在经过相关实验操作后析出Na2S2O3·5H2O晶体。
⑤ 进行减压过滤并低温干燥。
(图1是有关物质的溶解度曲线)

(1) 图2中,仪器B的名称是
(2) 实验步骤②中,加入的硫粉用乙醇润湿的目的是
(3) 实验步骤③中,趁热过滤的原因是
(4) 实验步骤④中,应采取的相关实验操作为
(5) 实验步骤⑤中,采用低温干燥的目的是
(6) 产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是
(7) 准确称取2.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol·L-1碘的标准溶液滴定。反应原理为2S2O
 +I2=S4O
+I2=S4O +2I-。滴定至终点时,溶液颜色的变化是
+2I-。滴定至终点时,溶液颜色的变化是
您最近一年使用:0次
2020-12-28更新
|
301次组卷
|
7卷引用:江苏省扬州市公道中学2020-2021学年下学期高二第二次学情测试化学试题
名校
9 . 下列有关化学反应的叙述正确的是( )
| A.Fe在氧气中燃烧生成黑色Fe3O4 |
| B.SO2与BaCl2溶液反应生成BaSO3沉淀 |
| C.常温下,Cu与浓H2SO4反应生成SO2 |
| D.向新制的FeCl2溶液中滴加NH4SCN溶液,溶液显红色 |
您最近一年使用:0次
解题方法
10 . 有效脱除烟气中的SO2是环境保护的重要课题。
(1)氨水可以脱除烟气中的SO2。氨水脱硫的相关热化学方程式如下:
2NH3(g) +H2O(l) +SO2(g) =(NH4)2SO3(aq) ΔH= akJ·mol−1
(NH4)2SO3(aq)+H2O(l) +SO2(g) =2NH4HSO3(aq) ΔH = bkJ·mol−1
2(NH4)2SO3(aq) +O2(g) =2(NH4)2SO4(aq) ΔH =ckJ·mol−1
反应NH3(g) +NH4HSO3(aq) + O2(g) = (NH4)2SO4(aq)的ΔH=
O2(g) = (NH4)2SO4(aq)的ΔH=____ kJ·mol−1。

已知:SO2的国家排放标准为80mg·m−3。氨水脱除烟气中的SO2是在吸收塔中进行的,控制其他实验条件相同,仅改变吸收塔的温度,实验结果如题图-1所示,为了尽可能获得NH4HSO3,则吸收塔合适的温度约为________ 。
A.25℃ B.31℃ C.35℃
(2)电解法可以脱除烟气中的SO2。用Na2SO4溶液吸收烟气中的SO2,使用惰性电极电解吸收后的溶液,H2SO3在阴极被还原为硫单质,阴极的电极反应式为_______ 。
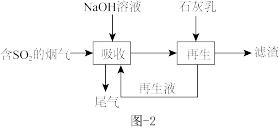
(3)钠钙双碱法可高效脱除烟气中的SO2,脱硫的流程如题图-2所示。
①“吸收”时气液逆流在吸收塔中接触,吸收时不宜直接使用石灰乳的原因是_______ 。

②水溶液中H2SO3、HSO 、SO
、SO 随pH的分布如题图−3所示,“再生液”用NaOH溶液调pH至7~9得到溶液X,溶液X吸收SO2时主要反应的离子方程式为
随pH的分布如题图−3所示,“再生液”用NaOH溶液调pH至7~9得到溶液X,溶液X吸收SO2时主要反应的离子方程式为______ 。
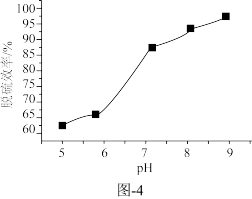
③已知Na2SO3的溶解度随着pH增大而减小。溶液X的pH对脱硫效率的影响如题图-4所示。当pH由6升高到7时,脱硫效率迅速增大的原因为______ ;当pH大于7时,随pH增大脱硫效率增速放缓的原因为______ 。
(1)氨水可以脱除烟气中的SO2。氨水脱硫的相关热化学方程式如下:
2NH3(g) +H2O(l) +SO2(g) =(NH4)2SO3(aq) ΔH= akJ·mol−1
(NH4)2SO3(aq)+H2O(l) +SO2(g) =2NH4HSO3(aq) ΔH = bkJ·mol−1
2(NH4)2SO3(aq) +O2(g) =2(NH4)2SO4(aq) ΔH =ckJ·mol−1
反应NH3(g) +NH4HSO3(aq) +
 O2(g) = (NH4)2SO4(aq)的ΔH=
O2(g) = (NH4)2SO4(aq)的ΔH=
已知:SO2的国家排放标准为80mg·m−3。氨水脱除烟气中的SO2是在吸收塔中进行的,控制其他实验条件相同,仅改变吸收塔的温度,实验结果如题图-1所示,为了尽可能获得NH4HSO3,则吸收塔合适的温度约为
A.25℃ B.31℃ C.35℃
(2)电解法可以脱除烟气中的SO2。用Na2SO4溶液吸收烟气中的SO2,使用惰性电极电解吸收后的溶液,H2SO3在阴极被还原为硫单质,阴极的电极反应式为
(3)钠钙双碱法可高效脱除烟气中的SO2,脱硫的流程如题图-2所示。
①“吸收”时气液逆流在吸收塔中接触,吸收时不宜直接使用石灰乳的原因是


②水溶液中H2SO3、HSO
 、SO
、SO 随pH的分布如题图−3所示,“再生液”用NaOH溶液调pH至7~9得到溶液X,溶液X吸收SO2时主要反应的离子方程式为
随pH的分布如题图−3所示,“再生液”用NaOH溶液调pH至7~9得到溶液X,溶液X吸收SO2时主要反应的离子方程式为③已知Na2SO3的溶解度随着pH增大而减小。溶液X的pH对脱硫效率的影响如题图-4所示。当pH由6升高到7时,脱硫效率迅速增大的原因为

您最近一年使用:0次



