解题方法
1 . 分子的结构与物质性质之间存在紧密的联系。
(1)如图是部分主族元素氢化物的沸点变化趋势_______ ,其汽化过程中克服的作用力是 _______ 。
②氢化物b、c、d的沸点均高于同族其它元素氢化物的沸点,原因是_______ 。
③H2O的沸点高于HF,预测可能的原因是_______ 。
(2)如图是冰(H2O)和干冰(CO2)的结构模型。_______ (填字母序号)。
a.冰中氢键存在方向性,晶体有较大空隙,空间利用率低
b.水分子极性强,分子间作用力大
c.二氧化碳分子的质量大于水分子
d.干冰晶胞中二氧化碳分子堆积得更密集
(3)苯胺(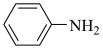 )与甲苯(
)与甲苯(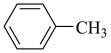 )的相对分子质量接近,但苯胺的熔点(﹣6.2℃)和沸点(184.4℃)高于甲苯的熔点(﹣95.0℃)和沸点(110.6℃),原因是
)的相对分子质量接近,但苯胺的熔点(﹣6.2℃)和沸点(184.4℃)高于甲苯的熔点(﹣95.0℃)和沸点(110.6℃),原因是 _______ 。
(1)如图是部分主族元素氢化物的沸点变化趋势
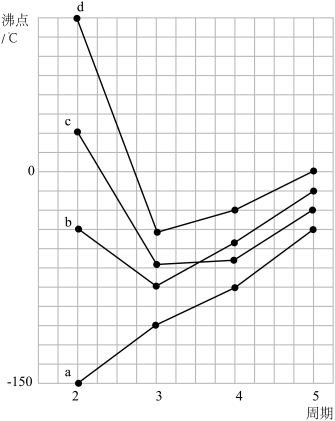
②氢化物b、c、d的沸点均高于同族其它元素氢化物的沸点,原因是
③H2O的沸点高于HF,预测可能的原因是
(2)如图是冰(H2O)和干冰(CO2)的结构模型。
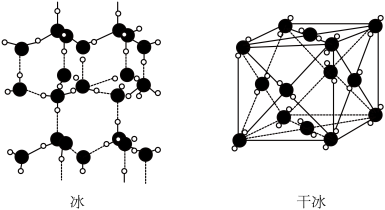
a.冰中氢键存在方向性,晶体有较大空隙,空间利用率低
b.水分子极性强,分子间作用力大
c.二氧化碳分子的质量大于水分子
d.干冰晶胞中二氧化碳分子堆积得更密集
(3)苯胺(
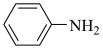 )与甲苯(
)与甲苯( )的相对分子质量接近,但苯胺的熔点(﹣6.2℃)和沸点(184.4℃)高于甲苯的熔点(﹣95.0℃)和沸点(110.6℃),原因是
)的相对分子质量接近,但苯胺的熔点(﹣6.2℃)和沸点(184.4℃)高于甲苯的熔点(﹣95.0℃)和沸点(110.6℃),原因是
您最近一年使用:0次
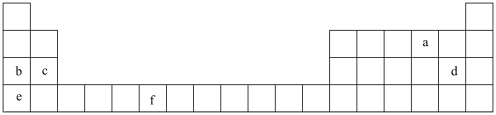
2 . 原子结构、元素性质、元素在周期表中的位置之间存在密切的相互关系。如图是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)a的原子结构示意图为___________ 。
(2)基态b原子核外电子占据的最高能级符号为_______ ,该能级的电子云轮廓图形状为 _______ 形。
(3)元素c位于周期表的_____ 区。
(4)元素b、d、e中电负性最大的是_______ (用元素符号表示)。
(5)基态f原子的价层电子排布式为___________ 。
(6)气态c原子失去核外不同电子所需能量如下:
①元素c的最高化合价为 _______ 。
②c原子的逐级电离能越来越大的原因是__________ 。
(1)a的原子结构示意图为
(2)基态b原子核外电子占据的最高能级符号为
(3)元素c位于周期表的
(4)元素b、d、e中电负性最大的是
(5)基态f原子的价层电子排布式为
(6)气态c原子失去核外不同电子所需能量如下:
| 电离能 | I1(第一电离能) | I2(第二电离能) | I3(第三电离能) |
| 能量/kJ•mol﹣1 | 737.7 | 1450.7 | 7732.7 |
②c原子的逐级电离能越来越大的原因是
您最近一年使用:0次
3 . 现有下列几种常见物质:①N2、②CO2、③NaCl、④H2O、⑤Cu。
(1)含有π键的是_______ (填序号,下同);
(2)含有非极性键的是_____ ;
(3)含有离子键的是_____ ;
(4)含有金属键的是_____ ;
(5)H2O中O原子杂化轨道类型是________ ,分子的空间结构为 _______ ,H﹣O﹣H键角 _____ (填“>”“=”或“<”)109°28',属于 _______ (“极性”或“非极性”)分子。
(1)含有π键的是
(2)含有非极性键的是
(3)含有离子键的是
(4)含有金属键的是
(5)H2O中O原子杂化轨道类型是
您最近一年使用:0次
解题方法
4 . 钛酸钙是一种典型的钙钛矿型半导体材料,其晶胞结构如图所示。下列关于钛酸钙说法不正确的是

| A.每个晶胞中含有3个O2﹣ |
| B.化学式为CaTiO3 |
| C.含有离子键 |
| D.晶体具有良好的导电性和延展性 |
您最近一年使用:0次
解题方法
5 . 下列关于核外电子运动状态的说法中,正确的是
| A.电子围绕原子核做有规律的圆周运动 |
| B.所有核外电子的能量均相同 |
| C.在不同能层上运动的电子具有不同的能量 |
| D.当电子逐渐靠近原子核时,会连续地吸收能量 |
您最近一年使用:0次
解题方法
6 . 某实验小组同学依据资料深入探究Fe3+在水溶液中的行为。
资料:ⅰ.Fe3+在水溶液中以[Fe(H2O)6]3的形式存在
ⅱ.[Fe(H2O)6]3+发生如下水解反应:[Fe(H2O)6]3++nH2O⇌[Fe(H2O)6(OH)n]3﹣n+nH3O+(n=0~6);
ⅲ.[FeCl4(H2O)2]﹣为黄色。
(1)配离子[Fe(H2O)6]3+的中心离子是_________ ,配体是 ________ ,配位数是 _____ 。
【实验一】分别向等浓度的Fe(NO3)3和FeCl3溶液中滴加硝酸,观察颜色变化。
(2)②中溶液褪色的原因是___________ 。
(3)③中溶液呈棕黄色与[FeCl4(H2O)2]﹣有关,支持此结论的实验现象是____________ 。
【实验二】分别以实验一①、③中的试剂作为待测液,用色度计测定其透光率。溶液透光率随温度变化曲线图如图(t1开始加热,t2停止加热;溶液颜色越深,透光率越低)。_______ (填“变浅”“变深”或“不变”)。
(5)由实验二,可以得出如下结论:
【结论1】FeCl3溶液中存在可逆反应:[Fe(H2O)6]3++4Cl﹣⇌[FeCl4(H2O)2]﹣+4H2O
得出此结论的理由是____________ 。
【结论2】结论1中反应的ΔH_______ (填“>0”或“<0”)。
(6)实验小组同学重新设计了一个实验,验证(5)中结论1。
实验方案:取①中溶液,____________________ (请描述必要的实验操作和现象)。
资料:ⅰ.Fe3+在水溶液中以[Fe(H2O)6]3的形式存在
ⅱ.[Fe(H2O)6]3+发生如下水解反应:[Fe(H2O)6]3++nH2O⇌[Fe(H2O)6(OH)n]3﹣n+nH3O+(n=0~6);
ⅲ.[FeCl4(H2O)2]﹣为黄色。
(1)配离子[Fe(H2O)6]3+的中心离子是
【实验一】分别向等浓度的Fe(NO3)3和FeCl3溶液中滴加硝酸,观察颜色变化。
| Ⅰ | ⅠI |
|
|
(2)②中溶液褪色的原因是
(3)③中溶液呈棕黄色与[FeCl4(H2O)2]﹣有关,支持此结论的实验现象是
【实验二】分别以实验一①、③中的试剂作为待测液,用色度计测定其透光率。溶液透光率随温度变化曲线图如图(t1开始加热,t2停止加热;溶液颜色越深,透光率越低)。

(5)由实验二,可以得出如下结论:
【结论1】FeCl3溶液中存在可逆反应:[Fe(H2O)6]3++4Cl﹣⇌[FeCl4(H2O)2]﹣+4H2O
得出此结论的理由是
【结论2】结论1中反应的ΔH
(6)实验小组同学重新设计了一个实验,验证(5)中结论1。
实验方案:取①中溶液,
您最近一年使用:0次
解题方法
7 . 氮元素能与金属或者非金属元素形成种类繁多、应用广泛的化合物。
(1)基态N原子的价层电子轨道表示式是___________ 。
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①在最简单的氮烯分子中,N的杂化方式是___________ 。
② 具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断
具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断 是否溶于水并说明理由
是否溶于水并说明理由___________ 。
(3)配合物 可用作广谱杀菌剂,其中Cu属于
可用作广谱杀菌剂,其中Cu属于___________ 区元素,该配合物中的配位原子是___________ ,配位数是___________ 。
(4) 的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是
的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是___________ 。
(5) 和
和 形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为
形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为 ,结构如图所示。
,结构如图所示。 最近的
最近的 有
有___________ 个。
②已知阿伏加德罗常数为 ,氮化镓(GaN)的摩尔质量为
,氮化镓(GaN)的摩尔质量为 ,该晶体的密度表达式为
,该晶体的密度表达式为___________  (
( )。
)。
(1)基态N原子的价层电子轨道表示式是
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①在最简单的氮烯分子中,N的杂化方式是
②
 具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断
具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断 是否溶于水并说明理由
是否溶于水并说明理由(3)配合物
 可用作广谱杀菌剂,其中Cu属于
可用作广谱杀菌剂,其中Cu属于(4)
 的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是
的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是(5)
 和
和 形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为
形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为 ,结构如图所示。
,结构如图所示。
 最近的
最近的 有
有②已知阿伏加德罗常数为
 ,氮化镓(GaN)的摩尔质量为
,氮化镓(GaN)的摩尔质量为 ,该晶体的密度表达式为
,该晶体的密度表达式为 (
( )。
)。
您最近一年使用:0次
名校
解题方法
8 . 大气中 含量的控制和
含量的控制和 资源化利用具有重要意义。
资源化利用具有重要意义。
(1) 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:
Ⅰ: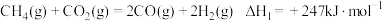
Ⅱ: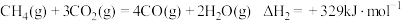
反应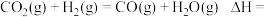
___________
(2)工业上可利用 制备
制备 :
:
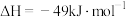
① 时,该反应的平衡常数
时,该反应的平衡常数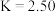 ,该温度下某时刻测得体系内四种物质的浓度均为
,该温度下某时刻测得体系内四种物质的浓度均为 ,则此时
,则此时
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②提高反应速率且增大 的平衡产率,可采取的措施
的平衡产率,可采取的措施___________ 。
A.升高反应温度
B.使用合适的催化剂
C.增大体系压强
D.从平衡体系中及时分离出
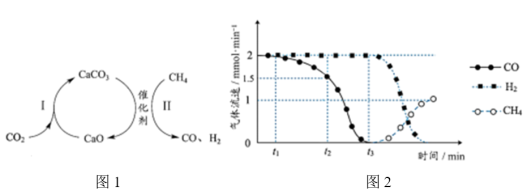
(3)一种捕获 并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以
并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了副反应(反应Ⅲ):
,在催化剂上有积碳,推测发生了副反应(反应Ⅲ): 。
。___________ 。
② 时间段内,反应Ⅱ速率减小至0的原因
时间段内,反应Ⅱ速率减小至0的原因___________ 。
③ 时刻,反应II和反应Ⅲ生成
时刻,反应II和反应Ⅲ生成 的速率之比为
的速率之比为___________ 。
(4)在铜基配合物的催化作用下,利用电化学原理可将 转化为碳基燃料(包括
转化为碳基燃料(包括 、烷烃和羧酸等),其装置原理如图所示。
、烷烃和羧酸等),其装置原理如图所示。___________ 。
②当有 通过质子交换膜时,理论上最多生成
通过质子交换膜时,理论上最多生成 的质量为
的质量为___________ 。
 含量的控制和
含量的控制和 资源化利用具有重要意义。
资源化利用具有重要意义。(1)
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:Ⅰ:
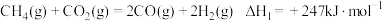
Ⅱ:
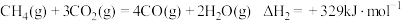
反应
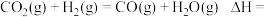
(2)工业上可利用
 制备
制备 :
:
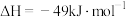
①
 时,该反应的平衡常数
时,该反应的平衡常数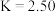 ,该温度下某时刻测得体系内四种物质的浓度均为
,该温度下某时刻测得体系内四种物质的浓度均为 ,则此时
,则此时
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②提高反应速率且增大
 的平衡产率,可采取的措施
的平衡产率,可采取的措施A.升高反应温度
B.使用合适的催化剂
C.增大体系压强
D.从平衡体系中及时分离出

(3)一种捕获
 并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以
并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了副反应(反应Ⅲ):
,在催化剂上有积碳,推测发生了副反应(反应Ⅲ): 。
。
②
 时间段内,反应Ⅱ速率减小至0的原因
时间段内,反应Ⅱ速率减小至0的原因③
 时刻,反应II和反应Ⅲ生成
时刻,反应II和反应Ⅲ生成 的速率之比为
的速率之比为(4)在铜基配合物的催化作用下,利用电化学原理可将
 转化为碳基燃料(包括
转化为碳基燃料(包括 、烷烃和羧酸等),其装置原理如图所示。
、烷烃和羧酸等),其装置原理如图所示。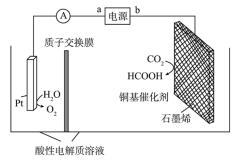
②当有
 通过质子交换膜时,理论上最多生成
通过质子交换膜时,理论上最多生成 的质量为
的质量为
您最近一年使用:0次
2024-04-10更新
|
293次组卷
|
2卷引用:北京市房山区2024届高三一模化学试题
名校
解题方法
9 . 探究同浓度的 与
与 溶液和不同盐溶液间的反应,①中产生白色沉淀和无色气体,②中只产生白色沉淀。(已知:碳酸铝在水溶液中不能稳定存在)
溶液和不同盐溶液间的反应,①中产生白色沉淀和无色气体,②中只产生白色沉淀。(已知:碳酸铝在水溶液中不能稳定存在)
 与
与 溶液和不同盐溶液间的反应,①中产生白色沉淀和无色气体,②中只产生白色沉淀。(已知:碳酸铝在水溶液中不能稳定存在)
溶液和不同盐溶液间的反应,①中产生白色沉淀和无色气体,②中只产生白色沉淀。(已知:碳酸铝在水溶液中不能稳定存在)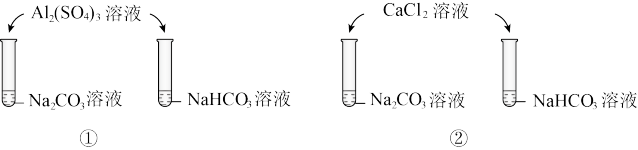
A.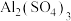 能促进 能促进 的水解 的水解 |
| B.①中沉淀可能是氢氧化铝和碱式碳酸铝中的一种或二者的混合物 |
C.同浓度的 与 与 溶液分别加入酚酞, 溶液分别加入酚酞, 溶液的红色深 溶液的红色深 |
D.②中 溶液滴入后, 溶液滴入后, 溶液的 溶液的 不变, 不变, 溶液的 溶液的 降低 降低 |
您最近一年使用:0次
2024-04-10更新
|
271次组卷
|
2卷引用:北京市房山区2024届高三一模化学试题
名校
10 . 丁烯二酸酐可通过不同的聚合方式合成以下两种聚合物,转化关系如图所示。
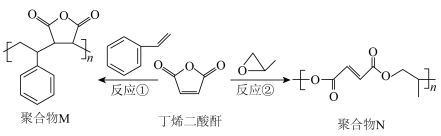
| A.反应①为加聚反应 |
| B.聚合物N在一定条件下还可以转化为交联结构 |
| C.聚合物M在碱性水溶液中的溶解程度比在水中的大 |
| D.依据反应②的合成原理,推测反应②会产生含七元环的副产物 |
您最近一年使用:0次
2024-04-10更新
|
345次组卷
|
2卷引用:北京市房山区2024届高三一模化学试题





