名校
1 . “84”消毒液是生活中常见的含氯消毒剂,呈无色或淡黄色,可由Cl2与NaOH溶液反应制得。回答下列问题:
I.
(1)Cl2与NaOH溶液反应制取“84”消毒液的离子方程式 为___________ 。
(2)“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中CO2使消毒杀菌能力增强,产物中有小苏打,请用化学方程式说明原因:___________ 。
II.实验室需使用480mL1.0mol/L的NaOH溶液来制备“84”消毒液。因此首先配制该NaOH溶液。
(3)实验必须用到的仪器有托盘天平、药匙、玻璃棒、烧杯、___________ 和___________ ,需要称量的NaOH固体的质量为___________ g。
(4)在配制氢氧化钠溶液时,有如下操作,正确的操作顺序是___________ (用字母符号 表示)。
A.盖好瓶塞,反复上下颠倒、摇匀
B.改用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶瓶颈上的刻度线相切
C.将已恢复至室温的溶液沿玻璃棒注入容量瓶中
D.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液全部注入容量瓶中,轻轻摇动容量瓶
E.将NaOH固体置于烧杯中准确称量,向烧杯中加入适量蒸馏水,慢慢搅拌,使其全部溶解
F.继续往容量瓶中加蒸馏水,直到液面接近瓶颈上的刻度线1~2cm处
(5)在配制上述溶液的实验中,下列操作会造成结果偏低的有___________ (填标号 )。
a.容量瓶洗净后未干燥就进行实验
b.NaOH溶解后未冷却至室温就立即进行后面的配制操作
c.定容时,仰视容量瓶刻度线
d.没有用蒸馏水洗涤烧杯2~3次
(6)将4gNaOH溶于___________ g水中,可使溶液中H2O与Na+的物质的量之比等于20:1.若测得该溶液的密度为1.1g/cm3,溶液中c(Na+)为___________ mol/L。
I.
(1)Cl2与NaOH溶液反应制取“84”消毒液的
(2)“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中CO2使消毒杀菌能力增强,产物中有小苏打,请用化学方程式说明原因:
II.实验室需使用480mL1.0mol/L的NaOH溶液来制备“84”消毒液。因此首先配制该NaOH溶液。
(3)实验必须用到的仪器有托盘天平、药匙、玻璃棒、烧杯、
(4)在配制氢氧化钠溶液时,有如下操作,正确的操作顺序是
A.盖好瓶塞,反复上下颠倒、摇匀
B.改用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶瓶颈上的刻度线相切
C.将已恢复至室温的溶液沿玻璃棒注入容量瓶中
D.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液全部注入容量瓶中,轻轻摇动容量瓶
E.将NaOH固体置于烧杯中准确称量,向烧杯中加入适量蒸馏水,慢慢搅拌,使其全部溶解
F.继续往容量瓶中加蒸馏水,直到液面接近瓶颈上的刻度线1~2cm处
(5)在配制上述溶液的实验中,下列操作会造成结果偏低的有
a.容量瓶洗净后未干燥就进行实验
b.NaOH溶解后未冷却至室温就立即进行后面的配制操作
c.定容时,仰视容量瓶刻度线
d.没有用蒸馏水洗涤烧杯2~3次
(6)将4gNaOH溶于
您最近一年使用:0次
名校
2 . 已知A是一种常见金属,B的俗称为磁性氧化铁,C溶液呈浅绿色。试根据图中转化关系,回答下列问题。

(1)检验D中阳离子的方法是___________ 。
(2)E在空气中放置容易转化为F,产生的现象为___________ 。
(3)写出A→B转化的化学方程式___________ 。
(4)写出C→D转化的离子方程式 ___________ 。

(1)检验D中阳离子的方法是
(2)E在空气中放置容易转化为F,产生的现象为
(3)写出A→B转化的化学方程式
(4)写出C→D转化的
您最近一年使用:0次
名校
解题方法
3 . 下列化学反应对应的离子方程式书写正确的是
| A.利用食醋除去水垢中的碳酸钙:CaCO3+2H+=Ca2++CO2↑+H2O |
| B.磁铁矿石溶于稀硝酸:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| C.CO2通入氯化钡溶液:Ba2++CO2+H2O=BaCO3↓+2H+ |
D.碳酸氢钙溶液和足量氢氧化钠溶液混合:Ca2++2 +2OH-=CaCO3↓+2H2O+ +2OH-=CaCO3↓+2H2O+ |
您最近一年使用:0次
4 . 分别将6滴饱和FeCl3溶液滴加到下列试剂中:①5mL20℃蒸馏水中;②5mL沸水中并加热至红褐色;③5mL20℃蒸馏水中,然后再加入少量0.1mol/L的NaOH溶液。下列有关相应分散系的说法正确的是
| A.分散质粒子直径:③>②>① |
| B.仅凭观察法不能将①②③三种分散系区分开 |
| C.用激光笔照射分散系,仅①中观察到光亮的通路 |
| D.向三种分散系中加入稀硝酸酸化的AgNO3溶液后,只有①中会产生白色沉淀 |
您最近一年使用:0次
名校
5 . 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
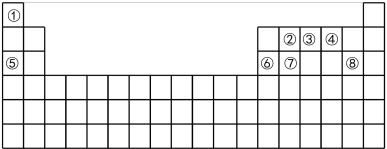
(1)写出元素⑥在周期表中的位置___________ 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________ (填化学式)。
(3)元素①与④能组成一种质子数为10、电子数也为10的微粒,写出元素⑤的单质和该微粒反应的化学方程式:___________ 。
(4)写出实验室制取元素⑧的单质的化学方程式:___________ 。
(5)碘(Ⅰ)在元素周期表中位于ⅦA族,是人体必需的微量元素之一、下列事实能够用“碘的非金属性比氯的弱”来解释的是___________ (填标号)。
a.Cl2能使淀粉KI试纸变蓝 b.HClO3的酸性强于HIO3
c.Cl2比I2更容易与H2化合 d.HCl比HI更不易分解

(1)写出元素⑥在周期表中的位置
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)元素①与④能组成一种质子数为10、电子数也为10的微粒,写出元素⑤的单质和该微粒反应的化学方程式:
(4)写出实验室制取元素⑧的单质的化学方程式:
(5)碘(Ⅰ)在元素周期表中位于ⅦA族,是人体必需的微量元素之一、下列事实能够用“碘的非金属性比氯的弱”来解释的是
a.Cl2能使淀粉KI试纸变蓝 b.HClO3的酸性强于HIO3
c.Cl2比I2更容易与H2化合 d.HCl比HI更不易分解
您最近一年使用:0次
6 . 二氧化氯ClO2是一种黄绿色气体,在工业上常用作水处理剂、漂白剂。在处理废水时,ClO2可将废水中的CN-(其中C为+2价)氧化成CO2和N2,其离子方程式为xClO2+yCN-=2CO2+N2+2Cl-。下列说法错误 的是
| A.x=y=2 |
| B.氧化性:ClO2>CO2 |
| C.氧化产物与还原产物的个数比为3:2 |
| D.当生成1molN2分子时,转移6mol电子 |
您最近一年使用:0次
2024-01-18更新
|
132次组卷
|
3卷引用: 天津市武清区杨村第一中学2023-2024学年高一上学期第三次阶段检测化学试题
名校
解题方法
7 . 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为离子交换膜。请按要求回答相关问题:
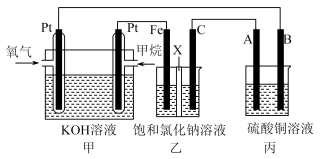
(1)甲烷燃料电池负极反应式是___________ 。
(2)Fe电极的电极反应式为___________ 。
(3)X选择___________ 离子交换膜(填“阴”,“阳”)。
(4)丙模拟粗铜的精炼,那么粗铜放在___________ (填“A”,“B”)极,反应结束后硫酸铜溶液的浓度___________ (填“变大”,“变小”,“不变”)。
(5)若在标准状况下,有1.12 L氧气参加反应,则乙装置中铁极上生成的气体体积为___________ L。
(6)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
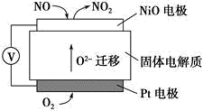
①Pt电极上发生的是___________ 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:___________ 。

(1)甲烷燃料电池负极反应式是
(2)Fe电极的电极反应式为
(3)X选择
(4)丙模拟粗铜的精炼,那么粗铜放在
(5)若在标准状况下,有1.12 L氧气参加反应,则乙装置中铁极上生成的气体体积为
(6)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是
②写出NiO电极的电极反应式:
您最近一年使用:0次
名校
解题方法
8 . 汽车发动机代用燃料包括乙醇、氢气和甲烷等。回答下列问题:
(1)在25℃、 下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量
下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量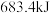 ,则乙醇燃烧热的热化学方程式为
,则乙醇燃烧热的热化学方程式为___________ 。
(2)根据图甲中的能量关系,可求得 键的键能为
键的键能为___________  。
。

(3)甲烷完全燃烧反应的能量关系如图乙所示。

①

___________ (用含 和
和 的关系式表示)。
的关系式表示)。
②为提高燃料利用率,加入甲烷燃烧的催化剂,则
___________ (填“变大”、“变小”或“不变”,下同),该反应的
___________ 。
(4)已知氢气的燃烧热为 ,甲烷的燃烧热为
,甲烷的燃烧热为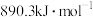 ,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点:
,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点:___________ 。
(5)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:___________ 。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是___________ ,元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(1)在25℃、
 下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量
下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量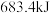 ,则乙醇燃烧热的热化学方程式为
,则乙醇燃烧热的热化学方程式为(2)根据图甲中的能量关系,可求得
 键的键能为
键的键能为 。
。
(3)甲烷完全燃烧反应的能量关系如图乙所示。

①


 和
和 的关系式表示)。
的关系式表示)。②为提高燃料利用率,加入甲烷燃烧的催化剂,则


(4)已知氢气的燃烧热为
 ,甲烷的燃烧热为
,甲烷的燃烧热为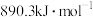 ,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点:
,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点:(5)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是
您最近一年使用:0次
名校
解题方法
9 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态Na原子的价层电子轨道表示式为___________ 。
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式: ,加入
,加入 的目的是
的目的是___________ 。
(3) 的电子式为
的电子式为___________ 。在25℃和101kPa时,Na与 反应生成1mol
反应生成1mol  放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式:___________ 。
(4)采用空气和Na为原料可直接制备 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过___________ 、___________ (填序号)
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(5)用“>”或“<”填空:
第一电离能:P___________ S,离子半径:O2___________ Na+, 酸性:H2SO4 ___________ HClO4,电负性:Si___________ O。
(6)天然碱的主要成分为 ,1mol
,1mol  经充分加热得到
经充分加热得到 的质量为
的质量为___________ g。
(1)基态Na原子的价层电子轨道表示式为
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式:
 ,加入
,加入 的目的是
的目的是(3)
 的电子式为
的电子式为 反应生成1mol
反应生成1mol  放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式:(4)采用空气和Na为原料可直接制备
 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(5)用“>”或“<”填空:
第一电离能:P
(6)天然碱的主要成分为
 ,1mol
,1mol  经充分加热得到
经充分加热得到 的质量为
的质量为
您最近一年使用:0次
名校
10 . 物质集合 中含有常见物质:
中含有常见物质: 、
、 、
、 、
、 、
、 、氨水、
、氨水、 、
、 ,这些物质按照如图所示方法进行分类,其中
,这些物质按照如图所示方法进行分类,其中 组为单质,
组为单质, 组为化合物,请按照要求回答问题。
组为化合物,请按照要求回答问题。
(1)
该分类方法为__________ ,B组物质中属于非电解质的为__________ 。
(2)C组物质中能与水反应且水既不作氧化剂也不作还原剂,该反应的离子方程式为_____________________ 。
(3)D组物质中的一种物质可以与氢氧化钠溶液反应,请写出该反应的离子方程式:______________________ 。
(4)请写出F组中的酸性氧化物与酸性 溶液反应的离子方程式:
溶液反应的离子方程式:__________ 。
(5)在密闭容器中,将E组中的混合物加热反应,若混合物中金属原子与氧原子的物质的量之比为1:2,混合加热充分反应后,排出气体,剩余固体的成分为__________ 。
 中含有常见物质:
中含有常见物质: 、
、 、
、 、
、 、
、 、氨水、
、氨水、 、
、 ,这些物质按照如图所示方法进行分类,其中
,这些物质按照如图所示方法进行分类,其中 组为单质,
组为单质, 组为化合物,请按照要求回答问题。
组为化合物,请按照要求回答问题。(1)

该分类方法为
(2)C组物质中能与水反应且水既不作氧化剂也不作还原剂,该反应的离子方程式为
(3)D组物质中的一种物质可以与氢氧化钠溶液反应,请写出该反应的离子方程式:
(4)请写出F组中的酸性氧化物与酸性
 溶液反应的离子方程式:
溶液反应的离子方程式:(5)在密闭容器中,将E组中的混合物加热反应,若混合物中金属原子与氧原子的物质的量之比为1:2,混合加热充分反应后,排出气体,剩余固体的成分为
您最近一年使用:0次



