1 . 下列关于乙烯的说法正确的是
| A.与溴单质或酸性高锰酸钾反应都与碳碳双键有关,但是两者原理不相同 |
| B.CH3CH2Br不可能是乙烯的加成产物,只能是CH3CH3的一卤取代产物 |
| C.乙烯和聚乙烯二者都能使溴水褪色,性质相似 |
| D.乙烯与氢气发生加成反应生成乙烷,所以除去乙烷中混有少量乙烯,可以在一定条件下通入过量氢气 |
您最近一年使用:0次
2023-05-22更新
|
913次组卷
|
3卷引用:内蒙古呼伦贝尔市满洲里市第一中学2022-2023学年高二下学期期末考试化学试题
10-11高二下·江苏南京·期中
2 . 反应A(g)+3B(g) 2C(g)
2C(g)  达到平衡后,将反应体系的温度降低,下列叙述中正确的是
达到平衡后,将反应体系的温度降低,下列叙述中正确的是
 2C(g)
2C(g)  达到平衡后,将反应体系的温度降低,下列叙述中正确的是
达到平衡后,将反应体系的温度降低,下列叙述中正确的是| A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
| C.正反应速率和逆反应速率都减小,平衡向正反应方向移动 |
| D.正反应速率和逆反应速率都减小,平衡向逆反应方向移动 |
您最近一年使用:0次
2022-11-25更新
|
1189次组卷
|
78卷引用:2014-2015内蒙古满洲里市七中高二上学期第二次月考化学试卷
2014-2015内蒙古满洲里市七中高二上学期第二次月考化学试卷内蒙古莫力达瓦旗尼尔基第一中学2021-2022学年高三上学期期末考试化学试题(已下线)2010—2011学年江苏省南京六中高二下学期期中考试化学试题(已下线)2011-2012学年山西省汾阳市高二10月月考化学试卷(已下线)2011-2012学年河南省开封高中高二上学期期中考试化学试卷(已下线)2011-2012学年山东省济南外国语学校高二上学期期中考试化学(理)试卷(已下线)2011-2012学年浙江省嵊泗中学高二上学期第一次月考化学试卷一(已下线)2011-2012学年山西省汾阳中学高二第二次月考化学试卷(已下线)2012年鲁科版高中化学必修2 2.2化学反应的快慢和限度练习卷(已下线)2012年鲁科版高中化学选修6 2反应条件对化学反应的影响练习卷(已下线)2014年高二化学人教版选修四 8化学平衡移动练习卷(已下线)2015届安徽望江中学同步课时练(人教选修4)2.3化学平衡移动试卷2014-2015学年宁夏育才中学高二上学期期中化学试卷2014-2015学年湖南省醴陵二中高二上学期期中化学(理)试卷2014-2015吉林省延边二中高二12月阶段考试化学试卷2014-2015甘肃省天水市秦安县二中高二上学期月考化学试卷2014—2015山东省泰安市高二上学期期末统考高二化学试卷2015-2016学年湖北省黄石市有色一中高二上学期10月月考化学试卷2015-2016学年西藏日喀则中学高二上12月月考化学试卷2015-2016学年河北省邯郸市曲周一中高一下期中化学试卷山东省济南市第一中学2016-2017学年高一下学期期中考试化学试题山东省烟台市第二中学2016-2017学年高一6月月考化学试题1山东省烟台市第二中学2016-2017学年高一6月月考化学试题2宁夏育才中学2017-2018学年高二9月月考化学试题新疆石河子第二中学2017-2018学年高二上学期第一次月考化学试题新疆呼图壁县第一中学2017-2018学年高二上学期期中考试化学试题吉林省汪清县第六中学2017-2018学年高二上学期期末考试化学试题(已下线)2018年9月16日 《每日一题》人教选修4-每周一测新疆维吾尔自治区昌吉市第四中学2018-2019学年第一学期高二第一次月考化学试题湖南省儋州一中2018-2019学年高二上学期第一次月考化学试题吉林省汪清县第六中学2018-2019学年高二上学期期末考试化学试题山东省泰安市宁阳县第一中学2018-2019学年高一下学期期中考试化学试题陕西省吴起高级中学2018-2019学年高一下学期期中考试基础题化学试题新疆维吾尔自治区且末县第二中学2018-2019学年高二上学期期末考试化学试题(已下线)2019年9月13日《每日一题》选修4—— 影响化学平衡移动的因素(2)甘肃省甘谷第一中学2019-2020学年高二上学期第一次月考化学试题山西省朔州市怀仁一中2019-2020学年高二上学期第一次月考化学试卷山东省淄博市淄川区般阳中学2019-2020学年高二10月月考化学试题辽宁省建平第二高级中学2019-2020学年高二上学期9月月考化学试题吉林省榆树市第一高级中学2019-2020学年高二上学期期中考试化学试题河北省武邑中学2019-2020学年高二上学期期中考试化学试题湖南省株洲市茶陵县第三中学2019-2020学年高二上学期期中考试化学(选考)试题甘肃省定西市岷县第二中学2019-2020学年高二上学期期中考试化学试题陕西省咸阳市乾县第二中学2019-2020学年高二上学期期中考试化学试题四川省自贡市田家炳中学2019-2020学年高二上学期期中考试化学试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(一)湖南省长沙市望城区第二中学2019-2020学年高二上学期第二次月考化学试题河北省保定八校2019-2020学年高二12月联考化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期期末考试化学试题辽宁省营口市第二高级中学2019-2020学年高二上学期第一次月考化学试题北京市东城区北京景山学校2019-2020学年高二下学期期末考试化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素西藏拉萨市第二高级中学2019-2020学年高二上学期期中考试化学试题安徽省蚌埠第三中学2019-2020学年高二上学期期中考试化学试题云南普洱景东彝族自治县第一中学2020-2021学年高二上学期12月月考化学试题(已下线)练习6 化学平衡(一)-2020-2021学年【补习教材·寒假作业】高二化学(人教版)陕西省咸阳百灵中学2020-2021学年高二上学期期中考试化学试题陕西省宝鸡市渭滨区2020-2021学年高二上学期期末考试化学试题辽宁省阜新市第二高级中学2020-2021学年高二上学期期末考试化学试题河北省衡水市第十四中学2020-2021学年高二下学期摸底考试化学试题河北省唐山市丰润区第二中学2020-2021学年高二上学期1月月考化学试题青海省海南州贵德高级中学2020-2021学年高二下学期期中化学试题选择性必修1 专题2 第三单元 课时1 影响化学平衡的因素吉林省通化县综合高级中学2021-2022学年高二上学期期中考试化学试题浙江省宁波市咸祥中学2021-2022学年高二上学期期中考试化学试题(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)辽宁省名校联盟2022-2023学年高二上学期10月联考化学试题福建省莆田第七中学2021-2022学年高二下学期期中考试化学试题苏教2020版选择性必修1专题2第三单元 化学平衡的移动课后习题(已下线)专题09 化学反应速率与化学平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)海南省临高县新盈中学2021-2022学年高二上学期(1-4班)期中考试化学试题新疆喀什地区巴楚县2023-2024学年高二上学期10月期中考试化学试题上海市宝山区上海大学附属中学2022-2023学年高二上学期期中考试化学试题上海市回民中学2023-2024学年高二上学期期中考试化学试题新疆生产建设兵团第二师八一中学2023-2024学年高二上学期期中考试化学(理科)试题新疆喀什地区巴楚县第一中学2023-2024学年高二上学期1月期末化学试题黑龙江省伊春市铁力市马永顺中学校2023-2024学年高二上学期期末考试化学试题
名校
3 . 三氯异氰尿酸是一种极强的氧化剂和氯化剂,具有高效、广谱、较为安全的消毒作用。三氯异氰尿酸之所以有杀菌、消毒功能,是因为三氯异氰尿酸溶于水能迅速生成次氯酸,反应方程式如图:
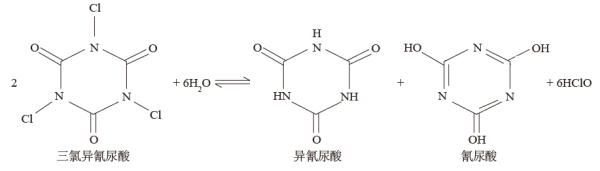
回答下列问题:
(1)Cl的基态原子核外电子排布式_______ 。在三氯异氰尿酸分子中,C和N原子的杂化类型分别为_______ 、_______ ,基态C和N核外未成对电子数较多的是_______
(2)苯分子中6个C原子,每个C原子有一个2p轨道参与形成大π键,可记为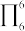 (右下角“6”表示6个原子,右上角“6”表示6个共用电子),则氰尿酸分子中存在的大π键可表示为
(右下角“6”表示6个原子,右上角“6”表示6个共用电子),则氰尿酸分子中存在的大π键可表示为_______ 。
(3)1mol异氰尿酸分子中σ键的数目为_______ ,π键的数目为_______ 。HClO分子属于_______ (填“极性”或“非极性”)分子,其立体构型为_______ 。
(4)异氰尿酸分子和氰尿酸分子的熔点都高于三氯异氰尿酸分子的熔点,其原因是_______ 。
(5)CO2的综合利用有利于“碳中和”,CO2分子在晶体中的堆积方式如图所示,该晶体面心立方最密堆积结构,晶胞边长为apm,则该晶体的密度ρ=_______ g/cm3(列出计算式,设NA为阿伏加德罗常数)


回答下列问题:
(1)Cl的基态原子核外电子排布式
(2)苯分子中6个C原子,每个C原子有一个2p轨道参与形成大π键,可记为
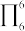 (右下角“6”表示6个原子,右上角“6”表示6个共用电子),则氰尿酸分子中存在的大π键可表示为
(右下角“6”表示6个原子,右上角“6”表示6个共用电子),则氰尿酸分子中存在的大π键可表示为(3)1mol异氰尿酸分子中σ键的数目为
(4)异氰尿酸分子和氰尿酸分子的熔点都高于三氯异氰尿酸分子的熔点,其原因是
(5)CO2的综合利用有利于“碳中和”,CO2分子在晶体中的堆积方式如图所示,该晶体面心立方最密堆积结构,晶胞边长为apm,则该晶体的密度ρ=

您最近一年使用:0次
2022-05-24更新
|
480次组卷
|
3卷引用:内蒙古呼伦贝尔满洲里市2022届高三三模理科综合化学试题
4 . 甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。实验室以FeCO3与甘氨酸(NH2CH2COOH)为原料制备甘氨酸亚铁的装置如图所示(夹持和加热仪器已省略)。
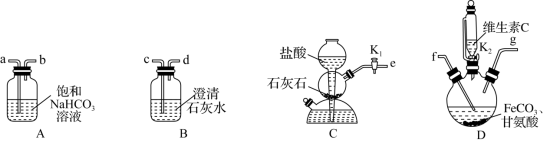
已知:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②维生素C易溶于水,具有较强的还原性和酸性。
回答下列问题:
(1)装置D中盛放维生素C的仪器名称是_______ ,上述装置依次连接的合理顺序为e→_______ (按气流方向,用小写字母表示)。
(2)实验开始时,先关闭K2,打开K1,当_______ (填实验现象)时,关闭K1,打开K2,进行实验。
(3)为了提高甘氨酸亚铁的产率,需要控制D中溶液的pH不能过高或过低。加入维生素C促进FeCO3溶解并调节溶液pH,维生素C的作用还有_______ 。
(4)写出装置D中生成甘氨酸亚铁的化学方程式:_______ 。
(5)实验结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥,得到甘氨酸亚铁。洗涤所选用的最佳试剂是_______ (填字母)。
a.蒸馏水 b.维生素C c.乙醇
(6)测定产品的含量。实验步骤如下:称量a g产品于锥形瓶中,溶解后进行必要处理,用容量瓶配制成200ml溶液,量取20.00ml,并加入2滴指示剂,用c mol/L Ce(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为Ce4++Fe2+=Ce3++Fe3+)
①产品中甘氨酸亚铁的质量分数表达式为_______ 。
②若滴定前滴定管内无气泡,滴定结束后有气泡,会使测定结果_______ (填“偏高”、“偏低”或“无影响”)。

已知:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②维生素C易溶于水,具有较强的还原性和酸性。
回答下列问题:
(1)装置D中盛放维生素C的仪器名称是
(2)实验开始时,先关闭K2,打开K1,当
(3)为了提高甘氨酸亚铁的产率,需要控制D中溶液的pH不能过高或过低。加入维生素C促进FeCO3溶解并调节溶液pH,维生素C的作用还有
(4)写出装置D中生成甘氨酸亚铁的化学方程式:
(5)实验结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥,得到甘氨酸亚铁。洗涤所选用的最佳试剂是
a.蒸馏水 b.维生素C c.乙醇
(6)测定产品的含量。实验步骤如下:称量a g产品于锥形瓶中,溶解后进行必要处理,用容量瓶配制成200ml溶液,量取20.00ml,并加入2滴指示剂,用c mol/L Ce(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为Ce4++Fe2+=Ce3++Fe3+)
①产品中甘氨酸亚铁的质量分数表达式为
②若滴定前滴定管内无气泡,滴定结束后有气泡,会使测定结果
您最近一年使用:0次
解题方法
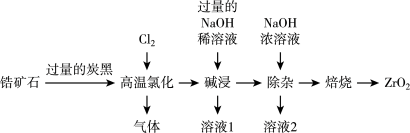
5 . 锆矿石(主要成分为 ,还含有
,还含有 及钠、铝、铜的氧化物等杂质),一种以锆矿石为原料制备工业纯
及钠、铝、铜的氧化物等杂质),一种以锆矿石为原料制备工业纯 的工艺流程如图所示:
的工艺流程如图所示:
已知: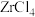 易溶于水,390℃会升华;
易溶于水,390℃会升华;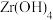 难溶于水,受热易分解。
难溶于水,受热易分解。
回答下列问题:
(1)为使氯化得更充分,一般采用的措施有_______ (只填一条)。
(2)“高温氯化”过程中,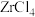 的产率与温度的关系如图所示,试分析随温度升高
的产率与温度的关系如图所示,试分析随温度升高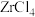 产率降低的原因:
产率降低的原因:_______ ;“高温氯化”结束前会通一段时间氧气,其目的是_______ 。

(3)“高温氯化”可以把氧化物转化为氯化物,写出 在“高温氯化”时发生反应的化学方程式:
在“高温氯化”时发生反应的化学方程式:_______ 。
(4)“过量的NaOH稀溶液”的作用是_______ ;得到“溶液1”的操作名称为_______ ,该操作所用的玻璃仪器有_______ 。
(5)“溶液2”中含 ,写出生成该离子的离子方程式:
,写出生成该离子的离子方程式:_______ 。
 ,还含有
,还含有 及钠、铝、铜的氧化物等杂质),一种以锆矿石为原料制备工业纯
及钠、铝、铜的氧化物等杂质),一种以锆矿石为原料制备工业纯 的工艺流程如图所示:
的工艺流程如图所示:
已知:
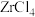 易溶于水,390℃会升华;
易溶于水,390℃会升华;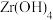 难溶于水,受热易分解。
难溶于水,受热易分解。回答下列问题:
(1)为使氯化得更充分,一般采用的措施有
(2)“高温氯化”过程中,
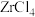 的产率与温度的关系如图所示,试分析随温度升高
的产率与温度的关系如图所示,试分析随温度升高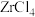 产率降低的原因:
产率降低的原因:
(3)“高温氯化”可以把氧化物转化为氯化物,写出
 在“高温氯化”时发生反应的化学方程式:
在“高温氯化”时发生反应的化学方程式:(4)“过量的NaOH稀溶液”的作用是
(5)“溶液2”中含
 ,写出生成该离子的离子方程式:
,写出生成该离子的离子方程式:
您最近一年使用:0次
2022-04-15更新
|
474次组卷
|
2卷引用:内蒙古呼伦贝尔市 2022届高三一模理科综合化学试题
解题方法
6 . 室温下,通过下列实验探究亚硫酸盐的性质。已知: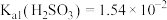 、
、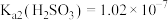 。
。
下列说法正确的是
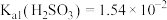 、
、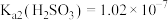 。
。| 实验 | 实验操作和现象 |
| 1 | 向 溶液中通入11.2mL(标准状况) 溶液中通入11.2mL(标准状况) ,测得pH约为9 ,测得pH约为9 |
| 2 | 向 溶液中通入 溶液中通入 至溶液 至溶液 |
| 3 | 向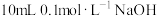 溶液中通入22.4mL(标准状况) 溶液中通入22.4mL(标准状况) ,测得pH约为4 ,测得pH约为4 |
| 4 | 取实验1所得溶液稀释至100mL,滴入1滴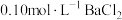 溶液,溶液出现浑浊(20滴溶液体积约为1mL) 溶液,溶液出现浑浊(20滴溶液体积约为1mL) |
A.实验1得到的溶液中有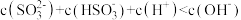 |
B.实验2得到的溶液中有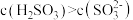 |
C.实验3得到的溶液中有 |
D.由实验4中可知: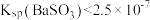 |
您最近一年使用:0次
2022-03-17更新
|
224次组卷
|
3卷引用:内蒙古呼伦贝尔市 2022届高三一模理科综合化学试题
名校
解题方法
7 . 当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应。发生电离:①CO2(g) CO2(aq);②CO2(aq)+H2O(l)
CO2(aq);②CO2(aq)+H2O(l) H+(aq)+HCO
H+(aq)+HCO (aq)。25℃时,反应②的平衡常数为K2。溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol·L-1·kPa-1。当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为
(aq)。25℃时,反应②的平衡常数为K2。溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol·L-1·kPa-1。当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为____ mol·L-1(写出表达式,忽略HCO 的电离)。
的电离)。
(2)105℃时,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:2MHCO3(s) M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于
M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于____ kPa。
(3)我国科学家研究Li—CO2电池,取得了重大科研成果。回答下列问题:
①Li—CO2电池中,Li为单质锂片,则该电池中的CO2在____ (填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.2CO2+2e-=C2O
Ⅱ.C2O =CO2+CO
=CO2+CO
Ⅲ.____
Ⅳ.CO +2Li+=Li2CO3
+2Li+=Li2CO3
②研究表明,在电解质水溶液中,CO2气体可被电化学还原。CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为____ 。
(1)雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应。发生电离:①CO2(g)
 CO2(aq);②CO2(aq)+H2O(l)
CO2(aq);②CO2(aq)+H2O(l) H+(aq)+HCO
H+(aq)+HCO (aq)。25℃时,反应②的平衡常数为K2。溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol·L-1·kPa-1。当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为
(aq)。25℃时,反应②的平衡常数为K2。溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol·L-1·kPa-1。当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为 的电离)。
的电离)。(2)105℃时,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:2MHCO3(s)
 M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于
M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于(3)我国科学家研究Li—CO2电池,取得了重大科研成果。回答下列问题:
①Li—CO2电池中,Li为单质锂片,则该电池中的CO2在
Ⅰ.2CO2+2e-=C2O

Ⅱ.C2O
 =CO2+CO
=CO2+CO
Ⅲ.
Ⅳ.CO
 +2Li+=Li2CO3
+2Li+=Li2CO3②研究表明,在电解质水溶液中,CO2气体可被电化学还原。CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
您最近一年使用:0次
名校
解题方法
8 . 用强碱滴定某一元弱酸时,弱酸被强碱部分中和后得到“弱酸盐和弱酸”组成的缓冲溶液,其中存在pH=pKa-1g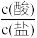 。25℃时,用0.1mol·L-1的NaOH溶液滴定16.00mL某未知浓度的HA溶液,滴定过程中消耗NaOH溶液的体积与混合溶液pH之间的关系如图所示。
。25℃时,用0.1mol·L-1的NaOH溶液滴定16.00mL某未知浓度的HA溶液,滴定过程中消耗NaOH溶液的体积与混合溶液pH之间的关系如图所示。

(已知:pKa=-lgKa,100.48=3,酸性HA>HCN),下列说法不正确的是
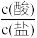 。25℃时,用0.1mol·L-1的NaOH溶液滴定16.00mL某未知浓度的HA溶液,滴定过程中消耗NaOH溶液的体积与混合溶液pH之间的关系如图所示。
。25℃时,用0.1mol·L-1的NaOH溶液滴定16.00mL某未知浓度的HA溶液,滴定过程中消耗NaOH溶液的体积与混合溶液pH之间的关系如图所示。
(已知:pKa=-lgKa,100.48=3,酸性HA>HCN),下列说法不正确的是
| A.HA电离常数Ka=10-4.75 |
| B.b点溶液中存在c(A-)+c(OH-)=c(HA)+c(H+) |
| C.c点溶液中离子浓度的大小关系为:(A-)>c(HA)>c(H+)>c(OH-) |
| D.若将HA改为等体积等浓度的HCN,则pH随NaOH溶液体积的变化曲线竖直上移 |
您最近一年使用:0次
2022-02-25更新
|
669次组卷
|
9卷引用:内蒙古呼伦贝尔市海拉尔第二中学2022届高三第四次模拟考试理科综合化学试题
内蒙古呼伦贝尔市海拉尔第二中学2022届高三第四次模拟考试理科综合化学试题河北省石家庄市2021-2022学年高三上学期毕业班教学质量检测(一)化学试题河北省石家庄市2022届高三上学期教学质量检测(一)化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】19(已下线)解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)浙江省名校协作体2021-2022学年高三下学期化学模拟试题(已下线)二轮拔高卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(浙江专用)山东省济南市外国语学校2022届高三12月月考化学试题(已下线)【直击双一流】05-备战2022年高考化学名校进阶模拟卷(通用版)
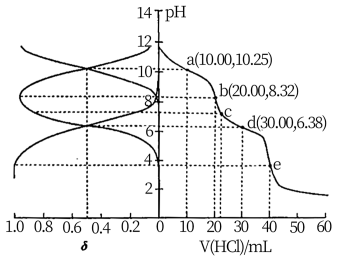
9 . 用 盐酸滴定
盐酸滴定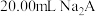 溶液,溶液中
溶液,溶液中 、
、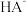 、
、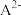 的分布分数
的分布分数 随pH变化曲线及滴定曲线如图。下列说法正确的是【如
随pH变化曲线及滴定曲线如图。下列说法正确的是【如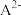 分布分数:
分布分数: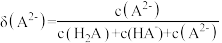 】
】
 盐酸滴定
盐酸滴定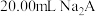 溶液,溶液中
溶液,溶液中 、
、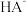 、
、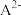 的分布分数
的分布分数 随pH变化曲线及滴定曲线如图。下列说法正确的是【如
随pH变化曲线及滴定曲线如图。下列说法正确的是【如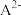 分布分数:
分布分数: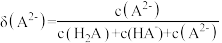 】
】
A. 的 的 为 为 | B.c点: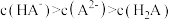 |
| C.第一次突变,可选酚酞作指示剂 | D.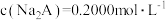 |
您最近一年使用:0次
2021-09-13更新
|
12297次组卷
|
29卷引用:内蒙古海拉尔第二中学2021-2022学年高三上学期第三次阶段考化学试题
内蒙古海拉尔第二中学2021-2022学年高三上学期第三次阶段考化学试题2021年新高考辽宁化学高考真题辽宁省实验中学2021-2022学年高二上学期11月期中阶段测化学试题辽宁省实验中学2021-2022学年高二上学期期中考试化学试题2021年辽宁高考化学试题变式题11-192020年全国卷Ⅰ理综化学高考真题变式题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)辽宁省朝阳市建平县实验中学2021-2022学年高二上学期第三次月考化学试题四川省绵阳南山中学2021-2022学年高二下学期3月月考理综化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)湖南省衡阳市衡阳县第一中学2021-2022学年高三下学期期中考试化学试题(已下线)专题10 水溶液中的离子平衡-三年(2020-2022)高考真题分项汇编(已下线)第32练 盐类的水解-2023年高考化学一轮复习小题多维练(全国通用)(已下线)微专题39 水溶液中平衡图像的拓展与探析-备战2023年高考化学一轮复习考点微专题(已下线)易错点24 水的电离平衡-备战2023年高考化学考试易错题山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡微专题(12) 电解质溶液中的两类特殊图像(已下线)考点27 水的电离与溶液的pH(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)四川省仁寿第一中学校南校区2023-2024学年高三上学期11月期中考试理综化学试题黑龙江省大庆市肇州县第二中学2023-2024学年高二上学期12月月考化学试题辽宁省大连市第十二中学2023-2024学年高二上学期12月学情反馈化学试题湖南省长沙市周南中学2023-2024学年高二下学期第一次月考化学试题
2021高三·全国·专题练习
名校
10 . CsICl2常用于化学上的分子筛技术,CaOCl2常用于漂白、消毒。下列判断正确的是
| A.CsICl2、CaOCl2中的卤族元素都显-1价 |
| B.向CaOCl2溶液中滴加稀硫酸可能产生黄绿色气体 |
| C.CsICl2溶液不能使酸性高锰酸钾溶液褪色 |
| D.向CsICl2、CaOCl2溶液中分别滴加硫酸亚铁溶液,均无明显颜色变化 |
您最近一年使用:0次
2021-09-06更新
|
1623次组卷
|
7卷引用:内蒙古海拉尔第二中学2021-2022学年高三上学期第一次阶段考化学试题
内蒙古海拉尔第二中学2021-2022学年高三上学期第一次阶段考化学试题(已下线)考向11 氯及其化合物-备战2022年高考化学一轮复习考点微专题(已下线)专题4.1.4 卤族元素(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)2021年北京高考化学试题变式题1-10(已下线)第12讲 富集在海水中的元素——卤素(练)-2023年高考化学一轮复习讲练测(全国通用)辽宁省沈阳市沈阳二中2023届高三上学期8月阶段测试化学试题 重庆市2023-2024学年高三下学期2月月度质量检测化学试题



