1 . 实验室里研究不同价态硫元素之间的转化。__________ 。
(2)B中的现象是__________ 。
(3)C中的现象是__________ , 在反应中做
在反应中做__________ 剂。
(4)D中氯水褪色,此反应中硫元素的化合价由__________ 转化为__________ ;甲认为可以补充一个实验进一步证明硫元素的价态转化,实验方案和现象为:取D中褪色后的溶液于试管中__________ 。
(5)E的作用是__________ ,离子方程式为__________ 。
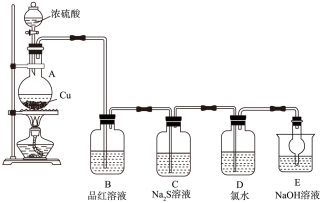
(2)B中的现象是
(3)C中的现象是
 在反应中做
在反应中做(4)D中氯水褪色,此反应中硫元素的化合价由
(5)E的作用是
您最近一年使用:0次
2 . 在下列反应中,硝酸既表现出氧化性,又表现出酸性的是
A.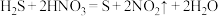 |
B.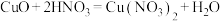 |
C.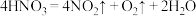 |
D.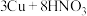 (稀) (稀)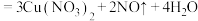 |
您最近一年使用:0次
3 . 下列反应中,硫酸既表现了氧化性又表现了酸性的是
A. (浓) (浓)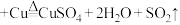 |
B. (浓) (浓)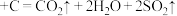 |
C. (浓) (浓) |
D. |
您最近一年使用:0次
4 . 实验室需要0.1 mol⋅L NaOH溶液450 mL和0.5 mol⋅L
NaOH溶液450 mL和0.5 mol⋅L 硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
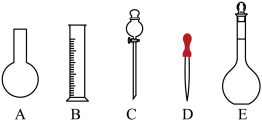
(1)如图所示的仪器中配制溶液肯定不需要的是___________ (填字母)。仪器C的名称是___________ ,本实验所需玻璃仪器E的规格和名称是___________ 。___________ (填“大于”“等于”或“小于”,下同)0.1 mol⋅L 。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度
。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度___________ 0.1 mol⋅L 。
。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g⋅cm 的浓硫酸的体积为
的浓硫酸的体积为___________ mL(计算结果保留一位小数)。如果实验室有10 mL、25 mL、50 mL量筒,应选用___________ mL规格的量筒最好。
(4)如果定容时不小心超过刻度线,应如何操作:___________ 。
 NaOH溶液450 mL和0.5 mol⋅L
NaOH溶液450 mL和0.5 mol⋅L 硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:(1)如图所示的仪器中配制溶液肯定不需要的是
 。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度
。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度 。
。(3)根据计算得知,所需质量分数为98%、密度为1.84 g⋅cm
 的浓硫酸的体积为
的浓硫酸的体积为(4)如果定容时不小心超过刻度线,应如何操作:
您最近一年使用:0次
5 . 下列物质中既能跟稀 反应,又能跟氢氧化钠溶液反应的两性物质是
反应,又能跟氢氧化钠溶液反应的两性物质是
① ②
② ③
③
 反应,又能跟氢氧化钠溶液反应的两性物质是
反应,又能跟氢氧化钠溶液反应的两性物质是①
 ②
② ③
③
| A.①② | B.②③ | C.①③ | D.只有② |
您最近一年使用:0次
6 . 下列有关实验操作或说法正确的是
A.配制125 mL 1.0 mol⋅L 的氯化钠溶液需要用到130 mL的容量瓶 的氯化钠溶液需要用到130 mL的容量瓶 |
| B.探究碳酸钠和碳酸氢钠热稳定性实验应分别加入碳酸钠与碳酸氢钠 |
| C.制备氢氧化铁胶体的实验中应将氯化铁溶液加入到温水中,继续煮沸至红褐色即可 |
| D.干燥的氯气使湿润的鲜花变色,干燥的氯气具有漂白性 |
您最近一年使用:0次
解题方法
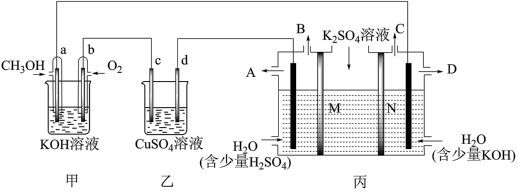
7 . 当今社会的主题之一:发展经济,节能减排。而燃料电池因其无污染,且原料来源广可再生被人们青睐,广泛应用于生产、生活、科学研究中,现有如下图所示装置,所有电极均为Pt,请按要求回答下列问题:______ (填“原电池”或“电解池”)。
(2)乙池中c极的电极反应______ 。
(3)若 足够,电解一段时间后,要恢复到原来的状态,则可加入____。
足够,电解一段时间后,要恢复到原来的状态,则可加入____。
(4)现用丙装置电解硫酸钾溶液制取氢气、氧气、硫酸和氢氧化钾,其中M、N为离子交换膜,只允许某些离子通过,则A出口导出的溶液溶质为_______ (写化学式),M为____ 离子交换膜(填“阴”或“阳”)。
(2)乙池中c极的电极反应
(3)若
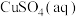 足够,电解一段时间后,要恢复到原来的状态,则可加入____。
足够,电解一段时间后,要恢复到原来的状态,则可加入____。| A.CuO | B. | C. | D. |
(4)现用丙装置电解硫酸钾溶液制取氢气、氧气、硫酸和氢氧化钾,其中M、N为离子交换膜,只允许某些离子通过,则A出口导出的溶液溶质为
您最近一年使用:0次
8 . 运用化学反应原理,研究硫、磷化合物的反应具有重要意义。
(1)已知 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为_______ ,该盐属于_____ (填“正盐”或“酸式盐”)。H3PO2易被氧化为 ,已知常温下
,已知常温下 的电离常数为
的电离常数为 ,
,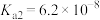 ,
,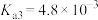 ,请利用以上数据计算推测
,请利用以上数据计算推测 溶液呈
溶液呈____ 性。
(2)常温下,用NaOH溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡______ (填“向左”“向右”或“不”)移动。试计算该溶液中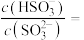
_______ (常温下, 的电离平衡常数
的电离平衡常数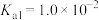 ,
, )。
)。
(3)化工生产中常用FeS作沉淀剂除去工业废水中的 ,其反应原理为
,其反应原理为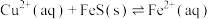
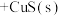 下列有关叙述正确的是_____。
下列有关叙述正确的是_____。
(1)已知
 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为 ,已知常温下
,已知常温下 的电离常数为
的电离常数为 ,
,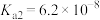 ,
,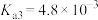 ,请利用以上数据计算推测
,请利用以上数据计算推测 溶液呈
溶液呈(2)常温下,用NaOH溶液吸收
 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡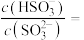
 的电离平衡常数
的电离平衡常数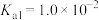 ,
, )。
)。(3)化工生产中常用FeS作沉淀剂除去工业废水中的
 ,其反应原理为
,其反应原理为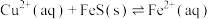
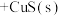 下列有关叙述正确的是_____。
下列有关叙述正确的是_____。A. |
B.达到平衡时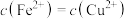 |
C.溶液中加入少量 固体后,溶液中 固体后,溶液中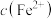 、 、 都减小 都减小 |
D.该反应平衡常数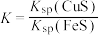 |
您最近一年使用:0次
解题方法
9 . 某化学兴趣小组进行实验,探究影响 分解速率的因素。
分解速率的因素。
(1)该小组测量用10 mL 溶液制取150 mL
溶液制取150 mL  所需时间,下表是实验过程中记录的一组数据:
所需时间,下表是实验过程中记录的一组数据:
该小组在设计方案时,考虑了浓度和______ 、______ 等因素对过氧化氢分解速率的影响;从上述影响 分解速率的因素中任选一个,说明该因素对该反应速率的影响:
分解速率的因素中任选一个,说明该因素对该反应速率的影响:___________ 。
(2)将质量相同但颗粒大小不同的 分别加入5 mL 5%的
分别加入5 mL 5%的 溶液中,并用带火星的木条测试,结果如下:
溶液中,并用带火星的木条测试,结果如下:
写出 发生反应的化学方程式:
发生反应的化学方程式:______ 。实验结果说明,催化剂催化作用的大小还与_____ 有关。
(3)氨在国民经济中占有重要地位。合成氨工业中,
 的化学平衡常数表达式为
的化学平衡常数表达式为________ 。下图是合成氨反应平衡混合气中 的体积分数随温度或压强变化的曲线,图中L(
的体积分数随温度或压强变化的曲线,图中L( 、
、 )、X分别代表温度或压强。其中X代表的是
)、X分别代表温度或压强。其中X代表的是______ (填“温度”或“压强”)。
 分解速率的因素。
分解速率的因素。(1)该小组测量用10 mL
 溶液制取150 mL
溶液制取150 mL  所需时间,下表是实验过程中记录的一组数据:
所需时间,下表是实验过程中记录的一组数据:| 反应条件 | 时间/s | |||
30% 溶液 溶液 | 15% 溶液 溶液 | 10% 溶液 溶液 | 5% 溶液 溶液 | |
| (Ⅰ)无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| (Ⅱ)无催化剂、加热 | 360 | 480 | 540 | 720 |
(Ⅲ) 催化剂、加热 催化剂、加热 | 10 | 25 | 60 | 120 |
 分解速率的因素中任选一个,说明该因素对该反应速率的影响:
分解速率的因素中任选一个,说明该因素对该反应速率的影响:(2)将质量相同但颗粒大小不同的
 分别加入5 mL 5%的
分别加入5 mL 5%的 溶液中,并用带火星的木条测试,结果如下:
溶液中,并用带火星的木条测试,结果如下:催化剂( ) ) | 操作情况 | 观察结果 | 反应完成所需的时间/min |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30 |
 发生反应的化学方程式:
发生反应的化学方程式:(3)氨在国民经济中占有重要地位。合成氨工业中,

 的化学平衡常数表达式为
的化学平衡常数表达式为 的体积分数随温度或压强变化的曲线,图中L(
的体积分数随温度或压强变化的曲线,图中L( 、
、 )、X分别代表温度或压强。其中X代表的是
)、X分别代表温度或压强。其中X代表的是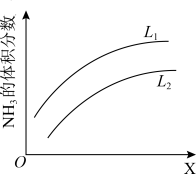
您最近一年使用:0次
解题方法
10 . 请填空:
(1)A元素L能层p电子数比s电子数多2个,A的元素符号为______ ;B元素M能层p电子数为s电子数的一半,B的元素名称为______ 。
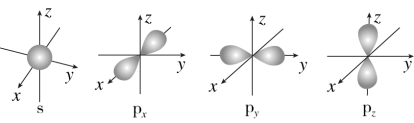
(2)下图是s能级和p能级的原子轨道图。____ 形,每个s能级有____ 个原子轨道;p电子的原子轨道呈____ 形,每个p能级有____ 个原子轨道。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素符号为____ ,其基态原子的核外电子排布式为______ 。
(4)常温下,向100 mL 0.01 mol⋅L HA溶液中逐滴加入0.02 mol⋅L
HA溶液中逐滴加入0.02 mol⋅L MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题。
MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题。_____ (填“强”或“弱”)酸。常温下一定浓度的MA稀溶液的 ,则a
,则a_____ (填“>”“<”或“=”)7,用离子方程式表示其原因:______ 。
(1)A元素L能层p电子数比s电子数多2个,A的元素符号为
(2)下图是s能级和p能级的原子轨道图。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素符号为
(4)常温下,向100 mL 0.01 mol⋅L
 HA溶液中逐滴加入0.02 mol⋅L
HA溶液中逐滴加入0.02 mol⋅L MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题。
MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题。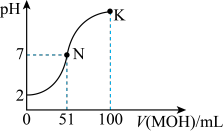
 ,则a
,则a
您最近一年使用:0次



