1 . 下图是医用胶504的一条合成路线(部分反应试剂和反应条件未标出)。
(i)烃A的质谱图中分子离子峰的m/z值为28。___________ 。
(2)B中所含的官能团是___________ (写名称);E→F的反应条件是___________ ;F→G的反应类型是___________ 。
(3)写出G→H的化学方程式___________ 。
(4)利用题示信息,以CH3CHO为原料,设计制备正丁醇的合成线路(无机试剂任选)___________ 。

(i)烃A的质谱图中分子离子峰的m/z值为28。
(ii)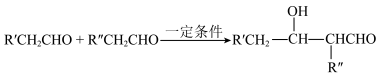
(2)B中所含的官能团是
(3)写出G→H的化学方程式
(4)利用题示信息,以CH3CHO为原料,设计制备正丁醇的合成线路(无机试剂任选)
您最近一年使用:0次
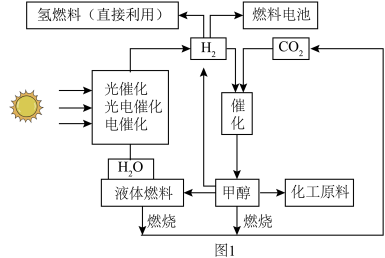
2 . “液态阳光”是指利用太阳能等可再生能源产生的电力电解水生产“绿色”氢能,再和从空气中捕获的二氧化碳通过催化过程转化为甲醇等液体燃料。甲醇可以直接作为能源,也可以作为化工原料。图1是“液态阳光”的合成技术线路示意图。___________ 。
A.石油 B.煤 C.风能
(2)与CH3OH互为同系物的是___________。
(3)CH3OH的下列性质与氢键无关的是___________。
(4)利用晶体X射线衍射技术不能测定CH3OH晶体的___________。
(5)下列关于CO2的说法错误的是___________。
(6)太阳能转化为电能时,要用到Si、GaP、GaAs等半导体材料,Ga元素与As同周期,与Al同主族。下列说法正确的是___________。
(7)某同学用图2所示装置(省略夹持装置)自制简单的氢氧燃料电池。___________ 。
A.石墨棒B为阳极 B.此过程中化学能转化为电能
C.石墨棒A的电极反应:2H++2e−=H2↑ D.石墨棒A和B产生等体积的气体
②通电一段时间后,断开K1,闭合K2,发光二极管立即发光。写出正极的电极反应式___________ 。
(8)已知H2(g)和CH3OH(l)的燃烧热分别为﹣286kJ·mol−1和﹣727kJ·mol−1.CO2和H2通过下列反应制备甲醇:CO2(g)+3H2(g) CH3OH(l)+H2O(l),该反应的ΔH=
CH3OH(l)+H2O(l),该反应的ΔH=___________ 。
A.石油 B.煤 C.风能
(2)与CH3OH互为同系物的是___________。
A.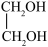 | B.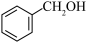 | C. | D.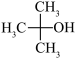 |
(3)CH3OH的下列性质与氢键无关的是___________。
| A.极易溶于水 | B.沸点比CH3SH高 | C.易燃烧 | D.具有还原性 |
(4)利用晶体X射线衍射技术不能测定CH3OH晶体的___________。
| A.化学键的键长 | B.化学键的键能 |
| C.化学键的键角 | D.分子在晶胞中的实际排列情况 |
(5)下列关于CO2的说法错误的是___________。
| A.所有原子共平面 | B.碳原子采取sp2杂化 |
| C.碳原子有2对价层电子对 | D.干冰易升华,可用作人工降雨 |
(6)太阳能转化为电能时,要用到Si、GaP、GaAs等半导体材料,Ga元素与As同周期,与Al同主族。下列说法正确的是___________。
| A.第一电离能:I1(Si)<I1(P) | B.原子半径:r(As)>r(Ga) |
| C.热稳定性:AsH3>PH3 | D.酸性:H2SiO3>H3PO4 |
(7)某同学用图2所示装置(省略夹持装置)自制简单的氢氧燃料电池。

A.石墨棒B为阳极 B.此过程中化学能转化为电能
C.石墨棒A的电极反应:2H++2e−=H2↑ D.石墨棒A和B产生等体积的气体
②通电一段时间后,断开K1,闭合K2,发光二极管立即发光。写出正极的电极反应式
(8)已知H2(g)和CH3OH(l)的燃烧热分别为﹣286kJ·mol−1和﹣727kJ·mol−1.CO2和H2通过下列反应制备甲醇:CO2(g)+3H2(g)
 CH3OH(l)+H2O(l),该反应的ΔH=
CH3OH(l)+H2O(l),该反应的ΔH=
您最近一年使用:0次
解题方法
3 . 工业上从金矿中提炼黄金可以采用氰化法,即:用NaCN稀溶液浸取粉碎的金矿石,生成溶于水的配位化合物Na[Au(CN)2],再用Zn置换出Au,产生的含氰废水经处理后排放。已知:HCN剧毒,易挥发,25℃时Ka(HCN)=4.0×10−10。
(1)配离子[Au(CN)2]−中的中心离子是___________ ,配体是___________ 。
(2)Zn位于元素周期表的第4周期第___________族。
(3)配制NaCN溶液时,将NaCN固体溶于___________溶液中,再用蒸馏水稀释。
(4)25℃时,等浓度等体积NaCN与HCN混合后溶液的pH>7,原因是___________ 。
(5)25℃时,H2CO3的Ka1=4.2×10−7,Ka2=4.8×10−11,将CO2通入NaCN溶液中,写出发生反应的离子方程式___________ 。
(6)可用Cl2处理含CN−废水:
___________CN−+___________Cl2+___________=___________HCO +___________N2↑+___________Cl−+___________。
+___________N2↑+___________Cl−+___________。
①CN−中各原子均达到8电子稳定结构,写出CN−的电子式___________ 。
②将上述离子方程式补充完整并配平。___________
③若标准状况下5.6m3Cl2发生反应,转移电子的数目为___________ 。(NA表示阿伏加德罗常数)
(7)酸性、碱性条件下,H2O2都能氧化废水中的CN−,但实际生产中却不选择酸性条件的可能原因是___________ 。
(1)配离子[Au(CN)2]−中的中心离子是
(2)Zn位于元素周期表的第4周期第___________族。
| A.IIA | B.IIB | C.0 | D.12 |
| A.HCl | B.KOH | C.NaCl | D.NaOH |
(5)25℃时,H2CO3的Ka1=4.2×10−7,Ka2=4.8×10−11,将CO2通入NaCN溶液中,写出发生反应的离子方程式
(6)可用Cl2处理含CN−废水:
___________CN−+___________Cl2+___________=___________HCO
 +___________N2↑+___________Cl−+___________。
+___________N2↑+___________Cl−+___________。①CN−中各原子均达到8电子稳定结构,写出CN−的电子式
②将上述离子方程式补充完整并配平。
③若标准状况下5.6m3Cl2发生反应,转移电子的数目为
(7)酸性、碱性条件下,H2O2都能氧化废水中的CN−,但实际生产中却不选择酸性条件的可能原因是
您最近一年使用:0次
解题方法
4 . 我国科学家制备了高选择性的二氧化碳加氢合成甲醇的催化剂氧化锆,其晶胞如下图所示。
(2)结合图中数据,计算该晶胞的密度ρ=___________ g·cm−3。(设NA为阿伏加德罗常数,用含a、b和NA的代数式表示)

| A.ZrO2 | B.ZrO | C.Zr2O | D.Zr2O3 |
(2)结合图中数据,计算该晶胞的密度ρ=
您最近一年使用:0次
解题方法
5 . 有机黏合剂是生产和生活中的一类重要的材料。黏合过程一般是液态黏合剂中的小分子物质经化学反应转化为高分子而固化。
(1)为去掉邮票背面的黏合剂,可将邮票浸入水中,该黏合剂的成分可能是___________。
(2)某“小分子胶水”(结构如下图)能助力自噬细胞“吞没”致病蛋白。下列有关该物质的说法错误的是___________。
(3)白乳胶也是常用的黏合剂,其主要成分是聚醋酸乙烯酯。试写出同时满足下列条件的白乳胶单体的同分异构体的结构简式___________ 。
①能发生银镜反应和水解反应;②有顺反异构
(1)为去掉邮票背面的黏合剂,可将邮票浸入水中,该黏合剂的成分可能是___________。
A.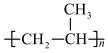 | B.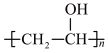 | C.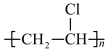 | D.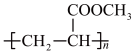 |
(2)某“小分子胶水”(结构如下图)能助力自噬细胞“吞没”致病蛋白。下列有关该物质的说法错误的是___________。
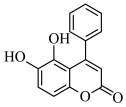
| A.分子中所有碳原子一定共平面 |
| B.遇FeCl3溶液显紫色 |
| C.1mol该物质最多能与4mol NaOH反应 |
| D.能发生取代反应和加成反应 |
(3)白乳胶也是常用的黏合剂,其主要成分是聚醋酸乙烯酯。试写出同时满足下列条件的白乳胶单体的同分异构体的结构简式
①能发生银镜反应和水解反应;②有顺反异构
您最近一年使用:0次
6 . α-氰基烯酸酯类医用胶无毒无害、性质稳定、与生物组织黏合好,可用作手术伤口黏合剂。其分子结构的通式可表示为: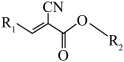
①分子中“-R1”“-R2”的碳链适当增长,有助于延长固化时间。
②分子中“-CN”具有较强的极性,能深入蛋白质内部与氨基、羧基形成氢键。
α-氰基丙烯酸乙酯(俗称502)是应用最早的医用胶,其结构简式为: 。
。
| A.蛋白质 | B.核酸 | C.油脂 | D.淀粉 |
(2)医用胶502具有黏合性的原因是发生了加聚反应(微量水蒸气作用下),加聚反应的化学方程式是
(3)常温下,丙烯难以聚合,而医用胶502可以快速聚合。从分子结构的角度分析产生该差异的原因是
(4)医用胶502现已被α-氰基丙烯酸正丁酯(俗称504)代替。504的结构简式为:
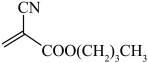 。医用胶504相对502的优点是
。医用胶504相对502的优点是
您最近一年使用:0次
7 . 为测定莫尔盐[(NH4)2SO4·FeSO4·6H2O](相对分子质量为392)的纯度,某同学取m g样品配制成500mL溶液,取20.00mL溶液用0.1000mol·L−1KMnO4酸性溶液进行滴定(MnO +5Fe2++8H+=5Fe3++Mn2++4H2O),实验数据如下表:
+5Fe2++8H+=5Fe3++Mn2++4H2O),实验数据如下表:
(1)计算该莫尔盐样品的纯度___________ 。(写出计算过程)
(2)再设计一个测定m g莫尔盐样品纯度的实验方案。___________
 +5Fe2++8H+=5Fe3++Mn2++4H2O),实验数据如下表:
+5Fe2++8H+=5Fe3++Mn2++4H2O),实验数据如下表:| 实验次数 | 1 | 2 | 3 | 4 |
| KMnO4酸性溶液体积/mL | 19.98 | 20.02 | 21.65 | 20.00 |
(2)再设计一个测定m g莫尔盐样品纯度的实验方案。
| 实验原理(用离子方程式表示) | 测定的物理量 |
您最近一年使用:0次
解题方法
8 . 莫尔盐在500℃时隔绝空气加热完全分解,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和SO2,为检验分解产物的成分,设计如下实验装置进行实验。___________ 。
(2)为验证A中残留的铁的氧化物中是否含有FeO,需要选用的试剂有___________。
(3)装置B是为了检验分解产物是否有___________ 气体;装置C是为了检验分解产物是否有___________ 气体。
(4)若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b___________ a。
A.大于 B.小于 C.等于
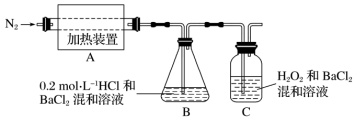
(2)为验证A中残留的铁的氧化物中是否含有FeO,需要选用的试剂有___________。
| A.KSCN溶液 | B.稀硫酸 | C.浓盐酸 | D.KMnO4溶液 |
(4)若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b
A.大于 B.小于 C.等于
您最近一年使用:0次
9 . NH4Fe(SO4)2·12H2O(铁铵矾)、(NH4)2Fe(SO4)2·6H2O(莫尔盐)均是分析化学中重要的试剂。氯化铁、硫酸铁是实验室常用的铁盐。
实验室可利用下列反应:Fe3++Ag Fe2++Ag+,用含Fe3+的溶液洗涤银镜反应后的试管。
Fe2++Ag+,用含Fe3+的溶液洗涤银镜反应后的试管。
(1)用0.1mol·L−1的FeCl3溶液和0.05mol·L−1 Fe2(SO4)3溶液溶解银镜,哪种溶液除银效果更好______ ,从化学平衡的角度说明理由___________ 。
(2)某同学用0.1mol·L−1的Fe(NO3)3溶液溶解银镜,发现银镜溶解速度比0.1mol·L−1的FeCl3溶液快得多,他猜测是酸性条件下NO 氧化了银,于是进行了下列操作验证猜测:
氧化了银,于是进行了下列操作验证猜测:
①测pH:测得0.1mol·L−1的Fe(NO3)3的pH=2。
②配制溶液:该同学配制的溶液是___________ 。
③验证猜测是否正确。
(3)下列有关0.2mol·L−1 NH4Fe(SO4)2溶液的叙述正确的是___________。
实验室可利用下列反应:Fe3++Ag
 Fe2++Ag+,用含Fe3+的溶液洗涤银镜反应后的试管。
Fe2++Ag+,用含Fe3+的溶液洗涤银镜反应后的试管。(1)用0.1mol·L−1的FeCl3溶液和0.05mol·L−1 Fe2(SO4)3溶液溶解银镜,哪种溶液除银效果更好
(2)某同学用0.1mol·L−1的Fe(NO3)3溶液溶解银镜,发现银镜溶解速度比0.1mol·L−1的FeCl3溶液快得多,他猜测是酸性条件下NO
 氧化了银,于是进行了下列操作验证猜测:
氧化了银,于是进行了下列操作验证猜测:①测pH:测得0.1mol·L−1的Fe(NO3)3的pH=2。
②配制溶液:该同学配制的溶液是
③验证猜测是否正确。
(3)下列有关0.2mol·L−1 NH4Fe(SO4)2溶液的叙述正确的是___________。
| A.室温下,其溶液中c(Fe3+)比0.1mol·L−1 Fe2(SO4)3溶液中c(Fe3+)小 |
| B.向其中滴加HBr,生成Br2 |
| C.向其中加入铜粉,发生的离子方程式为:Fe3++Cu=Fe2++Cu2+ |
D.向其中滴入Ba(OH)2溶液恰好使SO 完全沉淀的离子方程式为:NH 完全沉淀的离子方程式为:NH +Fe3++2SO +Fe3++2SO +2Ba2++4OH−=2BaSO4↓+NH3·H2O+Fe(OH)3↓ +2Ba2++4OH−=2BaSO4↓+NH3·H2O+Fe(OH)3↓ |
您最近一年使用:0次
10 . 上海建有以“液态阳光”甲醇为氢源,集制氢、储氢、加氢为一体的新型加氢站。甲醇水蒸气重整制氢的部分原理如下:
反应①:CH3OH(g)+H2O(g) CO2(g)+3H2(g) ∆H1=49kJ·mol−1
CO2(g)+3H2(g) ∆H1=49kJ·mol−1
反应②:H2(g)+CO2(g) CO(g)+H2O(g) ∆H2=41kJ·mol−1
CO(g)+H2O(g) ∆H2=41kJ·mol−1
(1)对反应①的下列判断正确的是___________。
(2)一定条件下,向2L恒容密闭容器中充入2mol CH3OH(g)和4mol H2O(g)发生反应①,2min时测得混合气体的压强是反应前的1.5倍,则2min内的υ(CH3OH)=___________ 。
(3)下列事实不能说明反应①已达到平衡状态的是___________。
(4)向某密闭容器中按下列比例通入CO和H2O发生反应②,在不同温度下,CO的平衡转化率如下表所示:
①比较大小:T1___________ T2(填写“大于”、“小于”或“等于”),判断理由是___________ 。
②T2℃时,反应②的化学平衡常数K =___________ 。
反应①:CH3OH(g)+H2O(g)
 CO2(g)+3H2(g) ∆H1=49kJ·mol−1
CO2(g)+3H2(g) ∆H1=49kJ·mol−1反应②:H2(g)+CO2(g)
 CO(g)+H2O(g) ∆H2=41kJ·mol−1
CO(g)+H2O(g) ∆H2=41kJ·mol−1(1)对反应①的下列判断正确的是___________。
| A.ΔS大于0,低温能自发进行 | B.ΔS小于0,高温能自发进行 |
| C.ΔS小于0,低温能自发进行 | D.ΔS大于0,高温能自发进行 |
(3)下列事实不能说明反应①已达到平衡状态的是___________。
| A.混合气体的平均相对分子质量不变 | B.υ正(CH3OH)=3υ逆(H2) |
| C.CH3OH的浓度不再变化 | D.绝热容器内的温度保持不变 |
| 反应温度(℃) | 进气比[n(CO):n(H2O)] | CO的平衡转化率 |
| T1 | 0.5 | 50% |
| T1 | 1 | 36.67% |
| T2 | 0.5 | 66.67% |
| T2 | 1 | 50% |
②T2℃时,反应②的化学平衡常数K =
您最近一年使用:0次



