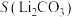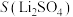解题方法
1 . 铁元素在地壳中含量丰富,应用广泛。回答下列问题:
(1)原子核外运动的电子有两种相反的自旋状态,若有一种自旋状态用 ,则与之相反的用
,则与之相反的用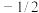 ,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为
,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为___________ 。
(2) 水溶液中
水溶液中 可水解生成双核阳离子
可水解生成双核阳离子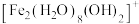 ,结构如图所示。该双核阳离子中
,结构如图所示。该双核阳离子中 键角
键角___________ (填“大于”、“小于”或“等于”) 中的
中的 键角;若对
键角;若对 水溶液进行加热,该双核阳离子内部首先断开的是
水溶液进行加热,该双核阳离子内部首先断开的是___________ 键(填“a”或“b”)。 】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为
】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为___________ , 的空间构型是
的空间构型是___________ ;尿素晶体的熔点为132.7℃,比相同摩尔质量的乙酸熔点(16.7℃)高116℃,主要原因是___________ 。
(4) 有良好的磁性和光学性能,广泛应用于电子工业和材料工业。
有良好的磁性和光学性能,广泛应用于电子工业和材料工业。 晶体中,
晶体中, 围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),
围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为
填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为___________ , 晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为
晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为___________  (写出含
(写出含 和
和 的计算表达式)。
的计算表达式)。
(1)原子核外运动的电子有两种相反的自旋状态,若有一种自旋状态用
 ,则与之相反的用
,则与之相反的用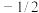 ,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为
,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为(2)
 水溶液中
水溶液中 可水解生成双核阳离子
可水解生成双核阳离子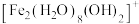 ,结构如图所示。该双核阳离子中
,结构如图所示。该双核阳离子中 键角
键角 中的
中的 键角;若对
键角;若对 水溶液进行加热,该双核阳离子内部首先断开的是
水溶液进行加热,该双核阳离子内部首先断开的是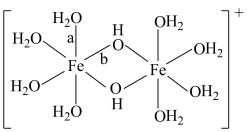
 】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为
】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为 的空间构型是
的空间构型是(4)
 有良好的磁性和光学性能,广泛应用于电子工业和材料工业。
有良好的磁性和光学性能,广泛应用于电子工业和材料工业。 晶体中,
晶体中, 围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),
围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为
填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为 晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为
晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为 (写出含
(写出含 和
和 的计算表达式)。
的计算表达式)。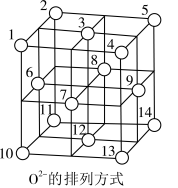
您最近一年使用:0次
2 .  、
、 、
、 三种元素性质非常相似,称铁系元素。请回答下列问题。
三种元素性质非常相似,称铁系元素。请回答下列问题。
(1)三种元素位于周期表中______ 区(填分区),基态 原子的外围电子轨道表达式为
原子的外围电子轨道表达式为______ 。
(2) 成为阳离子首先失去
成为阳离子首先失去______ 轨道电子; 、
、 的熔点是下列两个数值中的一个:1360℃、1565℃,1360℃是
的熔点是下列两个数值中的一个:1360℃、1565℃,1360℃是______ 的熔点,理由是______ 。
(3) 常作净水剂和补铁剂,
常作净水剂和补铁剂, 空间构型为
空间构型为______ ,与其互为等电子体的分子有______ (写一个)。
(4) 的结构如图1所示(略去
的结构如图1所示(略去 原子)(Y是乙二胺四乙酸,分子式为
原子)(Y是乙二胺四乙酸,分子式为 )。该图中四种元素第一电离能由大到小的顺序为
)。该图中四种元素第一电离能由大到小的顺序为______ (写元素符号),其中 原子的杂化类型为
原子的杂化类型为______ 。 该配合物中配位键有
该配合物中配位键有______ mol。 晶体为
晶体为 型结构(如图2)。其中
型结构(如图2)。其中 可看成填充在由
可看成填充在由 组成的正
组成的正______ 面体空隙中,填充率为 。将
。将 在空气中加热,部分
在空气中加热,部分 被氧化为
被氧化为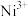 ,成为
,成为 ,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有
,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有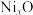 晶胞的质量为
晶胞的质量为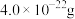 。则分别填充
。则分别填充 、
、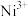 和未填充
和未填充 离子的空隙个数之比为
离子的空隙个数之比为______ 。
 、
、 、
、 三种元素性质非常相似,称铁系元素。请回答下列问题。
三种元素性质非常相似,称铁系元素。请回答下列问题。(1)三种元素位于周期表中
 原子的外围电子轨道表达式为
原子的外围电子轨道表达式为(2)
 成为阳离子首先失去
成为阳离子首先失去 、
、 的熔点是下列两个数值中的一个:1360℃、1565℃,1360℃是
的熔点是下列两个数值中的一个:1360℃、1565℃,1360℃是(3)
 常作净水剂和补铁剂,
常作净水剂和补铁剂, 空间构型为
空间构型为(4)
 的结构如图1所示(略去
的结构如图1所示(略去 原子)(Y是乙二胺四乙酸,分子式为
原子)(Y是乙二胺四乙酸,分子式为 )。该图中四种元素第一电离能由大到小的顺序为
)。该图中四种元素第一电离能由大到小的顺序为 原子的杂化类型为
原子的杂化类型为 该配合物中配位键有
该配合物中配位键有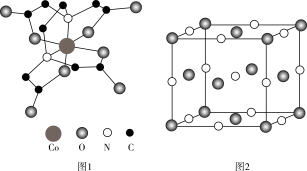
 晶体为
晶体为 型结构(如图2)。其中
型结构(如图2)。其中 可看成填充在由
可看成填充在由 组成的正
组成的正 。将
。将 在空气中加热,部分
在空气中加热,部分 被氧化为
被氧化为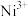 ,成为
,成为 ,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有
,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有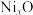 晶胞的质量为
晶胞的质量为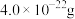 。则分别填充
。则分别填充 、
、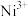 和未填充
和未填充 离子的空隙个数之比为
离子的空隙个数之比为
您最近一年使用:0次
7日内更新
|
236次组卷
|
3卷引用:2024届四川省仁寿第一中学校南校区高三下学期模拟考试(四)理综试题-高中化学
名校
3 . 前四周期元素X、Y、Z、W、Q原子序数依次增大,其中Y、Z同周期,Z、W同主族;X、Y、Z是人体内含量最高的三种元素,X、Y、Z、W、Q五原子核外电子数之和为51。下列叙述合理的是
A.原子半径 |
| B.X、Y形成的化合物沸点低于X、Z形成的化合物 |
| C.这些元素组成的三元化合物都可溶于水 |
D. 的一种化合物常加于煤中,避免煤燃烧产生的 的一种化合物常加于煤中,避免煤燃烧产生的 的某种氧化物污染空气 的某种氧化物污染空气 |
您最近一年使用:0次
7日内更新
|
257次组卷
|
3卷引用:2024届四川省仁寿第一中学校南校区高三下学期模拟考试(四)理综试题-高中化学
名校
4 . 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器和连接装置)
实验序号 | 实验目的 | 玻璃仪器 | 试剂 |
① | 萃取碘水中的碘单质 | 长颈漏斗、烧杯 |
|
② | 制 | 启普发生器、试管、导管 |
|
③ | 配制100mL一定物质的量浓度的NaCl溶液 | 100mL容量瓶、烧杯、玻璃棒 | 蒸馏水、NaCl固体 |
④ | 葡萄糖的银镜反应实验 | 试管、酒精灯、烧杯、量筒、胶头滴管 | 10%葡萄糖溶液、新制的银氨溶液 |
| A.① | B.② | C.③ | D.④ |
您最近一年使用:0次
7日内更新
|
253次组卷
|
3卷引用:2024届四川省仁寿第一中学校南校区高三下学期模拟考试(四)理综试题-高中化学
名校
解题方法
5 . 碳酸锂是制备锂电池的重要原料。一种由α—锂辉石(主要成分可用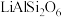 表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下: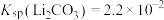 ,各离子沉淀pH范围:
,各离子沉淀pH范围:
回答下列问题:
(1)“煅烧”过程中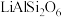 转化为
转化为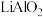 ,写出
,写出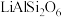 与生石灰反应的化学反应方程式
与生石灰反应的化学反应方程式_______ 。
(2)硫酸作为浸取酸时需要加入少量硝酸,其作用是_______ ;“调节pH”步骤应当控制的pH范围为_______ ,
(3)写出“除锰”过程中的离子反应方程式_______ 。若“除钙”后滤液中Li+浓度为0.2mol/L,则该步骤后 浓度应该低于
浓度应该低于_______ mol/L。
(4)已知 、
、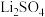 的溶解度(g/100g水)如下表所示:
的溶解度(g/100g水)如下表所示:
“沉锂”后应该选择_______ ℃(选填“20”、“50”和“80”)蒸馏水洗涤,写出检验沉淀是否洗涤干净的操作_______ 。
(5)“沉锂”后所得碳酸锂再次经过“碳化”—“热解”步骤的目的是_______ 。将碳酸锂与 混合,在空气中焙烧可制备电池阴极材料
混合,在空气中焙烧可制备电池阴极材料 ,写出其化学反应方程式
,写出其化学反应方程式_______ 。
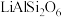 表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
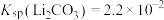 ,各离子沉淀pH范围:
,各离子沉淀pH范围:离子 |
|
|
|
|
开始沉淀pH | 7.6 | 2.7 | 3.8 | 8.3 |
沉淀完全pH | 9.7 | 3.2 | 5.2 | 9.8 |
(1)“煅烧”过程中
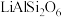 转化为
转化为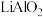 ,写出
,写出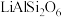 与生石灰反应的化学反应方程式
与生石灰反应的化学反应方程式(2)硫酸作为浸取酸时需要加入少量硝酸,其作用是
(3)写出“除锰”过程中的离子反应方程式
 浓度应该低于
浓度应该低于(4)已知
 、
、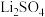 的溶解度(g/100g水)如下表所示:
的溶解度(g/100g水)如下表所示:T/℃ | 20 | 50 | 80 |
| 1.33 | 1.10 | 0.85 |
| 34.2 | 32.5 | 30.7 |
(5)“沉锂”后所得碳酸锂再次经过“碳化”—“热解”步骤的目的是
 混合,在空气中焙烧可制备电池阴极材料
混合,在空气中焙烧可制备电池阴极材料 ,写出其化学反应方程式
,写出其化学反应方程式
您最近一年使用:0次
2024-06-11更新
|
181次组卷
|
3卷引用:2024届四川省眉山市高三下学期第三次诊断考试理科综合试题 -高中化学
名校
解题方法
6 . 丙酮与柠檬醛在一定条件下反应可以合成假紫罗兰酮,再进一步可以合成有工业价值的 -紫罗兰酮和
-紫罗兰酮和 -紫罗兰酮,转化过程如图所示。下列说法错误的是
-紫罗兰酮,转化过程如图所示。下列说法错误的是
 -紫罗兰酮和
-紫罗兰酮和 -紫罗兰酮,转化过程如图所示。下列说法错误的是
-紫罗兰酮,转化过程如图所示。下列说法错误的是
A. -紫罗兰酮和 -紫罗兰酮和 -紫罗兰酮所有碳原子不可能处于同一平面上 -紫罗兰酮所有碳原子不可能处于同一平面上 |
B.假紫罗兰酮、 -紫罗兰酮和 -紫罗兰酮和 -紫罗兰酮互为同分异构体 -紫罗兰酮互为同分异构体 |
| C.柠檬醛合成假紫罗兰酮的过程中官能团的种类数目不变 |
| D.柠檬醛可以使酸性高锰酸钾溶液和溴水褪色 |
您最近一年使用:0次
2024-06-08更新
|
199次组卷
|
2卷引用:2024届四川省眉山市仁寿县四川省仁寿第一中学校(北校区)模拟预测理综试题-高中化学
解题方法
7 . 副族元素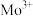 、
、 等元素较
等元素较 更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液
更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液_______ ;锰在周期表中的_______ 区。
(2)“超分子”中各元素(除H外)电负性由大到小的顺序为_______ 。
(3)副族元素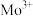 、
、 等元素比
等元素比 更易形成配合物,其原因是
更易形成配合物,其原因是_______ ; 与配体
与配体 形成共价键,提供孤电子对的原子是
形成共价键,提供孤电子对的原子是_______ (填元素符号),其中配体中C原子的杂化方式为_______ , 结合1个O和1个
结合1个O和1个 得到一种常见微粒,其空间构型为
得到一种常见微粒,其空间构型为_______ 。
(4)冠醚能够提升高锰酸钾氧化己烯的速率的原因是_______ 。
(5)氮化钼晶胞结构如图所示,N原子填充Mo围成的八面体空隙中,填充率为100%。_______ ;
② 的熔点
的熔点_______ (填“>”、“<”或“=”) ;
;
③若该八面体边长为 ,则晶胞的密度为
,则晶胞的密度为
_______  (
( 表示啊伏伽德罗常数)。
表示啊伏伽德罗常数)。
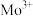 、
、 等元素较
等元素较 更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液
更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液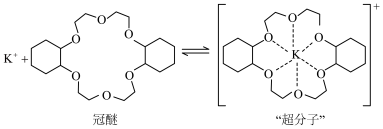
(2)“超分子”中各元素(除H外)电负性由大到小的顺序为
(3)副族元素
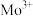 、
、 等元素比
等元素比 更易形成配合物,其原因是
更易形成配合物,其原因是 与配体
与配体 形成共价键,提供孤电子对的原子是
形成共价键,提供孤电子对的原子是 结合1个O和1个
结合1个O和1个 得到一种常见微粒,其空间构型为
得到一种常见微粒,其空间构型为(4)冠醚能够提升高锰酸钾氧化己烯的速率的原因是
(5)氮化钼晶胞结构如图所示,N原子填充Mo围成的八面体空隙中,填充率为100%。

②
 的熔点
的熔点 ;
;③若该八面体边长为
 ,则晶胞的密度为
,则晶胞的密度为
 (
( 表示啊伏伽德罗常数)。
表示啊伏伽德罗常数)。
您最近一年使用:0次
名校
解题方法
8 . 化学是以实验为基础的学科。下列根据实验操作及现象能得到相应实验结论的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 常温下,将Fe片分别插入稀硝酸和浓硝酸中,一段时间后,前者有气体产生,后者无明显现象 | 稀硝酸的氧化性比浓硝酸的强 |
| B | 向某溶液中加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 该溶液含有 |
| C | 相同温度下,测定 溶液和 溶液和 溶液的pH,前者pH值更大 溶液的pH,前者pH值更大 | 酸性:   |
| D | 同温下,向体积为2mL 的 的 溶液中先滴加4滴 溶液中先滴加4滴 的KCl溶液,再滴加4滴 的KCl溶液,再滴加4滴 的KI溶液,先产生白色沉淀,再产生黄色沉淀 的KI溶液,先产生白色沉淀,再产生黄色沉淀 | 同温下     |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . X、Y、Z、M为原子序数依次增大的周期表前20号主族元素。X原子的最外层电子数是内层电子数的两倍,Z的原子序数等于X、Y原子序数之和,M为金属元素且与Y同主族。下列说法正确的是
| A.原子半径:Y<Z |
| B.最高价含氧酸酸性:X<Z |
| C.Y和M分别与氧元素形成化合物均只有两种 |
| D.M、X和氧三种元素形成的盐只有一种 |
您最近一年使用:0次
名校
解题方法
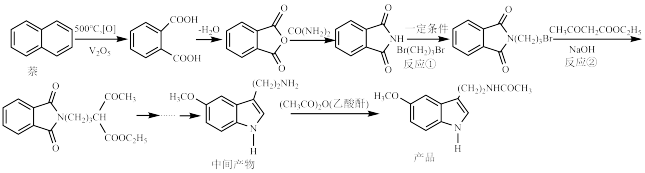
10 . 褪黑激素是一种神经系统激素,具有广泛的生理活性,有镇静镇痛的作用,一种以廉价易得的原料制备褪黑激素的合成路线如图所示:
(1)萘的一氯代物有___________ 种。
(2)1mol邻苯二甲酸与碳酸钠反应最多可产生___________ mol二氧化碳。
(3)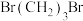 的官能团名称为
的官能团名称为___________ ,写出反应①的化学反应方程式___________ 。
(4)反应②属于___________ 反应(填有机反应类型),写出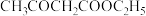 在NaOH水溶液中水解的化学反应方程式
在NaOH水溶液中水解的化学反应方程式___________ 。
(5)1mol中间产物H最多能与___________  发生加成反应,1个加成产物分子中有
发生加成反应,1个加成产物分子中有___________ 个手性碳原子。
(6)最后一步乙酰化反应可能会生成多种不同的乙酰化副产物,写出其中两种副产物的结构简式___________ 。
(1)萘的一氯代物有
(2)1mol邻苯二甲酸与碳酸钠反应最多可产生
(3)
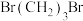 的官能团名称为
的官能团名称为(4)反应②属于
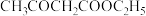 在NaOH水溶液中水解的化学反应方程式
在NaOH水溶液中水解的化学反应方程式(5)1mol中间产物H最多能与
 发生加成反应,1个加成产物分子中有
发生加成反应,1个加成产物分子中有(6)最后一步乙酰化反应可能会生成多种不同的乙酰化副产物,写出其中两种副产物的结构简式
您最近一年使用:0次
2024-05-17更新
|
314次组卷
|
2卷引用:2024届四川省仁寿第一中学校南校区二模理综化学试题

 、碘水
、碘水