13-14高二下·宁夏银川·期末
1 . 下列说法或有关化学用语的表达正确的是
| A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
B.基态Fe原子的外围电子排布图为: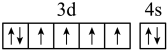 |
| C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 |
| D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
您最近一年使用:0次
2024-02-04更新
|
226次组卷
|
62卷引用:四川省广安市邻水县二中 2022-2023学年高三上学期9月考化学试题
四川省广安市邻水县二中 2022-2023学年高三上学期9月考化学试题四川省广安市第二中学校2017-2018学年高二下学期第二次月考化学试题山东省聊城市2019-2020学年高三化学一轮复习《物质结构与性质(》模拟测试四川省广安第二中学校2017-2018学年高二下学期第一次月考化学试题(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记山东省济南市济阳区闻韶中学2020-2021学年高三(3班)12月第一次模拟考试化学试题(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2015-2016学年山西省大同一中高二下3月月考化学试卷2015-2016学年贵州省思南中学高二下期中化学试卷2015-2016学年辽宁省五校协作体高二下学期期中考试化学试卷2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷山西省大同市第一中学2016-2017学年高二5月月考化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题贵州省思南中学2016-2017学年高二下学期期末考试化学试题2017-2018学年人教版高中化学选修三 模块综合质量检测吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题山西省沁县中学2018-2019学年高二下学期第一次月考化学试题吉林省扶余市第一中学2018-2019学年高二下学期第一次月考化学试题内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题辽宁省丹东市2017-2018学年高二下学期期末质量监测化学试题广西靖西市第二中学2019-2020学年高二下学期开学考试化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题吉林省长春市第二十九中学2019-2020学年高二下学期期中考试化学试题江苏省如东高级中学2019-2020学年高一下学期第二次阶段测试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题福建省莆田市仙游县第二中学2019-2020学年高二下学期期中考试化学试题四川省南充市阆中中学2020-2021学年高二上学期期中考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题(已下线)模块同步卷12 综合检测卷(提升卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期期中考试化学试题辽宁省沈阳市辽中区第一高级中学2020-2021学年高二下学期开学考试化学试题天津市实验中学滨海学校2020-2021学年高二下学期期中化学试题甘肃省武威第十八中学2020-2021学年高二下学期期中考试化学试题(已下线)作业02 原子结构与元素的性质-2021年高二化学暑假作业(人教版2019)新疆昌吉教育共同体2020-2021学年高二下学期期末质量检测化学试题福建省漳州市正兴学校2020-2021学年高二下学期期末考试化学试题宁夏银川市第六中学2020-2021学年高二下学期期末考试化学试题四川省遂宁市第二中学校2021-2022学年高二上学期期中考试化学试题辽宁省本溪市第二高级中学2021-2022学年高二上学期期末考试化学试题山西省长治市沁源县第一中学等名校2021-2022学年高二下学期5月联考化学试题吉林地区普通高中友好学校联合体2021-2022学年高二下学期期末考试化学试题第一章 本章复习提升1云南省石屏县第一中学2021-2022学年高二下学期3月份考试化学试题福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题安徽省合肥市肥东县综合高中2021-2022学年高二下学期期中考试化学试题甘肃省庆阳市第六中学2021-2022学年高二下学期期末考试化学试题福建省泉州科技中学2021-2022学年高二下学期期中考试化学试题新疆克拉玛依市高级中学2021-2022学年高二下学期期末考试化学试题重庆市荣昌永荣中学校2021-2022学年高二下学期期末考试化学试题山东省新泰市第一中学2022-2023学年高二下学期第一次大单元考试化学试题山东省青岛第十九中学2022-2023学年高二下学期4月月考化学试题宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题四川省广元中学2022-2023学年高二下学期5月期中考试化学试题安徽省安庆市第二中学2022-2023学年高二下学期期中考试化学试题河北省唐山市开滦一中2022-2023学年高二下学期期末考试化学试题吉林省普通高中友好学校联合体2023-2024学年高二上学期第三十七届基础年段期末联考化学试题湖南省长郡中学2023-2024学年高二下学期寒假检测(开学考试)化学试题湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题(已下线)猜想01 原子结构与性质 【考题猜想】(8大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
解题方法
2 . 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆漂白;食品消毒;水处理;杀菌灭藻和鱼药制造。某校化学实验探究小组设计如图实验制备亚氯酸钠(NaClO2)晶体。
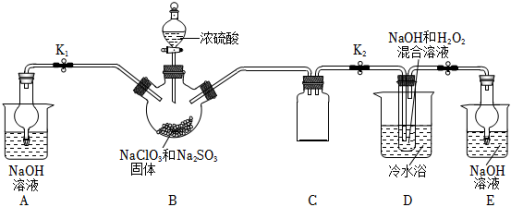
[查阅资料]
①2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O
②ClO2极易溶于水而不与水反应,几乎不发生水解,沸点11℃。
③NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)盛装浓硫酸的仪器名称是_______ 。C的作用是________ 。
(2)B中使用浓硫酸而不用稀硫酸的原因是_________ 。
(3)ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的离子方程式为_________ 。
(4)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体:55℃蒸发结晶→趁热过滤→38~60℃热水洗涤→低于60℃干燥,得到成品。如果干燥温度过高可能导致产品中混有的杂质是__________ 。
(5)实验须使B中n(NaClO3):n(Na2SO3)=2:1,如Na2SO3过量,则滴加过量硫酸后使ClO2混有气体。装置D中可能产生 ,检验装置D中是否含有
,检验装置D中是否含有 的方法是:取少量D中反应后的溶液于试管中,
的方法是:取少量D中反应后的溶液于试管中,_______ ,证明溶液中存在 。
。
(6)测定样品中NaClO2的纯度。测定时进行如下实验:准确称取mg的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用cmol•L﹣1Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为VmL(已知: )。
)。
①确认滴定终点的现象是_________ 。
②所称取的样品中NaClO2的质量分数为_____ (用含c、V的代数式表示)。

[查阅资料]
①2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O
②ClO2极易溶于水而不与水反应,几乎不发生水解,沸点11℃。
③NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)盛装浓硫酸的仪器名称是
(2)B中使用浓硫酸而不用稀硫酸的原因是
(3)ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的离子方程式为
(4)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体:55℃蒸发结晶→趁热过滤→38~60℃热水洗涤→低于60℃干燥,得到成品。如果干燥温度过高可能导致产品中混有的杂质是
(5)实验须使B中n(NaClO3):n(Na2SO3)=2:1,如Na2SO3过量,则滴加过量硫酸后使ClO2混有气体。装置D中可能产生
 ,检验装置D中是否含有
,检验装置D中是否含有 的方法是:取少量D中反应后的溶液于试管中,
的方法是:取少量D中反应后的溶液于试管中, 。
。(6)测定样品中NaClO2的纯度。测定时进行如下实验:准确称取mg的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用cmol•L﹣1Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为VmL(已知:
 )。
)。①确认滴定终点的现象是
②所称取的样品中NaClO2的质量分数为
您最近一年使用:0次
2024-01-31更新
|
429次组卷
|
6卷引用:四川省广安第二中学校2022-2023学年高三上学期第一次诊断化学试卷
四川省广安第二中学校2022-2023学年高三上学期第一次诊断化学试卷广西柳州市2022届高三第二次模拟考试理科综合化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)黑龙江省哈尔滨市第九中学校2022届高三考前理科综合压轴卷化学试题四川省成都外国语学校2023-2024学年高三上学期期中考试理综化学试题(已下线)题型17 化学实验综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
解题方法
3 . 锂辉石的主要成分有Li2O、Al2O3、SiO2,还含有少量Fe3O4、MgO等杂质,利用锂辉石制取Li2CO3的工艺流程如下:
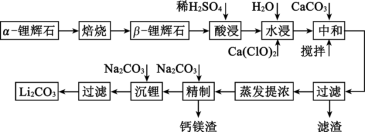
已知:ⅰ.α- 锂辉石是致密坚硬的固体,β- 锂辉石具有疏松多孔结构;
ⅱ.CaCO3的溶度积常数为1×10−9,MgCO3的溶度积常数为1×10−6。
回答下列问题:
(1)焙烧的目的是_______ 。
(2)为提高酸浸速率,可采取的措施是_______ (填一种即可)。
(3)水浸时加入少量Ca(ClO)2溶液,其目的是_______ ,发生反应的离子方程式为_______ ,该方案中不选择H2O2做氧化剂的原因是_______ 。
(4)中和过程中加入CaCO3,一方面是为了除去多余硫酸,另一方面是为了_______ 。
(5)精制过程是为了除去钙镁离子,钙镁渣中含CaCO3、Mg2(OH)2CO3和MgCO3,写出生成Mg2(OH)2CO3的离子方程式:_______ 。
(6)精制过程中,当钙离子刚好沉淀完全时[c(Ca2+)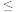 1×10−5 mol·L−1],溶液的pH为9,则CO
1×10−5 mol·L−1],溶液的pH为9,则CO 的一级水解常数约为
的一级水解常数约为_______ (忽略CO 的二级水解及其他离子的水解)。
的二级水解及其他离子的水解)。

已知:ⅰ.α- 锂辉石是致密坚硬的固体,β- 锂辉石具有疏松多孔结构;
ⅱ.CaCO3的溶度积常数为1×10−9,MgCO3的溶度积常数为1×10−6。
回答下列问题:
(1)焙烧的目的是
(2)为提高酸浸速率,可采取的措施是
(3)水浸时加入少量Ca(ClO)2溶液,其目的是
(4)中和过程中加入CaCO3,一方面是为了除去多余硫酸,另一方面是为了
(5)精制过程是为了除去钙镁离子,钙镁渣中含CaCO3、Mg2(OH)2CO3和MgCO3,写出生成Mg2(OH)2CO3的离子方程式:
(6)精制过程中,当钙离子刚好沉淀完全时[c(Ca2+)
 1×10−5 mol·L−1],溶液的pH为9,则CO
1×10−5 mol·L−1],溶液的pH为9,则CO 的一级水解常数约为
的一级水解常数约为 的二级水解及其他离子的水解)。
的二级水解及其他离子的水解)。
您最近一年使用:0次
2024-01-12更新
|
271次组卷
|
2卷引用:四川省广安第二中学校2023-2024学年高三上学期12月月考理科综合试题
名校
解题方法
4 . 磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的价电子排布式为_________ ;价电子中成对电子数______ 个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是________ 。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3____ H3PO4(填“>”或“<”),从结构的角度说明理由:_______ 。
(3)某磷青铜晶胞结构如图所示。
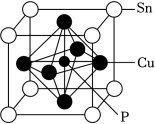
①则其化学式为________ 。
②该晶体中距离Cu原子最近的Sn原子有______ 个,这些Sn原子所呈现的构型为_______ 。
③若晶体密度为8.82g/cm3,最近的Cu原子核间距为_______ pm(用含NA的代数式表示)。
(1)基态铜原子的价电子排布式为
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3
(3)某磷青铜晶胞结构如图所示。

①则其化学式为
②该晶体中距离Cu原子最近的Sn原子有
③若晶体密度为8.82g/cm3,最近的Cu原子核间距为
您最近一年使用:0次
2024-01-07更新
|
60次组卷
|
2卷引用:四川省广安第二中学校2022-2023学年高三上学期第一次诊断化学试卷
5 . 草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
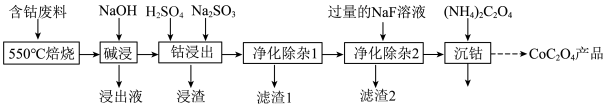
(1)“550℃焙烧”的目的是_________ 。
(2)“碱浸”过程中发生反应的化学方程式______ 。
(3)“钴浸出”过程中,不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2污染环境,该反应的离子方程式为________ 。
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5.滤渣1的主要成分是_______ 。金属离子与H2O2反应的离子方程式为________ 。
(5)“净化除杂2”过程中,加入NaF以除去原溶液中Ca2+(浓度为1.0×10﹣3mol⋅L﹣1)和Mg2+,若控制溶液中c(F﹣)=2.0×10﹣3mol⋅L﹣1,则Ca2+的去除率准确值为________ 。[已知某温度下,Ksp(CaF2)=4.0×10﹣11]
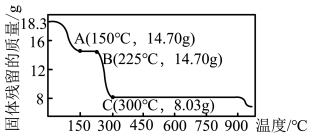
(6)如图为二水合草酸钴(CoC2O4⋅2H2O摩尔质量为183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。写出B点物质与O2在一定温度下发生反应生成C点物质的化学方程式_________ 。

(1)“550℃焙烧”的目的是
(2)“碱浸”过程中发生反应的化学方程式
(3)“钴浸出”过程中,不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2污染环境,该反应的离子方程式为
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5.滤渣1的主要成分是
(5)“净化除杂2”过程中,加入NaF以除去原溶液中Ca2+(浓度为1.0×10﹣3mol⋅L﹣1)和Mg2+,若控制溶液中c(F﹣)=2.0×10﹣3mol⋅L﹣1,则Ca2+的去除率准确值为
(6)如图为二水合草酸钴(CoC2O4⋅2H2O摩尔质量为183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。写出B点物质与O2在一定温度下发生反应生成C点物质的化学方程式

您最近一年使用:0次
2024-01-07更新
|
194次组卷
|
2卷引用:四川省广安第二中学校2022-2023学年高三上学期第一次诊断化学试卷
名校
解题方法
6 . 阿尔维德卡尔森因发现多巴胺获得了2000年诺贝尔生理学或医学奖,多巴胺是一种神经传导物质,用来帮助细胞传送脉冲的化学物质。这种脑内分泌物也能传递兴奋及开心的信息。其结构式如下图a所示,化学式为C8H11NO2。回答下列问题:
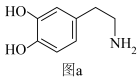
(1)基态氧原子最高能级上有_______ 种运动状态不同的电子,基态碳原子的一个2s电子跃迁到2p轨道形成激发态原子的价电子排布图为_______ 。
(2)多巴胺分子中碳原子的杂化方式有_______ ,C、N、O的第一电离能由大到小的顺序为_______ 。
(3)1 mol多巴胺中含有 键的数目为
键的数目为_______ 。多巴胺易溶于水,理由是_______ 。
(4)多巴胺与盐酸作用能形成盐酸多巴胺,结构如上图b所示,多巴胺和盐酸多巴胺中H—N—H键的键角,前者_______ (填“大于”“等于”或“小于”)后者,理由是_______ 。
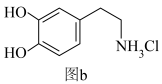
(5)盐酸多巴胺形成的晶体的晶胞结构如图所示,其晶胞中阳离子为面心立方最密堆积,阳离子半径为R pm,则晶胞氯离子的配位数是_______ ,晶胞的密度是_______ 。


(1)基态氧原子最高能级上有
(2)多巴胺分子中碳原子的杂化方式有
(3)1 mol多巴胺中含有
 键的数目为
键的数目为(4)多巴胺与盐酸作用能形成盐酸多巴胺,结构如上图b所示,多巴胺和盐酸多巴胺中H—N—H键的键角,前者

(5)盐酸多巴胺形成的晶体的晶胞结构如图所示,其晶胞中阳离子为面心立方最密堆积,阳离子半径为R pm,则晶胞氯离子的配位数是

您最近一年使用:0次
2023-12-31更新
|
329次组卷
|
3卷引用:四川省广安第二中学校2023-2024学年高三上学期12月月考理科综合试题
名校
解题方法
7 . 甲醇是一种重要的化工原料,通常用作溶剂、防冻剂、燃料,也可用于酯交换反应生产生物柴油等,因此,探究甲醇的生产制备具有重要的意义。回答下列问题:
(1)已知:① 2H2(g) + O2(g) = 2H2O(l) ΔH1
② H2O(g) = H2O(l) ΔH2
③ CO2(g) + 3H2(g)⇌CH3OH(g) + H2O(g) ΔH3
甲醇气体的燃烧热ΔH为_______ kJ·mol−1(用ΔH1、ΔH2、ΔH3表示)。
(2)某温度下,将1 mol CO2和3 mol H2充入体积可变的恒压密闭容器中进行反应③,测得起始时容器体积为2 L,反应达平衡时,容器体积变为1.5 L,则CO2的转化率为_______ 。下列说法可判断该反应达平衡的有_______ (填标号)。
A.CO2和H2的物质的量之比保持不变
B.断裂3 mol H—H键的同时,生成2 mol C=O键
C.混合气体的密度保持不变
D.容器的压强保持不变
(3)在某恒容密闭容器中发生上述反应③,某温度下,平衡时CO2的物质的量分数[x(CO2)]随压强(p)的变化关系,以及某压强下,-lgK(K为平衡常数)随温度(T )的变化关系如图所示,则x(CO2)~p对应图中的曲线_______ (填“Ⅰ”或“Ⅱ”),该反应正方向为_______ (填“放热”或“吸热”)反应,有利于该反应自发进行的条件是_______ (填“低温”或“高温”)。

(4)在利用CO2和H2合成甲醇的过程中,往往存在副反应CO2(g) + H2(g)⇌CO(g) + H2O(g) ΔH4 = +40.9 kJ·mol−1,若发现随反应温度升高,CO2的平衡转化率升高,而甲醇的产率降低,其原因可能是_______ ,提高相同时间内甲醇产率较好的方法是_______ 。
(1)已知:① 2H2(g) + O2(g) = 2H2O(l) ΔH1
② H2O(g) = H2O(l) ΔH2
③ CO2(g) + 3H2(g)⇌CH3OH(g) + H2O(g) ΔH3
甲醇气体的燃烧热ΔH为
(2)某温度下,将1 mol CO2和3 mol H2充入体积可变的恒压密闭容器中进行反应③,测得起始时容器体积为2 L,反应达平衡时,容器体积变为1.5 L,则CO2的转化率为
A.CO2和H2的物质的量之比保持不变
B.断裂3 mol H—H键的同时,生成2 mol C=O键
C.混合气体的密度保持不变
D.容器的压强保持不变
(3)在某恒容密闭容器中发生上述反应③,某温度下,平衡时CO2的物质的量分数[x(CO2)]随压强(p)的变化关系,以及某压强下,-lgK(K为平衡常数)随温度(T )的变化关系如图所示,则x(CO2)~p对应图中的曲线

(4)在利用CO2和H2合成甲醇的过程中,往往存在副反应CO2(g) + H2(g)⇌CO(g) + H2O(g) ΔH4 = +40.9 kJ·mol−1,若发现随反应温度升高,CO2的平衡转化率升高,而甲醇的产率降低,其原因可能是
您最近一年使用:0次
2023-12-31更新
|
271次组卷
|
2卷引用:四川省广安第二中学校2023-2024学年高三上学期12月月考理科综合试题
名校
解题方法
8 . 一氯胺(NH2Cl)是一种长效缓释消毒剂,其消毒原理是一氯胺水解生成次氯酸。工业上常用次氯酸钠与氨气反应制取一氯胺(NH3 + NaClO = NH2Cl + NaOH)。某课外活动小组根据上述制取原理设计了下列装置制取一氯胺。回答下列问题:
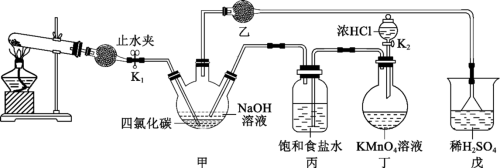
(1)工业上制取一氯胺的反应_______ (填“是”或“不是”)氧化还原反应。
(2)写出试管中所装药品的化学式:_______ ;仪器乙的名称是_______ ,仪器乙中装有碱石灰,其作用是_______ 。
(3)装置甲中将左侧导管插入下层四氯化碳中,其目的是_______ ,该装置中与其功能相同还有装置_______ (填“乙”“丙”“丁”或“戊”)。
(4)实验过程中先关闭K1,打开K2,让浓盐酸和高锰酸钾先发生反应,其反应的离子方程式为_______ ,这样做的目的是为了获得_______ ;然后再关闭K2,打开K1,并_______ (补充实验操作)。
(5)实验过程中若去掉盛有饱和食盐水的装置,对一氯胺的产率_______ (填“有”或“无”)影响,理由是_______ 。

(1)工业上制取一氯胺的反应
(2)写出试管中所装药品的化学式:
(3)装置甲中将左侧导管插入下层四氯化碳中,其目的是
(4)实验过程中先关闭K1,打开K2,让浓盐酸和高锰酸钾先发生反应,其反应的离子方程式为
(5)实验过程中若去掉盛有饱和食盐水的装置,对一氯胺的产率
您最近一年使用:0次
2023-12-31更新
|
326次组卷
|
2卷引用:四川省广安第二中学校2023-2024学年高三上学期12月月考理科综合试题
9 . 25℃时,向20 mL 0.1 mol·L−1 Na2CO3溶液中逐滴加入40 mL 0.1 mol·L−1 HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是
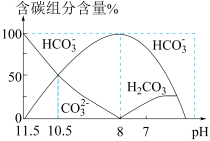
| A.pH = 8时,溶液中水的电离程度最大 |
B.当溶液中c(HCO ):c(CO ):c(CO ) = 2:1时,溶液的pH = 10.2(已知lg2取0.3) ) = 2:1时,溶液的pH = 10.2(已知lg2取0.3) |
C.在同一溶液中,H2CO3、HCO 、CO 、CO 能大量共存 能大量共存 |
D.pH = 7时,溶液中离子浓度大小关系为:c(Na+) > c(HCO ) > c(Cl−) ) > c(Cl−) |
您最近一年使用:0次
2023-12-31更新
|
885次组卷
|
6卷引用:四川省广安第二中学校2023-2024学年高三上学期12月月考理科综合试题
四川省广安第二中学校2023-2024学年高三上学期12月月考理科综合试题2024届四川省双流棠湖中学高三上学期第一次联考理科综合能力测试试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)黑龙江省哈尔滨市第九中学2023-2024学年高二下学期开学考试化学试卷宁夏开元学校2023-2024学年高二上学期期末考试化学试题
名校
解题方法
10 . 下列实验目的对应的实验操作正确的是
| 选项 | 实验目的 | 实验操作 |
| A | 证明活泼性:Na > Cu | 将少量Na投入CuSO4溶液中,观察是否产生红色固体 |
| B | 证明酸性:H2SO3 > HClO | 将SO2通入漂白粉溶液,观察是否变浑浊 |
| C | 证明H2SO4具有氧化性 | 将少量稀硫酸滴入Na2S2O3溶液,观察是否产生刺激性气味的气体 |
| D | 证明淀粉已水解完全 | 取适量淀粉水解液,滴入几滴碘水,观察溶液是否变蓝 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-31更新
|
965次组卷
|
5卷引用:四川省广安第二中学校2023-2024学年高三上学期12月月考理科综合试题
四川省广安第二中学校2023-2024学年高三上学期12月月考理科综合试题2024届四川省双流棠湖中学高三上学期第一次联考理科综合能力测试试题(已下线)化学(九省联考考后提升卷,江西卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)热点08 表格型实验方案的设计与评价(已下线)专题03 化学实验基础-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)



