名校
解题方法
1 . I.甲醇是重要的化工原料,发展前景广阔。
温度为T1时,向容积为2L的密闭容器甲、乙中分别充入一定量的CO和H2O(g),发生反应:CO(g) + H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g) 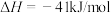 。相关数据如下:
。相关数据如下:
(1)甲容器中,反应在t1 min 内的平均速率v(H2)= ___________ mol/(L·min)。
(2)甲容器中,平衡时,反应放出的热量___________ kJ。
(3)T1时,反应的平衡常数K甲=___________ 。
(4)乙容器中,a=___________ mol。
II.实验探究
兴趣小组同学为探究影响化学反应速率及化学平衡的因素,设计以下实验:___________ 。
(6)利用实验II探究浓度对化学平衡的影响。
已知:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+ 推测B试管中实验现象为
(黄色)+2H+ 推测B试管中实验现象为___________ ,用平衡移动原理解释原因:___________ 。
(7)该小组同学继续用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
已知: 。
。
①由实验i、实验ii可得出的结论是___________ 。
②关于实验ii中80s后溶液颜色迅速变浅的原因,该小组同学提出了猜想:反应中生成的Mn2+对反应有催化作用。利用下列提供的试剂设计实验iii,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸, MnSO4固体,蒸馏水。
补全实验iii的操作:向试管中先加入5mL0.01mol/L酸性KMnO4溶液,___________ ,最后加入5mL0.1mol/L草酸溶液。
温度为T1时,向容积为2L的密闭容器甲、乙中分别充入一定量的CO和H2O(g),发生反应:CO(g) + H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g) 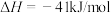 。相关数据如下:
。相关数据如下:| 容器 | 甲 | 乙 | ||
| 反应物 | CO | H2O | CO | H2O |
| 起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
| 平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
| 达到平衡的时间(min) | t1 | t2 | ||
(2)甲容器中,平衡时,反应放出的热量
(3)T1时,反应的平衡常数K甲=
(4)乙容器中,a=
II.实验探究
兴趣小组同学为探究影响化学反应速率及化学平衡的因素,设计以下实验:

(6)利用实验II探究浓度对化学平衡的影响。
已知:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+ 推测B试管中实验现象为
(黄色)+2H+ 推测B试管中实验现象为(7)该小组同学继续用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
| 编号 | 实验操作 | 实验现象 |
| i | 向一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入5mL0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅,30min后几乎变为无色 |
| ii | 向另一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,最后加入5mL0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
 。
。①由实验i、实验ii可得出的结论是
②关于实验ii中80s后溶液颜色迅速变浅的原因,该小组同学提出了猜想:反应中生成的Mn2+对反应有催化作用。利用下列提供的试剂设计实验iii,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸, MnSO4固体,蒸馏水。
补全实验iii的操作:向试管中先加入5mL0.01mol/L酸性KMnO4溶液,
您最近一年使用:0次
2 . 电解质的水溶液跟日常生活、工农业生产和环境保护息息相关。常温下,叠氮酸 是一元弱酸,高锰酸
是一元弱酸,高锰酸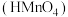 是一元强酸,
是一元强酸, 的高铼酸
的高铼酸 、
、 的高锰酸
的高锰酸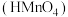 溶液分别与
溶液分别与 的
的 溶液等体积混合,所得溶液均呈中性。请回答下列问题:
溶液等体积混合,所得溶液均呈中性。请回答下列问题:
(1)高铼酸属于___________ (填“强”或“弱”)酸,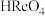 中Re的化合价为
中Re的化合价为___________ 。
(2)常温下,已知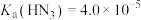 ,则
,则 的
的 溶液中
溶液中
___________  。
。
(3)已知25°C时, 的
的 ;
; 的:
的: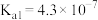
 ;HCN的
;HCN的 ,回答下列问题:
,回答下列问题:
①25°C时,向NaCN溶液中通入少量 ,反应的离子方程式为
,反应的离子方程式为___________ 。
②下列措施中能使醋酸的水溶液中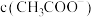 增大的同时
增大的同时 减小的是
减小的是___________ (填标号)。
A.加入 固体 B.加入固体
固体 B.加入固体 C.加入NaCN固体 D.升高温度
C.加入NaCN固体 D.升高温度
(4)常温时
 溶液,
溶液, 浓度为
浓度为___________ ,由水电离的 为
为___________ 。
 是一元弱酸,高锰酸
是一元弱酸,高锰酸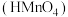 是一元强酸,
是一元强酸, 的高铼酸
的高铼酸 、
、 的高锰酸
的高锰酸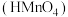 溶液分别与
溶液分别与 的
的 溶液等体积混合,所得溶液均呈中性。请回答下列问题:
溶液等体积混合,所得溶液均呈中性。请回答下列问题:(1)高铼酸属于
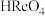 中Re的化合价为
中Re的化合价为(2)常温下,已知
 ,则
,则 的
的 溶液中
溶液中
 。
。(3)已知25°C时,
 的
的 ;
; 的:
的: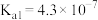
 ;HCN的
;HCN的 ,回答下列问题:
,回答下列问题:①25°C时,向NaCN溶液中通入少量
 ,反应的离子方程式为
,反应的离子方程式为②下列措施中能使醋酸的水溶液中
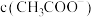 增大的同时
增大的同时 减小的是
减小的是A.加入
 固体 B.加入固体
固体 B.加入固体 C.加入NaCN固体 D.升高温度
C.加入NaCN固体 D.升高温度(4)常温时

 溶液,
溶液, 浓度为
浓度为 为
为
您最近一年使用:0次
名校
解题方法
3 . 氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示:_____ 。
(2)关于这两种晶体的说法,正确的是______ 。(填序号)
a.立方相氮化硼含有 键和
键和 键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的 键均为共价键 d.两种晶体均为分子晶体
键均为共价键 d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为_______ ,其结构与石墨相似却不导电,原因是_______ 。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为_____ 。该晶体的天然矿物在青藏高原地下约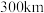 的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是
的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是_______ 。
(5)单质硼有无定形和晶体两种,参考下列数据:
①晶体硼的晶体类型属于________ 晶体。
②已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图所示),各正二十面体之间以 键相互联结,在每个正二十面体中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由
键相互联结,在每个正二十面体中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由______ 个硼原子构成,其中 键之间的键角是
键之间的键角是_____ 。

(2)关于这两种晶体的说法,正确的是
a.立方相氮化硼含有
 键和
键和 键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软c.两种晶体中的
 键均为共价键 d.两种晶体均为分子晶体
键均为共价键 d.两种晶体均为分子晶体(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为
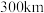 的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是
的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是(5)单质硼有无定形和晶体两种,参考下列数据:
| 晶体 | 金刚石 | 晶体硅 | 晶体硼 |
熔点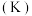 | 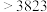 | 1683 | 2573 |
沸点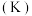 | 5100 | 2628 | 2823 |
硬度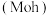 | 10 | 7.0 | 9.5 |
②已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图所示),各正二十面体之间以
 键相互联结,在每个正二十面体中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由
键相互联结,在每个正二十面体中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由 键之间的键角是
键之间的键角是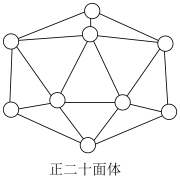
您最近一年使用:0次
4 . 某化学兴趣小组,在学习分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
根据这些数据分析,下列说法正确的是
 |  |  |  |  | |
熔点 | 801 | 712 | 190 |  | 148 |
沸点 | 1465 | 1418 | 182.7 | 57 | 160 |
A.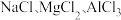 均为离子晶体 均为离子晶体 | B. 均为分子晶体 均为分子晶体 |
C. 的化学键离子成分低于 的化学键离子成分低于 | D.加热 晶体发生熔化时破坏的作用力为共价键 晶体发生熔化时破坏的作用力为共价键 |
您最近一年使用:0次
名校
解题方法
5 . 按照要求回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_____ 方法区分晶体、准晶体和非晶体。
(2) 单质为体心立方晶体,其晶胞参数
单质为体心立方晶体,其晶胞参数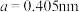 ,晶胞中铁原子的配位数为
,晶胞中铁原子的配位数为______ ,铁原子半径为______ ,列式表示铁晶胞的空间利用率____ 。(不必计算出结果)
(3)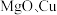 和干冰的晶胞示意图如图:
和干冰的晶胞示意图如图:________ 。
②在 晶体中,与
晶体中,与 相邻且最近的
相邻且最近的 个数为
个数为_______ ; 配位数为
配位数为_______ 。
③每个 晶胞中平均有
晶胞中平均有_____ 个 原子。
原子。
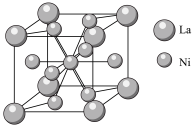
④金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,若阿伏加德罗常数为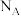 晶胞边长为
晶胞边长为 ,晶胞的密度为
,晶胞的密度为______ 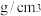 。
。 晶胞中,
晶胞中, 原子半径为
原子半径为 原子半径为
原子半径为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,
表示, 的密度可表示为
的密度可表示为____  。
。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)
 单质为体心立方晶体,其晶胞参数
单质为体心立方晶体,其晶胞参数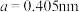 ,晶胞中铁原子的配位数为
,晶胞中铁原子的配位数为(3)
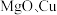 和干冰的晶胞示意图如图:
和干冰的晶胞示意图如图:
②在
 晶体中,与
晶体中,与 相邻且最近的
相邻且最近的 个数为
个数为 配位数为
配位数为③每个
 晶胞中平均有
晶胞中平均有 原子。
原子。④金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,若阿伏加德罗常数为
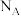 晶胞边长为
晶胞边长为 ,晶胞的密度为
,晶胞的密度为 。
。
 晶胞中,
晶胞中, 原子半径为
原子半径为 原子半径为
原子半径为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,
表示, 的密度可表示为
的密度可表示为 。
。
您最近一年使用:0次
名校
解题方法
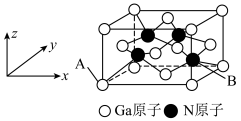
6 . A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的电负性由小到大的顺序为_______ (用元素符号表示)。
(2)B单质的熔点比C单质熔点_______ ,B的氯化物的熔点比C的氯化物的熔点_______ (填高或低)。理由_______ 。
(3) 形成某种化合物的晶胞结构如图所示,该化合物的化学式为
形成某种化合物的晶胞结构如图所示,该化合物的化学式为_______ 。_______ 。
(1)A、B、C、D的电负性由小到大的顺序为
(2)B单质的熔点比C单质熔点
(3)
 形成某种化合物的晶胞结构如图所示,该化合物的化学式为
形成某种化合物的晶胞结构如图所示,该化合物的化学式为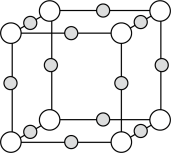
您最近一年使用:0次
名校
7 . 按照要求填空:
(1)判断下列分子的极性、分子的空间构型和中心原子的杂化方式。
(2)① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ 。
。
①既有 键,又有
键,又有 键的是
键的是_______ (用序号作答);既含有极性键又含有非极性键的极性分子的电子式为_______ ;既含有极性键又含有非极性键的非极性分子中碳原子的杂化方式为________ ;苯环中存在的大 键可表示为
键可表示为________ 。
②属于离子化合物的物质的电子式为______ ; 与
与 结构相似,则
结构相似,则 的电子式为
的电子式为_____ ; 中
中 键和
键和 键之比为
键之比为______ 。
(1)判断下列分子的极性、分子的空间构型和中心原子的杂化方式。
| 序号 | 化学式 | 分子的极性 | 空间构型 | 中心原子的杂化方式 |
| ① |  | |||
| ② |  | |||
| ③ |  | - |
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ 。
。①既有
 键,又有
键,又有 键的是
键的是 键可表示为
键可表示为②属于离子化合物的物质的电子式为
 与
与 结构相似,则
结构相似,则 的电子式为
的电子式为 中
中 键和
键和 键之比为
键之比为
您最近一年使用:0次
名校
解题方法
8 . 按要求回答下列问题:
(1)基态 原子中,核外电子排布式为
原子中,核外电子排布式为________ ,核外电子占据的最高能层电子的电子云轮廓图形状为_______ ,它在周期表中的位置为_______ ,与钛同周期元素的基态原子中,未成对电子数与钛相同的元素有____ 种。
(2) 与
与 形成
形成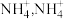 中
中 键角比
键角比 中
中 键角大,原因是
键角大,原因是______ , 中
中 键角
键角__  中
中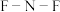 键角(填写“大于”“小于”或“等于”)。
键角(填写“大于”“小于”或“等于”)。
(3)比较①乙酸②甲酸③二氯乙酸的酸性由强到弱的顺序为_______ (填序号);比较① ②
② ③
③ 的熔点由低到高的顺序为
的熔点由低到高的顺序为________ (填序号);比较①晶体硅 ②晶体锗 ③ ④
④ 的熔点由低到高的顺序为
的熔点由低到高的顺序为_______ (填序号)。
(4)在周期表中,与 化学性质最相似的邻族元素是
化学性质最相似的邻族元素是______ ,该元素的最高正价氧化物对应的水化物与氢氧化钠反应的离子方程式为______ 。
(5) 等是有机反应中重要的中间体。碳正离子
等是有机反应中重要的中间体。碳正离子 可以通过
可以通过 在“超强酸”中获得1个
在“超强酸”中获得1个 而得到,而
而得到,而 失去
失去 可得
可得 。
。
① 是反应性很强的正离子,是缺电子的,其电子式是
是反应性很强的正离子,是缺电子的,其电子式是______ 。
② 中4个原子是共平面的,3个键角相等,键角应是
中4个原子是共平面的,3个键角相等,键角应是_______ 。
(1)基态
 原子中,核外电子排布式为
原子中,核外电子排布式为(2)
 与
与 形成
形成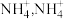 中
中 键角比
键角比 中
中 键角大,原因是
键角大,原因是 中
中 键角
键角 中
中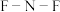 键角(填写“大于”“小于”或“等于”)。
键角(填写“大于”“小于”或“等于”)。(3)比较①乙酸②甲酸③二氯乙酸的酸性由强到弱的顺序为
 ②
② ③
③ 的熔点由低到高的顺序为
的熔点由低到高的顺序为 ④
④ 的熔点由低到高的顺序为
的熔点由低到高的顺序为(4)在周期表中,与
 化学性质最相似的邻族元素是
化学性质最相似的邻族元素是(5)
 等是有机反应中重要的中间体。碳正离子
等是有机反应中重要的中间体。碳正离子 可以通过
可以通过 在“超强酸”中获得1个
在“超强酸”中获得1个 而得到,而
而得到,而 失去
失去 可得
可得 。
。①
 是反应性很强的正离子,是缺电子的,其电子式是
是反应性很强的正离子,是缺电子的,其电子式是②
 中4个原子是共平面的,3个键角相等,键角应是
中4个原子是共平面的,3个键角相等,键角应是
您最近一年使用:0次
名校
解题方法
9 . 铁与镁组成的储氢合金的立方晶胞结构如图所示,铁原子位于顶点和面心的位置,镁原子位于将晶胞平分8个立方单位的体心位置下列说法正确的是

A. 原子的配位数为6 原子的配位数为6 |
B. 位置原子的分数坐标 位置原子的分数坐标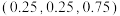 |
C. 原子与镁原子间最短距离为 原子与镁原子间最短距离为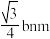 |
D.晶体储氢时, 在晶胞的体心和棱的中心位置,若储氢后化学式为 在晶胞的体心和棱的中心位置,若储氢后化学式为 ,则储氢率为 ,则储氢率为 |
您最近一年使用:0次
10 .  晶体的晶胞如图所示,阿伏加德罗常数的值用
晶体的晶胞如图所示,阿伏加德罗常数的值用 表示。下列有关说法错误的是
表示。下列有关说法错误的是
 晶体的晶胞如图所示,阿伏加德罗常数的值用
晶体的晶胞如图所示,阿伏加德罗常数的值用 表示。下列有关说法错误的是
表示。下列有关说法错误的是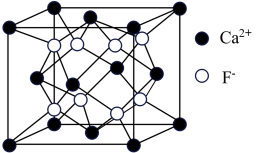
A.距离 最近且等距离的 最近且等距离的 有12个 有12个 |
B.基态F原子的电子排布式为 |
C.距离 最近且等距离的 最近且等距离的 有6个 有6个 |
D.若 晶胞的棱长为 晶胞的棱长为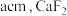 的密度为 的密度为 |
您最近一年使用:0次



