名校
1 . 有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20.其中只有C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为 ;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
请回答下列问题:
(1)C是_______ (填元素名称)。
(2)上述元素中位于s区的有_______ (填元素符号)。
(3)与 互为等电子体的阴离子为
互为等电子体的阴离子为_______ 。
(4)已知C的氧化物CO与NiO的晶体结构相同,其中 和
和 的离子半径分别为66pm和69pm,则熔点:CO
的离子半径分别为66pm和69pm,则熔点:CO_____ NiO(填“>”“<”或“=”)。
(5)浸金时,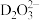 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成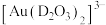 。
。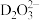 中的配位原子为
中的配位原子为_____ (填元素符号),其位置在______ (填“中心”或“端位”),理由是______ 。
 ;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。请回答下列问题:
(1)C是
(2)上述元素中位于s区的有
(3)与
 互为等电子体的阴离子为
互为等电子体的阴离子为(4)已知C的氧化物CO与NiO的晶体结构相同,其中
 和
和 的离子半径分别为66pm和69pm,则熔点:CO
的离子半径分别为66pm和69pm,则熔点:CO(5)浸金时,
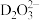 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成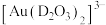 。
。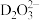 中的配位原子为
中的配位原子为
您最近一年使用:0次
名校
解题方法
2 . 用磷铁渣(含Fe、FeP、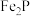 及少量杂质)制备磷酸铁晶体(
及少量杂质)制备磷酸铁晶体( )的工艺流程如下:
)的工艺流程如下:___________ 。
(2)“浸取”时,硝酸浓度过高会较多分解,化学方程式是___________ 。
(3)废气中含有 、NO,直接排放产生的危害主要有
、NO,直接排放产生的危害主要有___________ (写出两项),加入活性炭的目的是吸附氮氧化物;若用NaOH溶液吸收,物质的量比为 的
的 、NO被完全吸收转化生成的是一种盐,盐中Na、N质量比为
、NO被完全吸收转化生成的是一种盐,盐中Na、N质量比为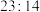 ,其化学式是
,其化学式是___________ 。
(4)若HNO₃的还原产物为NO,与1molFe2P完全反应而生成的NO有___________ mol。
(5)实验室完成操作X中用到的玻璃仪器有:烧杯、___________ 。
(6)“调pH”时,碱性过高产物中含铁量会增大,其原因有可能为___________ 。
(7)最终产品应洗涤,检验是否洗净的试剂是___________ 。
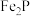 及少量杂质)制备磷酸铁晶体(
及少量杂质)制备磷酸铁晶体( )的工艺流程如下:
)的工艺流程如下:
(2)“浸取”时,硝酸浓度过高会较多分解,化学方程式是
(3)废气中含有
 、NO,直接排放产生的危害主要有
、NO,直接排放产生的危害主要有 的
的 、NO被完全吸收转化生成的是一种盐,盐中Na、N质量比为
、NO被完全吸收转化生成的是一种盐,盐中Na、N质量比为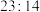 ,其化学式是
,其化学式是(4)若HNO₃的还原产物为NO,与1molFe2P完全反应而生成的NO有
(5)实验室完成操作X中用到的玻璃仪器有:烧杯、
(6)“调pH”时,碱性过高产物中含铁量会增大,其原因有可能为
(7)最终产品应洗涤,检验是否洗净的试剂是
您最近一年使用:0次
名校
解题方法
3 . 含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1) 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是___________ ,原因是___________ 。
(2) 与C处于同一族,
与C处于同一族, 的几何构型为
的几何构型为___________ 。
(3)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是___________(填标号)。
(4)如图是硫的四种含氧酸根的结构: 转化为
转化为 的是
的是___________ (填标号)。理由是___________ 。
(5)如图是CZTS四元半导体化合物的四方晶胞。该物质的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若图中A原子的坐标为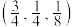 ,则B的原子坐标为
,则B的原子坐标为___________ 。
(1)
 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是(2)
 与C处于同一族,
与C处于同一族, 的几何构型为
的几何构型为(3)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是___________(填标号)。
A. | B. |
C. | D.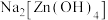 |
(4)如图是硫的四种含氧酸根的结构:
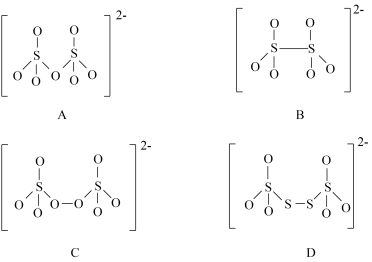
 转化为
转化为 的是
的是(5)如图是CZTS四元半导体化合物的四方晶胞。该物质的化学式为
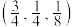 ,则B的原子坐标为
,则B的原子坐标为
您最近一年使用:0次
名校
4 . 冠醚是一种超分子,它是由多个二元醇分子之间脱水形成的环状化合物。18—冠—6可用作相转移催化其与 形成的螯合离子结构如图所示。下列说法正确的是
形成的螯合离子结构如图所示。下列说法正确的是
 形成的螯合离子结构如图所示。下列说法正确的是
形成的螯合离子结构如图所示。下列说法正确的是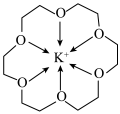
| A.该螯合离子形成的晶体类型为分子晶体 |
B.与二甲醚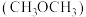 相比,该整合离子中“C-O-C”键角更大 相比,该整合离子中“C-O-C”键角更大 |
| C.该螯合离子中碳原子与氧原子杂化类型不同 |
| D.该螯合离子中所有非氢原子可以位于同一平面 |
您最近一年使用:0次
名校
5 . NO、 、CO是常见的空气污染气体。在某分子筛的催化作用下,
、CO是常见的空气污染气体。在某分子筛的催化作用下, 可脱除废气中的NO和
可脱除废气中的NO和 ,生成两种无害物质,其反应历程如图所示。下列说法不正确的是
,生成两种无害物质,其反应历程如图所示。下列说法不正确的是
 、CO是常见的空气污染气体。在某分子筛的催化作用下,
、CO是常见的空气污染气体。在某分子筛的催化作用下, 可脱除废气中的NO和
可脱除废气中的NO和 ,生成两种无害物质,其反应历程如图所示。下列说法不正确的是
,生成两种无害物质,其反应历程如图所示。下列说法不正确的是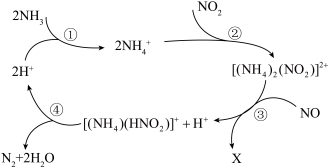
| A.历程中反应①②都是非氧化还原反应 |
B. 中不含有 中不含有 价的N 价的N |
C.X是 和 和 ,其中 ,其中 的电子式是 的电子式是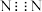 |
D.汽车尾气中的氮氧化合物主要是高温下气缸里的 、 、 反应产生的 反应产生的 |
您最近一年使用:0次
6 . 下列由实验操作和相应现象得出的实验结论正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 溴水中加入汽油,充分振荡后静置 | 下层的水溶液几乎无色 | 汽油中含有不饱和烃 |
| B | 向含有 的 的 溶液中通气体X 溶液中通气体X | 产生白色沉淀 | X一定表现氧化性 |
| C | 向某钠盐中滴加稀盐酸,并将产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该钠盐为 |
| D | 取少量白色晶体于试管,加入氢氧化钠溶液并加热 | 试管口附近湿润的红色石蕊试纸变蓝 | 白色晶体一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 金属的冶炼体现了人类文明的发展水平。下列有关金属冶炼的说法不正确的是
A.工业上用焦炭还原 制取密度小、耐腐蚀的金属铝 制取密度小、耐腐蚀的金属铝 |
| B.金属被人类开发利用的先后顺序主要取决于金属的活动性,不是在地壳中的含量 |
| C.金属的冶炼是将金属元素由化合态还原为游离态 |
| D.金属Mg、Na工业上都是用电解熔融氯化物的方法冶炼 |
您最近一年使用:0次
名校
8 . 草酸亚铁晶体( )是常用的分析试剂,可通过
)是常用的分析试剂,可通过 [硫酸亚铁铵晶体,易氧化]与草酸反应制得。制备并测定草酸亚铁晶体组成的实验设计如下,回答下列问题
[硫酸亚铁铵晶体,易氧化]与草酸反应制得。制备并测定草酸亚铁晶体组成的实验设计如下,回答下列问题
实验步骤:(连接好装置后)
(i)……;
(ii)加入试剂;
(iii)打开d、c,加热,通入氨气制得硫酸铵;
(iv)……(a、b止水夹“操作1”),加入稀硫酸,产生 ,赶出装置内的空气,……(a、b止水夹“操作2”),将A中的硫酸亚铁压入到B中;
,赶出装置内的空气,……(a、b止水夹“操作2”),将A中的硫酸亚铁压入到B中;
(v)将B中溶液倒入蒸发皿中,经系列操作得到硫酸亚铁铵。
(1)操作(i)为_______ 。
(2)操作(iv)产生H2,赶出装置内的空气的目的为_______ ;a、b止水夹“操作2”为_______ 。
(3)用离子方程式表示装置B在操作(iii)时发生的反应_______ ;装置B中存在一处缺陷为_______ 。
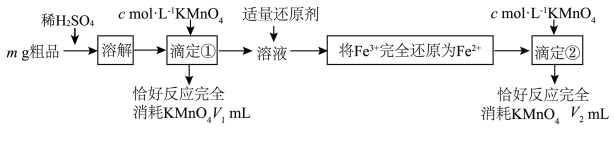
Ⅱ.制备草酸亚铁晶体并测定其组成。
将制得的硫酸亚铁铵与草酸在一定条件下混合加热,经沉淀,抽滤、洗涤获得草酸亚铁晶体粗品。该草酸亚铁晶体 粗品中可能含有的杂质为
粗品中可能含有的杂质为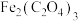 、
、 ,采用
,采用 溶液滴定法测定该粗品的组成,实验过程如下图。
溶液滴定法测定该粗品的组成,实验过程如下图。
已知:草酸为弱酸,可被 溶液氧化为
溶液氧化为 。
。 ,还有
,还有_______ 。
(5)样品中所含 (摩尔质量为
(摩尔质量为 )的质量分数表达式
)的质量分数表达式_______ 。
 )是常用的分析试剂,可通过
)是常用的分析试剂,可通过 [硫酸亚铁铵晶体,易氧化]与草酸反应制得。制备并测定草酸亚铁晶体组成的实验设计如下,回答下列问题
[硫酸亚铁铵晶体,易氧化]与草酸反应制得。制备并测定草酸亚铁晶体组成的实验设计如下,回答下列问题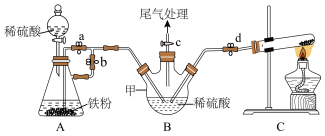
实验步骤:(连接好装置后)
(i)……;
(ii)加入试剂;
(iii)打开d、c,加热,通入氨气制得硫酸铵;
(iv)……(a、b止水夹“操作1”),加入稀硫酸,产生
 ,赶出装置内的空气,……(a、b止水夹“操作2”),将A中的硫酸亚铁压入到B中;
,赶出装置内的空气,……(a、b止水夹“操作2”),将A中的硫酸亚铁压入到B中;(v)将B中溶液倒入蒸发皿中,经系列操作得到硫酸亚铁铵。
(1)操作(i)为
(2)操作(iv)产生H2,赶出装置内的空气的目的为
(3)用离子方程式表示装置B在操作(iii)时发生的反应
Ⅱ.制备草酸亚铁晶体并测定其组成。
将制得的硫酸亚铁铵与草酸在一定条件下混合加热,经沉淀,抽滤、洗涤获得草酸亚铁晶体粗品。该草酸亚铁晶体
 粗品中可能含有的杂质为
粗品中可能含有的杂质为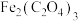 、
、 ,采用
,采用 溶液滴定法测定该粗品的组成,实验过程如下图。
溶液滴定法测定该粗品的组成,实验过程如下图。已知:草酸为弱酸,可被
 溶液氧化为
溶液氧化为 。
。
 ,还有
,还有(5)样品中所含
 (摩尔质量为
(摩尔质量为 )的质量分数表达式
)的质量分数表达式
您最近一年使用:0次
名校
9 . “零碳甲醇”是符合“碳中和”属性的绿色能源。请回答下列有关问题。
(1)已知: ;
; ,
, (a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围
(a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围_____ K(用含a、b的代数式表示)。
(2)某温度下,用 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液pOH=
,则该溶液pOH=_____ (该温度下 的
的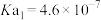 、
、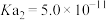 、
、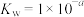 ,用含a的代数式表示)。
,用含a的代数式表示)。
(3)合成甲醇有两种方法。
直接法:
Ⅰ.
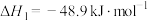
间接法: 和
和 通过逆水煤气反应,先合成CO后,CO和
通过逆水煤气反应,先合成CO后,CO和 再合成甲醇。
再合成甲醇。
Ⅱ.
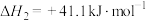
Ⅲ.
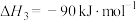
①若利用间接工艺法合成甲醇,反应的决速步为逆水煤气反应,下列示意图中能体现上述反应体系能量变化的是_____ (填字母)。_____ 。
③一定温度、50bar(1bar=100kPa)恒压下,按进料气含a% 、3a%
、3a% (体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则
(体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则
_____ bar,反应的平衡常数
_____  (用含a的代数式表示)。
(用含a的代数式表示)。
(4)甲醇、乙醇、正丙醇三种物质在温度传感器尖头处蒸发时的温度变化曲线如图,根据曲线下降的幅度和速率的快慢,可以比较分子间作用力的大小。请判断表示甲醇的曲线是_____ ,理由是_____ 。
(1)已知:
 ;
; ,
, (a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围
(a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围(2)某温度下,用
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液pOH=
,则该溶液pOH= 的
的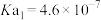 、
、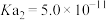 、
、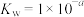 ,用含a的代数式表示)。
,用含a的代数式表示)。(3)合成甲醇有两种方法。
直接法:
Ⅰ.

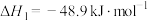
间接法:
 和
和 通过逆水煤气反应,先合成CO后,CO和
通过逆水煤气反应,先合成CO后,CO和 再合成甲醇。
再合成甲醇。Ⅱ.

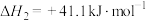
Ⅲ.

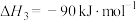
①若利用间接工艺法合成甲醇,反应的决速步为逆水煤气反应,下列示意图中能体现上述反应体系能量变化的是


③一定温度、50bar(1bar=100kPa)恒压下,按进料气含a%
 、3a%
、3a% (体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则
(体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则

 (用含a的代数式表示)。
(用含a的代数式表示)。(4)甲醇、乙醇、正丙醇三种物质在温度传感器尖头处蒸发时的温度变化曲线如图,根据曲线下降的幅度和速率的快慢,可以比较分子间作用力的大小。请判断表示甲醇的曲线是

您最近一年使用:0次
名校
10 . 氯化磷酸三钠熔点67℃,常温下较稳定,受热易分解,具有良好的消杀、漂白作用,广泛用于医药、餐饮行业。某小组设计如下流程制备氯化磷酸三钠。下列叙述错误的是
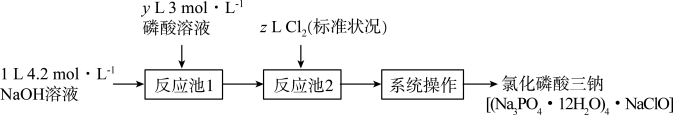
| A.理论上制得的氯化磷酸三钠不超过0.3mol |
B.“反应池1”中最少应加入400mL3 磷酸溶液 磷酸溶液 |
| C.“系列操作”包括蒸发浓缩、降温结晶、过滤、洗涤和高温烘干 |
| D.氧化磷酸三钠因含NaClO而具有消杀、漂白作用 |
您最近一年使用:0次



