名校
1 . 工业上用 处理氨氮水的原理如图所示。
处理氨氮水的原理如图所示。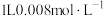 的氨水分别和不同量的
的氨水分别和不同量的 混合,测得溶液中氨去除率、总氮(
混合,测得溶液中氨去除率、总氮( 和
和 的总和)残余率与
的总和)残余率与 投入量(用x表示)的关系如图所示。下列说法错误的是
投入量(用x表示)的关系如图所示。下列说法错误的是
 处理氨氮水的原理如图所示。
处理氨氮水的原理如图所示。
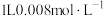 的氨水分别和不同量的
的氨水分别和不同量的 混合,测得溶液中氨去除率、总氮(
混合,测得溶液中氨去除率、总氮( 和
和 的总和)残余率与
的总和)残余率与 投入量(用x表示)的关系如图所示。下列说法错误的是
投入量(用x表示)的关系如图所示。下列说法错误的是
A.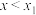 时, 时, 主要被氧化为 主要被氧化为 |
B.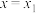 时,生成的 时,生成的 的物质的量为 的物质的量为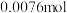 |
C.生成硝氮的离子方程式: |
D. 时,分批加入 时,分批加入 可以降低总氮残余率 可以降低总氮残余率 |
您最近一年使用:0次
名校
2 . 某种分解氯化铵实现产物分离的原理如图所示,其中b、d代表 或
或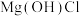 中的一种。下列说法正确的是
中的一种。下列说法正确的是
 或
或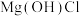 中的一种。下列说法正确的是
中的一种。下列说法正确的是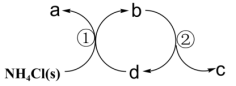
A. 是离子化合物,晶体中只含离子键 是离子化合物,晶体中只含离子键 |
| B.反应①中,增大压强可以加快a的生成速率 |
| C.反应②中,有离子键的断裂和共价键生成 |
D.d是 ,常用它与水反应制备 ,常用它与水反应制备 |
您最近一年使用:0次
名校
3 . 按要求回答下列各题:
(1)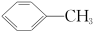 的一溴代物有
的一溴代物有___________ 种。
(2)茅苍术醇(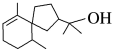 )的分子式为
)的分子式为_________ ,所含官能团名称为_________ 。
(3)用系统命名法命名物质 :
:___________ ;
(4)环癸五烯分子结构可表示为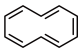 。环癸五烯具有的性质有
。环癸五烯具有的性质有___________ 。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(5)写出 的一种同分异构体的结构简式:
的一种同分异构体的结构简式:___________ 。
(6)某物质只含 、
、 、
、 三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)
三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)___________ 。
②下列物质中,与该物质互为同分异构体的是___________ (填字母)。
A.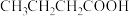 B.
B.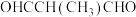
C.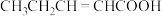 D.
D.
③该分子中共平面的原子个数最多为___________ 个(已知羧基的四个原子可以共平面)。
④该物质与 反应的化学方程式为
反应的化学方程式为___________ 。
(1)
 的一溴代物有
的一溴代物有(2)茅苍术醇(
 )的分子式为
)的分子式为(3)用系统命名法命名物质
 :
:(4)环癸五烯分子结构可表示为
 。环癸五烯具有的性质有
。环癸五烯具有的性质有a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(5)写出
 的一种同分异构体的结构简式:
的一种同分异构体的结构简式:(6)某物质只含
 、
、 、
、 三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)
三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)
②下列物质中,与该物质互为同分异构体的是
A.
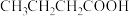 B.
B.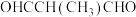
C.
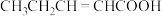 D.
D.
③该分子中共平面的原子个数最多为
④该物质与
 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
名校
4 . 单质硼、硼酸( )、硼砂(
)、硼砂( )中阴离子
)中阴离子 的结构或结构单元分别如图1、图2、图3所示。
的结构或结构单元分别如图1、图2、图3所示。
(1)图1为某晶体硼的部分结构单元,其熔点为 ,属于
,属于___________ 晶体,该结构单元由20个等边三角形构成,则构成此结构单元的B原子数为___________ 。
(2)图2为硼酸晶体的平面结构,硼酸晶体中存在的作用力有___________ (填标号)
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(3) 与
与 溶液反应时,反应方程式为
溶液反应时,反应方程式为 ,则
,则 是
是___________ 弱酸(填“一元”或“三元”);当 过量时,反应得到硼砂晶体,其化学方程式为
过量时,反应得到硼砂晶体,其化学方程式为 ,硼砂阴离子
,硼砂阴离子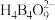 的结构如图3所示,其中
的结构如图3所示,其中 原子的杂化方式为
原子的杂化方式为___________ 。
(4)B、Al,Ga为同主族元素, ,
, 在一定条件下均易形成双聚分子,而
在一定条件下均易形成双聚分子,而 却很难形成双聚分子,其主要原因是
却很难形成双聚分子,其主要原因是 分子内形成了大
分子内形成了大 键,该大
键,该大 键可表示为
键可表示为___________ 。(分子中的大 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大
代表参与形成大 键的原子数,
键的原子数, 代表参与形成大
代表参与形成大 键的电子数)
键的电子数)
 )、硼砂(
)、硼砂( )中阴离子
)中阴离子 的结构或结构单元分别如图1、图2、图3所示。
的结构或结构单元分别如图1、图2、图3所示。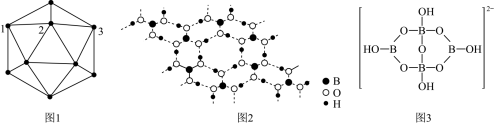
(1)图1为某晶体硼的部分结构单元,其熔点为
 ,属于
,属于(2)图2为硼酸晶体的平面结构,硼酸晶体中存在的作用力有
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(3)
 与
与 溶液反应时,反应方程式为
溶液反应时,反应方程式为 ,则
,则 是
是 过量时,反应得到硼砂晶体,其化学方程式为
过量时,反应得到硼砂晶体,其化学方程式为 ,硼砂阴离子
,硼砂阴离子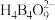 的结构如图3所示,其中
的结构如图3所示,其中 原子的杂化方式为
原子的杂化方式为(4)B、Al,Ga为同主族元素,
 ,
, 在一定条件下均易形成双聚分子,而
在一定条件下均易形成双聚分子,而 却很难形成双聚分子,其主要原因是
却很难形成双聚分子,其主要原因是 分子内形成了大
分子内形成了大 键,该大
键,该大 键可表示为
键可表示为 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大
代表参与形成大 键的原子数,
键的原子数, 代表参与形成大
代表参与形成大 键的电子数)
键的电子数)
您最近一年使用:0次
解题方法
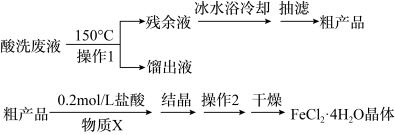
5 . 镀锌钢构件的酸洗废液中含有2.5mol。L-1盐酸、50%FeCl2·4H2O和2%ZnCl2。实验室从酸洗废液中回收盐酸和FeCl2·4H2O的实验流程如下:
回答下列问题:
I.回收盐酸和FeCl2·4H2O粗产品
(1)操作1应选择___________ (填序号)。
A.水浴加热 B.油浴加热 C.投入沸石
(2)为了获得FeCl2·4H2O粗产品,应加热至留有少量残余液时立即停止。
①立即停止可以避免Fe2+被氧化外,还能___________ 。
②如果残余液过多,可能会导致___________ 。(答一条)
Ⅱ.FeCl2·4H2O粗产品的重结晶
(3)检验FeCl2·4H2O粗产品中含有Fe3+的操作方法是___________ 。
(4)重结晶前加入的物质X为___________ ;操作2的名称是___________ 。
Ⅲ.滴定亚铁离子,测定FeCl2·4H2O晶体纯度
准确称取ag重结晶后的FeCl2·4H2O晶体,溶于酸中并定容至100mL。移取三份25.00mL溶液,滴加几滴指示剂,用cmol。L-1K2Cr2O7标准溶液滴定至终点,半分钟内不恢复原色,消耗K2Cr2O7标准溶液平均体积为VmL(此时Cl-不被氧化)。(M【FeCl2·4H2O】=199 g·mol-1)
(5)计算FeCl2·4H2O晶体的纯度为___________ %(用含a、c的最简代数式表示)。
(6)亚甲基蓝可用作以上指示剂,其结构式如下图。MB可用N,N-二甲基苯胺(DMA)为原料制得。___________ 。
②亚甲基蓝中N原子的杂化方式有___________ 。
③DMA的碱性比苯胺强,说明理由___________ 。
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| FeCl2 | 49.7 | 59.0 | 62.5 | 66.7 | 70.0 | 78.3 | 88.7 | 94.9 |
| ZnCl2 | 342 | 363 | 395 | 437 | 452 | 488 | 541 | 614 |
I.回收盐酸和FeCl2·4H2O粗产品
(1)操作1应选择
A.水浴加热 B.油浴加热 C.投入沸石
(2)为了获得FeCl2·4H2O粗产品,应加热至留有少量残余液时立即停止。
①立即停止可以避免Fe2+被氧化外,还能
②如果残余液过多,可能会导致
Ⅱ.FeCl2·4H2O粗产品的重结晶
(3)检验FeCl2·4H2O粗产品中含有Fe3+的操作方法是
(4)重结晶前加入的物质X为
Ⅲ.滴定亚铁离子,测定FeCl2·4H2O晶体纯度
准确称取ag重结晶后的FeCl2·4H2O晶体,溶于酸中并定容至100mL。移取三份25.00mL溶液,滴加几滴指示剂,用cmol。L-1K2Cr2O7标准溶液滴定至终点,半分钟内不恢复原色,消耗K2Cr2O7标准溶液平均体积为VmL(此时Cl-不被氧化)。(M【FeCl2·4H2O】=199 g·mol-1)
(5)计算FeCl2·4H2O晶体的纯度为
(6)亚甲基蓝可用作以上指示剂,其结构式如下图。MB可用N,N-二甲基苯胺(DMA)为原料制得。

②亚甲基蓝中N原子的杂化方式有
③DMA的碱性比苯胺强,说明理由
您最近一年使用:0次
6 . 乙二胺四乙酸(EDTA)是一种重要的络合剂,其能与绝大多数的金属离子形成稳定的配合物,简易机理如图所示。下列叙述错误的是

| A.EDTA的核磁共振氢谱上有3组峰 | B.EDTA中含有两种官能团 |
| C.螯合物中含有4个sp2-pπ键 | D.螯合物中有5个五元螯合环 |
您最近一年使用:0次
解题方法
7 . 硝酸铈铵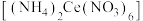 作为一种很强的氧化剂,在电子工业中应用广泛。某小组在实验室 模拟制备硝酸铈铵并测定其纯度。
作为一种很强的氧化剂,在电子工业中应用广泛。某小组在实验室 模拟制备硝酸铈铵并测定其纯度。
已知:① 易水解。②硝酸铈铵易溶于水和乙醇,难溶于浓硝酸。
易水解。②硝酸铈铵易溶于水和乙醇,难溶于浓硝酸。
I.由 溶液与
溶液与 反应制备
反应制备 ,装置如图所示:
,装置如图所示:___________ 。
(2)制备 溶液时应先打开活塞
溶液时应先打开活塞___________ (填“a”或“b”)。装置B中球泡的作用是___________ 。
(3)往制得的 溶液中逐滴加入
溶液中逐滴加入 溶液,可得
溶液,可得 固体,反应的离子方程式为
固体,反应的离子方程式为___________ ,该操作采用冷水浴的原因是___________ 。
Ⅱ.由 制
制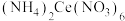 ,流程如下:
,流程如下:___________ 。
(5)洗涤产品的试剂是___________ 。
Ⅲ.测定产品纯度
(6)准确称取16.00g硝酸铈铵样品,加水溶解,配成100mL溶液。量取20.00mL溶液,移入250mL锥形瓶中,加入适量硫酸和磷酸,再加入2滴邻二氮菲指示剂,用 硫酸亚铁铵
硫酸亚铁铵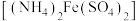 标准溶液滴定至终点,消耗标准溶液25.60mL。该样品中硝酸铈铵的质量分数为
标准溶液滴定至终点,消耗标准溶液25.60mL。该样品中硝酸铈铵的质量分数为___________ (保留3位有效数字)。已知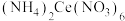 摩尔质量为
摩尔质量为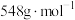 ,滴定反应为
,滴定反应为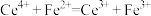
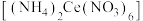 作为一种很强的氧化剂,在电子工业中应用广泛。某小组在实验室 模拟制备硝酸铈铵并测定其纯度。
作为一种很强的氧化剂,在电子工业中应用广泛。某小组在实验室 模拟制备硝酸铈铵并测定其纯度。已知:①
 易水解。②硝酸铈铵易溶于水和乙醇,难溶于浓硝酸。
易水解。②硝酸铈铵易溶于水和乙醇,难溶于浓硝酸。I.由
 溶液与
溶液与 反应制备
反应制备 ,装置如图所示:
,装置如图所示:
(2)制备
 溶液时应先打开活塞
溶液时应先打开活塞(3)往制得的
 溶液中逐滴加入
溶液中逐滴加入 溶液,可得
溶液,可得 固体,反应的离子方程式为
固体,反应的离子方程式为Ⅱ.由
 制
制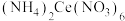 ,流程如下:
,流程如下: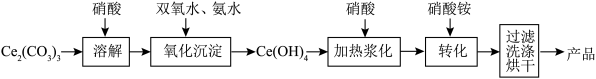
(5)洗涤产品的试剂是
Ⅲ.测定产品纯度
(6)准确称取16.00g硝酸铈铵样品,加水溶解,配成100mL溶液。量取20.00mL溶液,移入250mL锥形瓶中,加入适量硫酸和磷酸,再加入2滴邻二氮菲指示剂,用
 硫酸亚铁铵
硫酸亚铁铵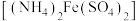 标准溶液滴定至终点,消耗标准溶液25.60mL。该样品中硝酸铈铵的质量分数为
标准溶液滴定至终点,消耗标准溶液25.60mL。该样品中硝酸铈铵的质量分数为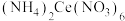 摩尔质量为
摩尔质量为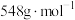 ,滴定反应为
,滴定反应为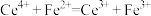
您最近一年使用:0次
8 . 工业生产中采用水解中和法处理含铜废水。常温下,向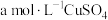 溶液中逐渐加入NaOH固体,发生的反应有:
溶液中逐渐加入NaOH固体,发生的反应有:
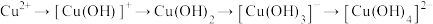
溶液中含铜微粒的分布系数随pH的变化如图所示。
(已知:分布系数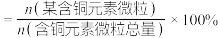 ;忽略加入固体后溶液体积的变化。)
;忽略加入固体后溶液体积的变化。)
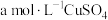 溶液中逐渐加入NaOH固体,发生的反应有:
溶液中逐渐加入NaOH固体,发生的反应有: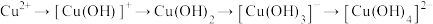
溶液中含铜微粒的分布系数随pH的变化如图所示。
(已知:分布系数
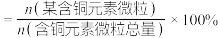 ;忽略加入固体后溶液体积的变化。)
;忽略加入固体后溶液体积的变化。)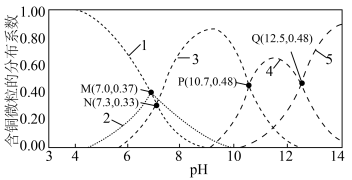
A.曲线4代表的含铜微粒为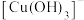 |
B. 时, 时,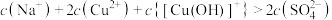 |
C. 的平衡常数为 的平衡常数为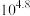 |
D.M点混合溶液中 的浓度为 的浓度为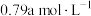 |
您最近一年使用:0次
2024-05-17更新
|
150次组卷
|
2卷引用:2024届福建省三明市高三下学期三模化学试题
9 . 我国力争2060年实现碳中和。 催化还原
催化还原 为减少
为减少 的排放提供良好的解决方案。涉及的主要反应有:
的排放提供良好的解决方案。涉及的主要反应有:
反应I: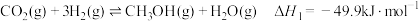
反应Ⅱ: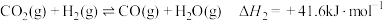
(1)已知下列物质的标准摩尔生成焓:
则甲醇燃烧的热化学方程式为___________ 。
(2)一定温度下,将 和
和 按物质的量之比1:4混合充入密闭容器中,10min后达到平衡。
按物质的量之比1:4混合充入密闭容器中,10min后达到平衡。
①关于该平衡体系的说法正确的是___________ (填标号)。
A.体系中各物质的浓度相等
B.降低温度,反应I和Ⅱ的速率都减小。
C.缩小容器体积,反应I和Ⅱ重新达到平衡的时间相同
D.恒温恒压下充入Ar,可提高 的选择性
的选择性
②若容器体积不变,初始压强为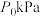 ,测得平衡时
,测得平衡时 的分压为
的分压为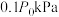 ,
, 的转化率为25%。从反应开始到平衡
的转化率为25%。从反应开始到平衡 的平均反应速率为
的平均反应速率为___________  (用分压表示)。反应Ⅱ的平衡常数
(用分压表示)。反应Ⅱ的平衡常数
___________ 。
(3)350℃、恒容条件下,只发生反应I,测得平衡体系中 的体积分数(
的体积分数( )与x[
)与x[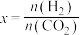 ,
,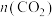 和
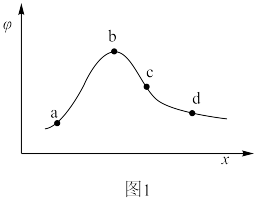
和 为初始的物质的量]的关系如图1所示。图中a、b、c、d四点
为初始的物质的量]的关系如图1所示。图中a、b、c、d四点 转化率最高的是
转化率最高的是___________ (填标号),理由是___________ 。b点对应的
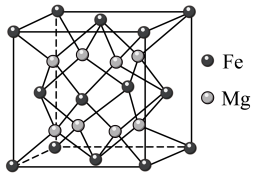
___________ 。___________ 空隙中。该合金每个晶胞可以储存4个氢分子,则 的合金储存氢气的物质的量为
的合金储存氢气的物质的量为___________ mol(阿伏加德罗常数的值为 )。
)。
 催化还原
催化还原 为减少
为减少 的排放提供良好的解决方案。涉及的主要反应有:
的排放提供良好的解决方案。涉及的主要反应有:反应I:
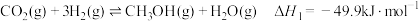
反应Ⅱ:
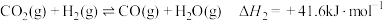
(1)已知下列物质的标准摩尔生成焓:
| 物质 |  |  |  |  |
标准摩尔生成焓 | 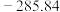 |  | 0 | 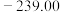 |
(2)一定温度下,将
 和
和 按物质的量之比1:4混合充入密闭容器中,10min后达到平衡。
按物质的量之比1:4混合充入密闭容器中,10min后达到平衡。①关于该平衡体系的说法正确的是
A.体系中各物质的浓度相等
B.降低温度,反应I和Ⅱ的速率都减小。
C.缩小容器体积,反应I和Ⅱ重新达到平衡的时间相同
D.恒温恒压下充入Ar,可提高
 的选择性
的选择性②若容器体积不变,初始压强为
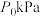 ,测得平衡时
,测得平衡时 的分压为
的分压为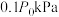 ,
, 的转化率为25%。从反应开始到平衡
的转化率为25%。从反应开始到平衡 的平均反应速率为
的平均反应速率为 (用分压表示)。反应Ⅱ的平衡常数
(用分压表示)。反应Ⅱ的平衡常数
(3)350℃、恒容条件下,只发生反应I,测得平衡体系中
 的体积分数(
的体积分数( )与x[
)与x[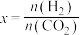 ,
,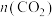 和
和 为初始的物质的量]的关系如图1所示。图中a、b、c、d四点
为初始的物质的量]的关系如图1所示。图中a、b、c、d四点 转化率最高的是
转化率最高的是
 的合金储存氢气的物质的量为
的合金储存氢气的物质的量为 )。
)。
您最近一年使用:0次
10 . 钌(Ru)是地球上丰度最小的元素,钌的产品广泛应用于电子、航空航天、化工等领域。从某种失效的钌催化剂(主要成分为Ru、ZnO、 、有机物等)中回收钌的工艺流程如下:
、有机物等)中回收钌的工艺流程如下: 的沸点为40℃,温度高于108℃分解。②氧化性:
的沸点为40℃,温度高于108℃分解。②氧化性: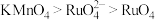
(1)“煅烧”的目的是___________ 。
(2)“氧化”过程需在650℃下熔融反应5小时。
①单质Ru被氧化为 的化学方程式为
的化学方程式为___________ 。
② 固体过量会导致钌的回收率降低,原因是
固体过量会导致钌的回收率降低,原因是___________ 。
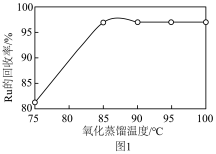
(3)“氧化蒸馏”时,测得钌的回收率随温度变化曲线如图1所示。工业上保证钌回收率较高的情况下,选择在95℃进行氧化蒸馏的原因是___________ 。___________ 。
(5)钌多活性位点催化剂(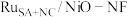 )可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。
)可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。___________ 。
②催化剂的活性位点在催化过程中的主要作用是___________ 。
③分析图2-a推测 的“吸附解离”主要发生在
的“吸附解离”主要发生在___________ (填“钌原子”、“钌团簇”或“NiO”)位点上,若有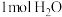 参与该过程,则变化的能量为
参与该过程,则变化的能量为___________ kJ(保留1位小数:已知: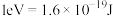 )。
)。
④分析图2-b并说明 的脱附主要发生在NiO表面的原因
的脱附主要发生在NiO表面的原因___________ 。
 、有机物等)中回收钌的工艺流程如下:
、有机物等)中回收钌的工艺流程如下: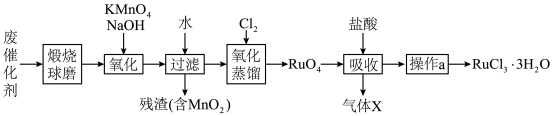
 的沸点为40℃,温度高于108℃分解。②氧化性:
的沸点为40℃,温度高于108℃分解。②氧化性: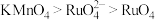
(1)“煅烧”的目的是
(2)“氧化”过程需在650℃下熔融反应5小时。
①单质Ru被氧化为
 的化学方程式为
的化学方程式为②
 固体过量会导致钌的回收率降低,原因是
固体过量会导致钌的回收率降低,原因是(3)“氧化蒸馏”时,测得钌的回收率随温度变化曲线如图1所示。工业上保证钌回收率较高的情况下,选择在95℃进行氧化蒸馏的原因是
(5)钌多活性位点催化剂(
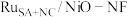 )可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。
)可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。
②催化剂的活性位点在催化过程中的主要作用是
③分析图2-a推测
 的“吸附解离”主要发生在
的“吸附解离”主要发生在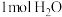 参与该过程,则变化的能量为
参与该过程,则变化的能量为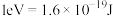 )。
)。④分析图2-b并说明
 的脱附主要发生在NiO表面的原因
的脱附主要发生在NiO表面的原因
您最近一年使用:0次



