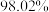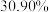名校
1 . 冠醚能与碱金属离子作用,并随环的大小不同而与不同的金属离子作用。12-冠-4与 作用而不与
作用而不与 、
、 作用;18-冠-6与
作用;18-冠-6与 作用(如图),但不与
作用(如图),但不与 或
或 作用。下列说法正确的是
作用。下列说法正确的是
 作用而不与
作用而不与 、
、 作用;18-冠-6与
作用;18-冠-6与 作用(如图),但不与
作用(如图),但不与 或
或 作用。下列说法正确的是
作用。下列说法正确的是
| A.冠醚可作为一些有机反应中的相转移催化剂,与其能与碱金属阳离子作用有关 |
B.18-冠-6与 作用,不与 作用,不与 或 或 作用,这体现了超分子的“自组装”的特征 作用,这体现了超分子的“自组装”的特征 |
C.18-冠-6中O原子与 间存在离子键 间存在离子键 |
| D.18-冠-6分子具有旋光性 |
您最近一年使用:0次
名校
2 .  的配位化合物较稳定且运用广泛。它可与
的配位化合物较稳定且运用广泛。它可与 、
、 、
、 、
、 等形成配离子使溶液显色。如:显浅紫色的
等形成配离子使溶液显色。如:显浅紫色的 、红色的
、红色的 、黄色的
、黄色的 、无色的
、无色的 。某同学按如下步骤完成实验:
。某同学按如下步骤完成实验:

下列说法不正确的是
 的配位化合物较稳定且运用广泛。它可与
的配位化合物较稳定且运用广泛。它可与 、
、 、
、 、
、 等形成配离子使溶液显色。如:显浅紫色的
等形成配离子使溶液显色。如:显浅紫色的 、红色的
、红色的 、黄色的
、黄色的 、无色的
、无色的 。某同学按如下步骤完成实验:
。某同学按如下步骤完成实验:
下列说法不正确的是
A.为了能观察到溶液Ⅰ中 的颜色,可向该溶液中加入稀盐酸 的颜色,可向该溶液中加入稀盐酸 |
B.溶液Ⅰ呈黄色可能是由 水解产物的颜色引起的 水解产物的颜色引起的 |
C. 与 与 的配位能力强于 的配位能力强于 |
| D.向溶液Ⅲ中加入足量的KSCN固体,溶液可能再次变为红色 |
您最近一年使用:0次
名校
解题方法
3 . 随着煤和石油等不可再生能源的日益枯竭,同时在“碳达峰”与“碳中和”可持续发展的目标下,作为清洁能源的天然气受到了广泛的关注。甲烷干重整反应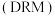 可以将两种温室气体(
可以将两种温室气体( 和
和 )直接转化为合成气(主要成分为
)直接转化为合成气(主要成分为 和
和 ),兼具环境效益和经济效益。
),兼具环境效益和经济效益。
(1)已知: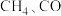 和
和 的燃烧热
的燃烧热 分别为
分别为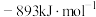 、
、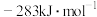 和
和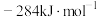 ,则甲烷干重整反应
,则甲烷干重整反应 的
的 为
为___________  。
。
(2)合成气可以用于生成甲醇,在容积为 的恒容密闭容器中加入
的恒容密闭容器中加入 和
和 ,发生反应
,发生反应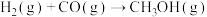 (未配平),各组分的物质的量随时间的变化如图所示。
(未配平),各组分的物质的量随时间的变化如图所示。 内
内
_____________  ;
;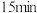 时改变的条件不可能是
时改变的条件不可能是____________ (填标号)。
A.充入 B.充入
B.充入 C.通入惰性气体
C.通入惰性气体
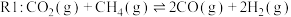 (主反应)
(主反应)
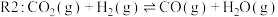
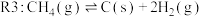
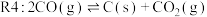
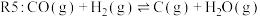
各反应的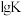 (
( 为各反应的平衡常数)与温度的关系如图所示。由图可知,为提高主反应的转化率应
为各反应的平衡常数)与温度的关系如图所示。由图可知,为提高主反应的转化率应____________ (填“升高温度”或“降低温度”),简述判断的理由________________________ 。
(5)在 、温度为
、温度为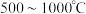 、进料配比
、进料配比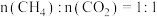 的条件下,甲烷干重整过程中甲烷的转化率、
的条件下,甲烷干重整过程中甲烷的转化率、 的转化率和积碳率随着温度变化的规律如图所示。
的转化率和积碳率随着温度变化的规律如图所示。____________  。
。
②在最佳温度、初始压强 条件下,向某
条件下,向某 的恒容密闭容器中加入
的恒容密闭容器中加入 和
和 ,设只发生
,设只发生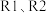 两个反应。达平衡后,测得容器中
两个反应。达平衡后,测得容器中 的浓度为
的浓度为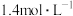 ,
, 的转化率为
的转化率为 ,则此时
,则此时 反应的压强平衡常数
反应的压强平衡常数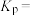
_____________ 。(列出计算式,压强平衡常数用各组分的平衡分压代替物质的量浓度进行计算,平衡分压 物质的量分数
物质的量分数 平衡总压强)。
平衡总压强)。
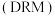 可以将两种温室气体(
可以将两种温室气体( 和
和 )直接转化为合成气(主要成分为
)直接转化为合成气(主要成分为 和
和 ),兼具环境效益和经济效益。
),兼具环境效益和经济效益。(1)已知:
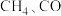 和
和 的燃烧热
的燃烧热 分别为
分别为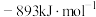 、
、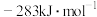 和
和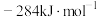 ,则甲烷干重整反应
,则甲烷干重整反应 的
的 为
为 。
。(2)合成气可以用于生成甲醇,在容积为
 的恒容密闭容器中加入
的恒容密闭容器中加入 和
和 ,发生反应
,发生反应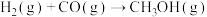 (未配平),各组分的物质的量随时间的变化如图所示。
(未配平),各组分的物质的量随时间的变化如图所示。 内
内
 ;
;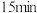 时改变的条件不可能是
时改变的条件不可能是A.充入
 B.充入
B.充入 C.通入惰性气体
C.通入惰性气体
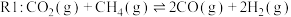 (主反应)
(主反应)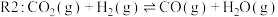
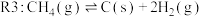
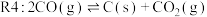
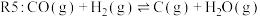
各反应的
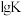 (
( 为各反应的平衡常数)与温度的关系如图所示。由图可知,为提高主反应的转化率应
为各反应的平衡常数)与温度的关系如图所示。由图可知,为提高主反应的转化率应
A. 和 和 的转化率相等 的转化率相等 | B.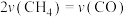 |
C. 的体积分数保持不变 的体积分数保持不变 | D.体系的温度不再变化 |
(5)在
 、温度为
、温度为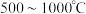 、进料配比
、进料配比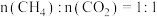 的条件下,甲烷干重整过程中甲烷的转化率、
的条件下,甲烷干重整过程中甲烷的转化率、 的转化率和积碳率随着温度变化的规律如图所示。
的转化率和积碳率随着温度变化的规律如图所示。
 。
。②在最佳温度、初始压强
 条件下,向某
条件下,向某 的恒容密闭容器中加入
的恒容密闭容器中加入 和
和 ,设只发生
,设只发生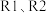 两个反应。达平衡后,测得容器中
两个反应。达平衡后,测得容器中 的浓度为
的浓度为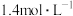 ,
, 的转化率为
的转化率为 ,则此时
,则此时 反应的压强平衡常数
反应的压强平衡常数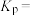
 物质的量分数
物质的量分数 平衡总压强)。
平衡总压强)。
您最近一年使用:0次
名校
4 . 用过二硫酸铵 溶液作浸取剂可以提取黄铜矿(主要成分为
溶液作浸取剂可以提取黄铜矿(主要成分为 )中的铜。
)中的铜。
已知:ⅰ.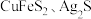 均能导电;
均能导电;
ⅱ.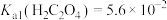 ;
;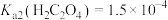 ;
;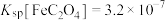
(1) 的晶体中基本结构单元如图1、图2所示。
的晶体中基本结构单元如图1、图2所示。 的配位数为
的配位数为_________ 。
②能够表示 晶胞的是
晶胞的是_____________ 。(填“图1”、“图2”或“图1和图2”)
(2)用 溶液作浸取剂浸取
溶液作浸取剂浸取 的原理示意如图3所示。
的原理示意如图3所示。 与
与 反应的离子方程式为
反应的离子方程式为____________________________ 。
②浸取初期,随着浸取时间延长, 的浸出速率迅速提高,其可能的原因是
的浸出速率迅速提高,其可能的原因是______________ 。
(3)在足量 溶液中添加少量
溶液中添加少量 溶液作为浸取剂与
溶液作为浸取剂与 作用,一段时间结果如下:
作用,一段时间结果如下:
①添加 可以显著提高
可以显著提高 元素的浸出率的原因:
元素的浸出率的原因:_____________________________ 。
②进一步研究发现添加的少量 可以循环参与反应。
可以循环参与反应。 “再生”的离子方程式为:
“再生”的离子方程式为:______________ 。
(4)进一步从浸出液中提取铜并使 再生并得到相对纯净的
再生并得到相对纯净的 的流程如图所示。
的流程如图所示。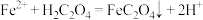 ,该反应化学平衡常数为
,该反应化学平衡常数为______________ 。有同学认为 是二元弱酸,若改用
是二元弱酸,若改用 溶液沉淀效果会更好,你是否同意?
溶液沉淀效果会更好,你是否同意?_____________ (填“是”或“否”)
②生成 的电极反应式是
的电极反应式是_____________________ 。
 溶液作浸取剂可以提取黄铜矿(主要成分为
溶液作浸取剂可以提取黄铜矿(主要成分为 )中的铜。
)中的铜。已知:ⅰ.
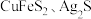 均能导电;
均能导电;ⅱ.
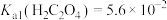 ;
;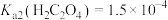 ;
;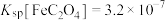
(1)
 的晶体中基本结构单元如图1、图2所示。
的晶体中基本结构单元如图1、图2所示。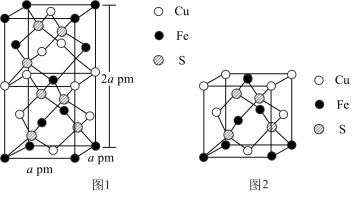
 的配位数为
的配位数为②能够表示
 晶胞的是
晶胞的是(2)用
 溶液作浸取剂浸取
溶液作浸取剂浸取 的原理示意如图3所示。
的原理示意如图3所示。
 与
与 反应的离子方程式为
反应的离子方程式为②浸取初期,随着浸取时间延长,
 的浸出速率迅速提高,其可能的原因是
的浸出速率迅速提高,其可能的原因是(3)在足量
 溶液中添加少量
溶液中添加少量 溶液作为浸取剂与
溶液作为浸取剂与 作用,一段时间结果如下:
作用,一段时间结果如下:添加 | 图3未加 | |
|
|
|
过程中产物形态 |
|
|
 可以显著提高
可以显著提高 元素的浸出率的原因:
元素的浸出率的原因:②进一步研究发现添加的少量
 可以循环参与反应。
可以循环参与反应。 “再生”的离子方程式为:
“再生”的离子方程式为:(4)进一步从浸出液中提取铜并使
 再生并得到相对纯净的
再生并得到相对纯净的 的流程如图所示。
的流程如图所示。
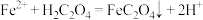 ,该反应化学平衡常数为
,该反应化学平衡常数为 是二元弱酸,若改用
是二元弱酸,若改用 溶液沉淀效果会更好,你是否同意?
溶液沉淀效果会更好,你是否同意?②生成
 的电极反应式是
的电极反应式是
您最近一年使用:0次
名校
解题方法
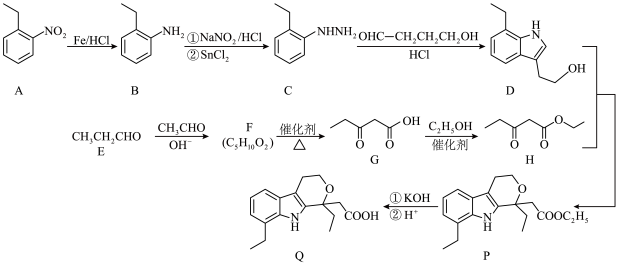
5 . 杂环化合物在药物中广泛存在,依托度酸(etodolac)用于治疗风湿性关节炎、类风湿性关节炎等,具有耐受性好、镇痛作用强等特点,尤其适用于老年患者。以下为其合成路线:
(1)由苯制备物质 ,最好应先引入
,最好应先引入___________ (填“乙基”或“硝基”);物质 中的含氧官能团的名称为
中的含氧官能团的名称为___________ 。
(2) 的系统命名为
的系统命名为___________ ,该物质存在多种同分异构体,其中一定条件下能与 溶液反应的同分异构体有
溶液反应的同分异构体有___________ 种。
(3) 的化学反应方程式为
的化学反应方程式为___________ 。
(4) 主要经历先
主要经历先___________ 后___________ 两种反应类型, 的另一种产物的结构简式为
的另一种产物的结构简式为___________ 。
(5)在医院里肠杆菌等细菌的鉴定常利用吲哚实验,转换反应式如下: 原子的孤电子对位于
原子的孤电子对位于___________ 轨道;柯氏试剂 化学式为
化学式为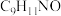 ,该步反应的另一种产物为
,该步反应的另一种产物为 ,则
,则 结构简式为
结构简式为___________ 。

(1)由苯制备物质
 ,最好应先引入
,最好应先引入 中的含氧官能团的名称为
中的含氧官能团的名称为(2)
 的系统命名为
的系统命名为 溶液反应的同分异构体有
溶液反应的同分异构体有(3)
 的化学反应方程式为
的化学反应方程式为(4)
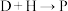 主要经历先
主要经历先 的另一种产物的结构简式为
的另一种产物的结构简式为(5)在医院里肠杆菌等细菌的鉴定常利用吲哚实验,转换反应式如下:
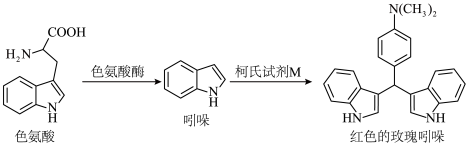
 原子的孤电子对位于
原子的孤电子对位于 化学式为
化学式为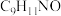 ,该步反应的另一种产物为
,该步反应的另一种产物为 ,则
,则 结构简式为
结构简式为
您最近一年使用:0次
名校
解题方法
6 . 苯酚作为质子穿梭剂可用于高效连续性催化合成氨,电解装置中使用LiBF4的四氢呋喃有机电解液。下列说法错误的是
已知法拉第效率(FE)的定义: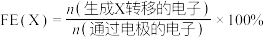
已知法拉第效率(FE)的定义:
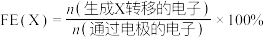

| A.a接电源的正极 |
| B.电解过程中,Pt电极区生成了Li和LiNxHy |
C.N2与 生成NH3的总电极反应式为:N2+6 生成NH3的总电极反应式为:N2+6 +6e-=6 +6e-=6 +2NH3 +2NH3 |
| D.若生成NH3的法拉第效率为75%,则生成1mol氨气,消耗H2为1.5mol |
您最近一年使用:0次
2024-06-04更新
|
132次组卷
|
2卷引用:2024届福建省厦门第一中学高三下学期高考模拟(最后一卷)化学试题
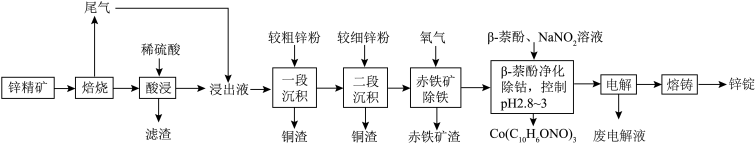
7 . 湿法炼锌具有能耗低,生成产品纯度高等特点,其主要原料为锌精矿(主要成分为硫化锌,还含有铁、钴、铜、镉、铅等元素的杂质),获得较纯锌锭的工艺流程如图: 、
、 、CdO。
、CdO。
(1)铜原子的价层电子排布图为________ 。
(2)“酸浸”中滤渣主要成分为________ 。
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:________ 。
(4)写出“赤铁矿除铁”过程中反应的离子方程式:_________ 。
(5)“ 萘酚净化除钴”先是
萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:________ 。
(6)“电解”工艺中,电解液常有较高浓度的 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 ,发生的反应为
,发生的反应为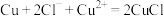 ,该反应的平衡常数
,该反应的平衡常数
________ 。[已知: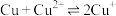
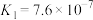 ;
; ]
]
(7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
________ ,
________ ;充电过程中ZnS到 的电极反应式为
的电极反应式为________ (x和y用具体数字表示)。
②若 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为________ nm。
 、
、 、CdO。
、CdO。(1)铜原子的价层电子排布图为
(2)“酸浸”中滤渣主要成分为
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:
(4)写出“赤铁矿除铁”过程中反应的离子方程式:
(5)“
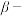 萘酚净化除钴”先是
萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:(6)“电解”工艺中,电解液常有较高浓度的
 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 ,发生的反应为
,发生的反应为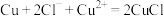 ,该反应的平衡常数
,该反应的平衡常数
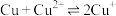
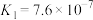 ;
; ]
](7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
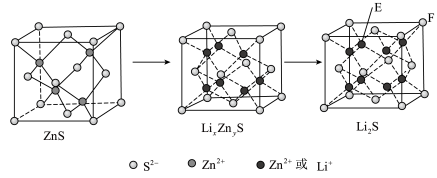


 的电极反应式为
的电极反应式为②若
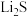 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为
您最近一年使用:0次
8 . 溴及其化合物是重要的化工基础原料,广泛应用于制药、染料、电子、日化等行业。
Ⅰ.用图所示装置A可制取氯气。将纯净的氯气通入装置C的NaBr溶液中可以在实验室制取少量溴单质。_______ 。
(2)为了富集生成的溴单质,用热空气吹出,并在装置D中收集,则装置D中可选用的试剂为_______。
Ⅱ.工业上从海水中提取 过程更为复杂。研究集中在空气吹出法,空气吹出法提溴对原料的适应性高,但吹出设备庞大,且能耗高。某工厂针对空气吹出法的缺点进行工艺改造,提出连续双段真空提溴工艺,如图转化过程:
过程更为复杂。研究集中在空气吹出法,空气吹出法提溴对原料的适应性高,但吹出设备庞大,且能耗高。某工厂针对空气吹出法的缺点进行工艺改造,提出连续双段真空提溴工艺,如图转化过程:_______ 。主反应塔1中温度保持在82~99℃,减少了水蒸气的用量。从化学性质的角度分析这么做的主要目的有两点:①减少氯气与水的反应,②减少_______ 反应。从经济角度来看这么做还可以减少的_______ 用量。
(4)为了让原料卤水与氯气在主反应塔1中更充分反应,请将正确装置对应的选项填在图中“□”处:_______ 。_______ 。冷凝器需要铺设循环冷却水管道,循环冷却水管道中水流方向是_______ (填“从地面到顶端”或“从顶端到地面”),请说明原因_______ 。
(6)在分离器中经冷凝、分离、纯化后制得精溴。少量氯、溴与混合废气需要经过水蒸气喷射泵喷入气体吸收器。此时,还需进行酸化调节,再经过排水管通入主反应塔1中循环利用。请写出吸收器中酸化调节主要发生的离子反应方程式:_______ 。
Ⅰ.用图所示装置A可制取氯气。将纯净的氯气通入装置C的NaBr溶液中可以在实验室制取少量溴单质。
(2)为了富集生成的溴单质,用热空气吹出,并在装置D中收集,则装置D中可选用的试剂为_______。
A. | B.NaOH | C.KI | D. |
Ⅱ.工业上从海水中提取
 过程更为复杂。研究集中在空气吹出法,空气吹出法提溴对原料的适应性高,但吹出设备庞大,且能耗高。某工厂针对空气吹出法的缺点进行工艺改造,提出连续双段真空提溴工艺,如图转化过程:
过程更为复杂。研究集中在空气吹出法,空气吹出法提溴对原料的适应性高,但吹出设备庞大,且能耗高。某工厂针对空气吹出法的缺点进行工艺改造,提出连续双段真空提溴工艺,如图转化过程:
(4)为了让原料卤水与氯气在主反应塔1中更充分反应,请将正确装置对应的选项填在图中“□”处:
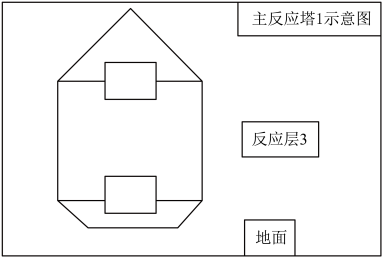

(6)在分离器中经冷凝、分离、纯化后制得精溴。少量氯、溴与混合废气需要经过水蒸气喷射泵喷入气体吸收器。此时,还需进行酸化调节,再经过排水管通入主反应塔1中循环利用。请写出吸收器中酸化调节主要发生的离子反应方程式:
您最近一年使用:0次
9 . 利用某阳极泥(含 和
和 单质)回收贵金属
单质)回收贵金属 并合成高能量密度材料
并合成高能量密度材料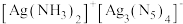 的工艺流程如下。
的工艺流程如下。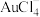 的离子方程式为
的离子方程式为___________ 。
(2)“还原”过程发生反应的化学方程式为___________ 。
(3)溶液中含银微粒的物质的量分数随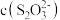 的变化如图。
的变化如图。 ,应调节
,应调节 最佳浓度为
最佳浓度为___________  。
。
②25℃时, 的
的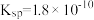 ,
, 的
的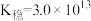 ,
,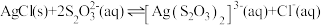 的平衡常数
的平衡常数
___________ 。
(4)“电解”过程生成 的电极反应式为
的电极反应式为___________ 。
(5)“溶解”过程可提高溶解速率的措施有___________ (填1条)。
(6)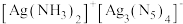 晶体的局部结构如图。
晶体的局部结构如图。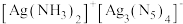 晶体中存在的微粒间作用力有
晶体中存在的微粒间作用力有___________ (填标号)。
A.离子键 B. 键 C.
键 C. 键 D.金属键 E.氢键
键 D.金属键 E.氢键
②晶体中 的杂化轨道类型
的杂化轨道类型___________ (填“相同”或“不同”),依据是___________ 。
 和
和 单质)回收贵金属
单质)回收贵金属 并合成高能量密度材料
并合成高能量密度材料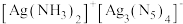 的工艺流程如下。
的工艺流程如下。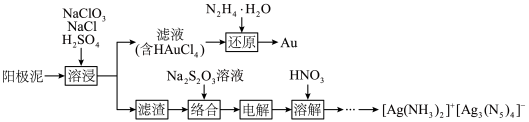
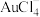 的离子方程式为
的离子方程式为(2)“还原”过程发生反应的化学方程式为
(3)溶液中含银微粒的物质的量分数随
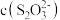 的变化如图。
的变化如图。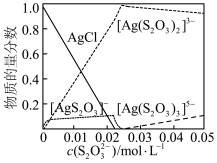
 ,应调节
,应调节 最佳浓度为
最佳浓度为 。
。②25℃时,
 的
的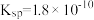 ,
, 的
的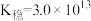 ,
,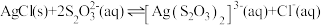 的平衡常数
的平衡常数
(4)“电解”过程生成
 的电极反应式为
的电极反应式为(5)“溶解”过程可提高溶解速率的措施有
(6)
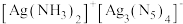 晶体的局部结构如图。
晶体的局部结构如图。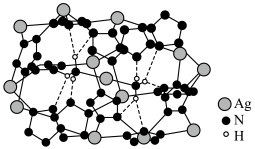
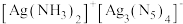 晶体中存在的微粒间作用力有
晶体中存在的微粒间作用力有A.离子键 B.
 键 C.
键 C. 键 D.金属键 E.氢键
键 D.金属键 E.氢键②晶体中
 的杂化轨道类型
的杂化轨道类型
您最近一年使用:0次
名校
10 . 某化学兴趣小组同学进行如下实验:①分别向 溶液和
溶液和 溶液中滴加KSCN溶液,均无明显现象。②向
溶液中滴加KSCN溶液,均无明显现象。②向 和
和 的混合液中滴加少量KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。③过滤②中白色沉淀并洗涤干净,向其中加入过量氨水,白色沉淀溶解得无色溶液,放置过程中,无色溶液变蓝色。已知:CuSCN为白色、难溶性物质;
的混合液中滴加少量KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。③过滤②中白色沉淀并洗涤干净,向其中加入过量氨水,白色沉淀溶解得无色溶液,放置过程中,无色溶液变蓝色。已知:CuSCN为白色、难溶性物质; 为无色离子;
为无色离子; 为深蓝色离子。下列说法不正确的是
为深蓝色离子。下列说法不正确的是
 溶液和
溶液和 溶液中滴加KSCN溶液,均无明显现象。②向
溶液中滴加KSCN溶液,均无明显现象。②向 和
和 的混合液中滴加少量KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。③过滤②中白色沉淀并洗涤干净,向其中加入过量氨水,白色沉淀溶解得无色溶液,放置过程中,无色溶液变蓝色。已知:CuSCN为白色、难溶性物质;
的混合液中滴加少量KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。③过滤②中白色沉淀并洗涤干净,向其中加入过量氨水,白色沉淀溶解得无色溶液,放置过程中,无色溶液变蓝色。已知:CuSCN为白色、难溶性物质; 为无色离子;
为无色离子; 为深蓝色离子。下列说法不正确的是
为深蓝色离子。下列说法不正确的是A.实验①说明 不能与SCN反应生成CuSCN 不能与SCN反应生成CuSCN |
B.实验②中红色褪去的原因是振荡后 降低 降低 |
C.实验③中无色溶液变蓝色的原因是: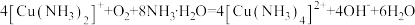 |
D.依据实验①、②、③推测,②中由于生成CuSCN,使 氧化性增强,将 氧化性增强,将 氧化为 氧化为 |
您最近一年使用:0次