1 . 按要求填空
(1)正常雨水的 ,酸雨的
,酸雨的
_______ 。
(2)空气中 来源与煤的燃烧,金属的冶炼,可利用氧化钙进行钙基固硫法处理二氧化硫,产物为石膏的主要成分,请写出其总反应方程式
来源与煤的燃烧,金属的冶炼,可利用氧化钙进行钙基固硫法处理二氧化硫,产物为石膏的主要成分,请写出其总反应方程式_______ 。
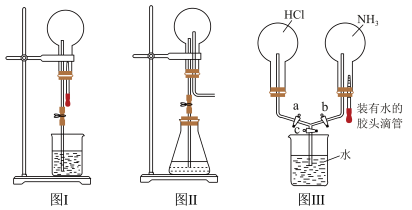
(3)选出雷电发庄稼的路径_______ 。_______ (填“增大”或“减小”,下同)上部烧瓶内气体压强;标况条件下图I先充满氨气,然后进行喷泉实验之后,其氨水的浓度为:_______ ,图Ⅱ是_______ 下部锥形瓶内气体压强。某学生积极思考喷泉原理的应用,设计了如图Ⅲ所示的装置。如果关闭活塞c,打开活塞a、b,再挤压胶头滴管。则可能出现的现象为_______ 。_______ (填化学式)进行尾气处理,在NO与 一起通入其溶液处理尾气时应该要保证
一起通入其溶液处理尾气时应该要保证_______ (选 或
或 )过量。
)过量。
(6)使用过氧化氢绿色氧化剂氧化绿化亚铁得到氯化铁,为何过氧化氢的试剂用量远远大于理论用量_______ 。
(1)正常雨水的
 ,酸雨的
,酸雨的
(2)空气中
 来源与煤的燃烧,金属的冶炼,可利用氧化钙进行钙基固硫法处理二氧化硫,产物为石膏的主要成分,请写出其总反应方程式
来源与煤的燃烧,金属的冶炼,可利用氧化钙进行钙基固硫法处理二氧化硫,产物为石膏的主要成分,请写出其总反应方程式(3)选出雷电发庄稼的路径

 一起通入其溶液处理尾气时应该要保证
一起通入其溶液处理尾气时应该要保证 或
或 )过量。
)过量。(6)使用过氧化氢绿色氧化剂氧化绿化亚铁得到氯化铁,为何过氧化氢的试剂用量远远大于理论用量
您最近一年使用:0次
名校
解题方法
2 . 按要求完成下面小题。
(1)有以下转化关系:
反应①:___________
 在上述有序号的反应中,除了①⑥外,需用氧化剂的是
在上述有序号的反应中,除了①⑥外,需用氧化剂的是___________ (填序号)。
(2) 。该反应中,生成物M是
。该反应中,生成物M是___________ (填化学式)。
(3)针对以下A~D四个涉及H2O2的反应(未配平)填空:
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2↑+H2O
C.H2O2→H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
H2O2仅作氧化剂的反应是___________ (填序号,下同)。
(4)取少量NaH放入水中,剧烈反应放出一种无色、无味的气体,并形成一种碱性溶液。NaH与水反应的化学方程式为___________ 。
(5) 与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:
与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:___________ 。
(6)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药是将硫磺、木炭、硝酸钾按照一定比例混合,在发生爆炸时,没有产生污染性物质。请书写出该反应方程式并配平___________ 。
(1)有以下转化关系:

反应①:
 在上述有序号的反应中,除了①⑥外,需用氧化剂的是
在上述有序号的反应中,除了①⑥外,需用氧化剂的是(2)
 。该反应中,生成物M是
。该反应中,生成物M是(3)针对以下A~D四个涉及H2O2的反应(未配平)填空:
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2↑+H2O
C.H2O2→H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
H2O2仅作氧化剂的反应是
(4)取少量NaH放入水中,剧烈反应放出一种无色、无味的气体,并形成一种碱性溶液。NaH与水反应的化学方程式为
(5)
 与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:
与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:(6)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药是将硫磺、木炭、硝酸钾按照一定比例混合,在发生爆炸时,没有产生污染性物质。请书写出该反应方程式并配平
您最近一年使用:0次
2024-03-25更新
|
94次组卷
|
2卷引用:云南省丽江润泽高级中学2023-2024学年高一上学期11月月考化学试题
解题方法
3 . 实验室里常用的干燥剂有:①生石灰 ②固体氢氧化钠 ③变色硅胶(主要成分是二氧化硅,在其中掺入少量的无水氯化钻( )作指示剂) ④五氧化二磷 ⑤无水氯化钙 ⑥浓硫酸 ⑦碱石灰(主要成分是氢氧化钠、氧化钙)等。
)作指示剂) ④五氧化二磷 ⑤无水氯化钙 ⑥浓硫酸 ⑦碱石灰(主要成分是氢氧化钠、氧化钙)等。
(1)上述物质中,属于纯净物的是_______(填序号)。
(2)上述②、④、⑤、⑥四种干燥剂中,其主要化学成分所属的类别依次为_______ (填序号)。
A. 混合物 B. 碱 C. 盐 D. 氧化物
(3)硅胶中无水氯化钻( )呈蓝色,吸水后变为粉红色的
)呈蓝色,吸水后变为粉红色的 ,该变化过程属于
,该变化过程属于_______ (填“物理变化”或“化学变化”)。
(4)下列气体中,能用固体氢氧化钠干燥的是_______ 。
A. B.HCl C.
B.HCl C.
(5)生石灰常用作食品干燥剂,久置后易失去干燥能力,其原因为_______ (用化学方程式表示)。
 )作指示剂) ④五氧化二磷 ⑤无水氯化钙 ⑥浓硫酸 ⑦碱石灰(主要成分是氢氧化钠、氧化钙)等。
)作指示剂) ④五氧化二磷 ⑤无水氯化钙 ⑥浓硫酸 ⑦碱石灰(主要成分是氢氧化钠、氧化钙)等。(1)上述物质中,属于纯净物的是_______(填序号)。
| A.①②④ | B.②④⑥ | C.①②④⑤ | D.全部 |
A. 混合物 B. 碱 C. 盐 D. 氧化物
(3)硅胶中无水氯化钻(
 )呈蓝色,吸水后变为粉红色的
)呈蓝色,吸水后变为粉红色的 ,该变化过程属于
,该变化过程属于(4)下列气体中,能用固体氢氧化钠干燥的是
A.
 B.HCl C.
B.HCl C.
(5)生石灰常用作食品干燥剂,久置后易失去干燥能力,其原因为
您最近一年使用:0次
解题方法
4 . 现有课外活动小组进行 胶体的制备并检验其性质,甲同学在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和
胶体的制备并检验其性质,甲同学在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和 溶液,继续煮沸并用玻璃棒搅拌至溶液呈红褐色,停止加热,即制得
溶液,继续煮沸并用玻璃棒搅拌至溶液呈红褐色,停止加热,即制得 胶体。
胶体。
(1)①请评价该操作是否正确_____________ (填“正确”或“不正确”),写出制备 胶体的反应方程式
胶体的反应方程式______________________________________________________________________ 。
(2)②乙同学将用氯化铁溶液制得的氢氧化铁胶体放入半透膜制成的袋内,如图所示,放置2min后取少量半透膜外的液体于烧杯中,置于暗处用一束强光从侧面照射,观察__________ (填“有”或“无”)丁达尔现象。

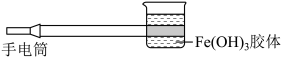
(3)如下图是在实验室中进行 胶体丁达尔效应实验的示意图,该图中有一处明显错误是
胶体丁达尔效应实验的示意图,该图中有一处明显错误是__________ ,原因是_________________________________________ 。(试从分散系分类的角度进行解释说明)。
(4)丙同学将制好的 胶体装入U型玻璃管中,插入电极,连通直流电,进行电泳实验。一段时间后,观察到阴极附近液体红褐色加深,原因是
胶体装入U型玻璃管中,插入电极,连通直流电,进行电泳实验。一段时间后,观察到阴极附近液体红褐色加深,原因是______________ 。
(5)把盐酸逐滴滴加到 胶体中,先观察到的现象是产生红褐色沉淀理由是
胶体中,先观察到的现象是产生红褐色沉淀理由是______ ,随后看到红褐色沉淀溶解溶液变黄,请用离子反应方程式表示此现象_______________________ 。
 胶体的制备并检验其性质,甲同学在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和
胶体的制备并检验其性质,甲同学在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和 溶液,继续煮沸并用玻璃棒搅拌至溶液呈红褐色,停止加热,即制得
溶液,继续煮沸并用玻璃棒搅拌至溶液呈红褐色,停止加热,即制得 胶体。
胶体。(1)①请评价该操作是否正确
 胶体的反应方程式
胶体的反应方程式(2)②乙同学将用氯化铁溶液制得的氢氧化铁胶体放入半透膜制成的袋内,如图所示,放置2min后取少量半透膜外的液体于烧杯中,置于暗处用一束强光从侧面照射,观察

(3)如下图是在实验室中进行
 胶体丁达尔效应实验的示意图,该图中有一处明显错误是
胶体丁达尔效应实验的示意图,该图中有一处明显错误是
(4)丙同学将制好的
 胶体装入U型玻璃管中,插入电极,连通直流电,进行电泳实验。一段时间后,观察到阴极附近液体红褐色加深,原因是
胶体装入U型玻璃管中,插入电极,连通直流电,进行电泳实验。一段时间后,观察到阴极附近液体红褐色加深,原因是(5)把盐酸逐滴滴加到
 胶体中,先观察到的现象是产生红褐色沉淀理由是
胶体中,先观察到的现象是产生红褐色沉淀理由是
您最近一年使用:0次
解题方法
5 . 阅读下列科普短文并填空:
海洋的水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如 、
、 等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和
等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和 用以生产
用以生产 、
、 、
、 、
、 、
、 等。苦卤经过氯气氧化、热空气吹出、
等。苦卤经过氯气氧化、热空气吹出、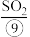 吸收等一操作可获得
吸收等一操作可获得 。电解熔融氯化钠可冶炼
。电解熔融氯化钠可冶炼 。海底埋藏大量可燃冰资源,
。海底埋藏大量可燃冰资源, 是一种清洁能源。
是一种清洁能源。
(1)上述标有序号的物质中属于非电解质的是__________ (填序号)
(2)写出⑤溶于水的电离方程式:___________________ 。将⑧与④混合,写出离子反应方程式_________________ 。将⑤与④的溶液混合,写出离子反应方程式_______________________________ 。
(3)元素G的一种含氧酸化学式为 ,属于二元酸,则
,属于二元酸,则 与过量氢氧化钠溶液反应,生成的正盐的化学式
与过量氢氧化钠溶液反应,生成的正盐的化学式_________________ 。
海洋的水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如
 、
、 等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和
等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和 用以生产
用以生产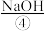 、
、 、
、 、
、 、
、 等。苦卤经过氯气氧化、热空气吹出、
等。苦卤经过氯气氧化、热空气吹出、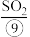 吸收等一操作可获得
吸收等一操作可获得 。电解熔融氯化钠可冶炼
。电解熔融氯化钠可冶炼 。海底埋藏大量可燃冰资源,
。海底埋藏大量可燃冰资源, 是一种清洁能源。
是一种清洁能源。(1)上述标有序号的物质中属于非电解质的是
(2)写出⑤溶于水的电离方程式:
(3)元素G的一种含氧酸化学式为
 ,属于二元酸,则
,属于二元酸,则 与过量氢氧化钠溶液反应,生成的正盐的化学式
与过量氢氧化钠溶液反应,生成的正盐的化学式
您最近一年使用:0次
名校
解题方法
6 . 实验室现需要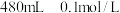 葡萄糖
葡萄糖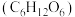 溶液。请根据所学知识回答下列问题:
溶液。请根据所学知识回答下列问题:
(1)葡萄糖的摩尔质量为___________ 。
(2)配制该溶液所需仪器有天平、量筒、烧杯、玻璃棒、胶头滴管、___________ 。
(3)需称量葡萄糖固体的质量为___________ g。
a.向容量瓶中直接加蒸馏水至离刻度线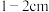 处
处
b.将溶液冷却至室温后转移到容量瓶中
c.将配制好的溶液转入准备好的试剂瓶中贮存备用
d.将称量好的葡萄糖用适量水在小烧杯内溶解
e.称量配制溶液所需的葡萄糖
f.盖上容量瓶塞子,上下颠倒容量瓶使溶液混合均匀
g.用胶头滴管小心加蒸馏水至刻度线
h.用少量蒸馏水洗涤小烧杯和玻璃棒 次,并将洗涤液转移到容量瓶中
次,并将洗涤液转移到容量瓶中
①容量瓶使用前应___________ 。
②正确的操作顺序是___________ (填标号)。
③此实验中两次用到玻璃棒,先后作用分别是___________ 、___________ 。
④判断下列操作对所配制溶液的浓度有何影响(填“偏高”、“偏低”或“无影响”):
i.转移溶液后的小烧杯,玻璃棒未洗涤___________ 。
ii.转移溶液前,容量瓶中有少量的蒸馏水___________ 。
iii.定容时俯视刻度线___________ 。
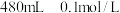 葡萄糖
葡萄糖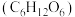 溶液。请根据所学知识回答下列问题:
溶液。请根据所学知识回答下列问题:(1)葡萄糖的摩尔质量为
(2)配制该溶液所需仪器有天平、量筒、烧杯、玻璃棒、胶头滴管、
(3)需称量葡萄糖固体的质量为
a.向容量瓶中直接加蒸馏水至离刻度线
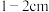 处
处b.将溶液冷却至室温后转移到容量瓶中
c.将配制好的溶液转入准备好的试剂瓶中贮存备用
d.将称量好的葡萄糖用适量水在小烧杯内溶解
e.称量配制溶液所需的葡萄糖
f.盖上容量瓶塞子,上下颠倒容量瓶使溶液混合均匀
g.用胶头滴管小心加蒸馏水至刻度线
h.用少量蒸馏水洗涤小烧杯和玻璃棒
 次,并将洗涤液转移到容量瓶中
次,并将洗涤液转移到容量瓶中①容量瓶使用前应
②正确的操作顺序是
③此实验中两次用到玻璃棒,先后作用分别是
④判断下列操作对所配制溶液的浓度有何影响(填“偏高”、“偏低”或“无影响”):
i.转移溶液后的小烧杯,玻璃棒未洗涤
ii.转移溶液前,容量瓶中有少量的蒸馏水
iii.定容时俯视刻度线
您最近一年使用:0次
2023-12-07更新
|
188次组卷
|
3卷引用:云南省丽江润泽高级中学2023-2024学年高一下学期开学考试化学试题
名校
7 . I.完成下列问题。
(1)明胶溶于水形成胶体,与溶液相比,胶体最本质的特征是________ 。
A.丁达尔效应 B.分散质直径在1-100nm之间 C.加入电解质会发生沉降
(2)下列方法不能用于鉴别碳酸钠固体和碳酸氢钠固体的是___________。
II.某研究性学习小组查阅资料发现,Na2O2与干燥的HCl气体能发生反应生成Cl2.;Na2O2+4HCl= 2NaCl+Cl2+2H2O。
(3)用双线桥标出该反应电子转移的方向和数目:Na2O2 + 4HCl = 2NaCl + Cl2 + 2H2O________ 。
(4)该反应中氧化剂是___________ (化学式,下同),氧化产物是___________ ,两者氧化性强弱相比,___________ 氧化性更强。
(1)明胶溶于水形成胶体,与溶液相比,胶体最本质的特征是
A.丁达尔效应 B.分散质直径在1-100nm之间 C.加入电解质会发生沉降
(2)下列方法不能用于鉴别碳酸钠固体和碳酸氢钠固体的是___________。
| A.滴加盐酸 | B.溶于水,滴加氯化钙 |
| C.滴加水,测温度变化 | D.溶于水,滴加澄清石灰水 |
II.某研究性学习小组查阅资料发现,Na2O2与干燥的HCl气体能发生反应生成Cl2.;Na2O2+4HCl= 2NaCl+Cl2+2H2O。
(3)用双线桥标出该反应电子转移的方向和数目:Na2O2 + 4HCl = 2NaCl + Cl2 + 2H2O
(4)该反应中氧化剂是
您最近一年使用:0次
2023-11-11更新
|
32次组卷
|
2卷引用:云南省丽江润泽高级中学2023-2024学年高一下学期开学考试化学试题
解题方法
8 . 回答下列问题:
(1)锌-空气电池是金属空气电池的一种,电解质溶液为KOH溶液,工作示意图如图1所示。
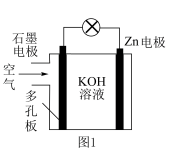
Zn电极作______ 极,写出通入空气一极的电极反应式:______ 。
(2)氯碱工业中电解饱和食盐水的原理示意图如图2所示:
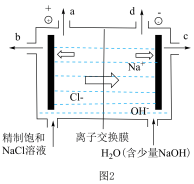
①a口产生的气体是______ ,c口获得的产品是______ ,当d口产生标况下2.24L气体时,电路中转移电子的物质的量为______ 。
②写出电解饱和食盐水的离子方程式______ 。
(3)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。鉴于腐蚀问题的严重性,国内外对防腐工作都很重视,采取各种措施来减轻腐蚀的危害,图3是金属防护的两个例子。
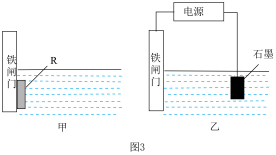
①为了降低某水库的铁闸门被腐蚀的速率,可以采用图3甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用______ (填字母)。
A.铜 B.石墨 C.锌
②图3乙方案也可以降低铁闸门腐蚀的速率,其中铁闸门应该连接在直流电源的______ (填“正”或“负”)极,该金属防护的方法叫做______ 。
(1)锌-空气电池是金属空气电池的一种,电解质溶液为KOH溶液,工作示意图如图1所示。

Zn电极作
(2)氯碱工业中电解饱和食盐水的原理示意图如图2所示:

①a口产生的气体是
②写出电解饱和食盐水的离子方程式
(3)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。鉴于腐蚀问题的严重性,国内外对防腐工作都很重视,采取各种措施来减轻腐蚀的危害,图3是金属防护的两个例子。

①为了降低某水库的铁闸门被腐蚀的速率,可以采用图3甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用
A.铜 B.石墨 C.锌
②图3乙方案也可以降低铁闸门腐蚀的速率,其中铁闸门应该连接在直流电源的
您最近一年使用:0次
解题方法
9 . 回答下列问题:
(1)常温下,盐酸和氨水混合,所得溶液pH=7,则此时溶液中c(NH )
)_____ c(Cl-)(填“>”、“<”或“=”)。将0.01mol•L-1的盐酸稀释100倍后的pH=_____ ;向水中加入少量NH4Cl固体,水的电离平衡_____ 移动(填“正向”或“逆向”);用离子方程式解释NH4Cl溶液呈酸性的原因:_____ 。
(2)滴定法是化学分析的常用方法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。酸碱滴定和氧化还原滴定是常见的两种滴定方法:
I.氧化还原滴定:双氧水常用于医用伤口消毒、环境消毒和食品消毒。化学兴趣小组欲准确测定某市售双氧水中H2O2的含量:取双氧水25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准液滴定,其反应的离子方程式为2MnO +5H2O2+6H+=2Mn2++5O2↑+8H2O。
+5H2O2+6H+=2Mn2++5O2↑+8H2O。
①滴定时,将高锰酸钾标准溶液注入______ (填“A”或“B”)滴定管中。
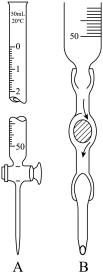
②滴定到达终点的现象是_____ 。
Ⅱ.酸碱中和滴定:常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到如图滴定曲线:
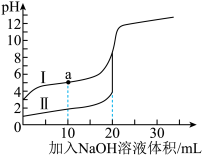
①表示滴定盐酸的曲线是______ (填“I”或“Ⅱ”)。
②当用NaOH标准溶液滴定醋酸溶液,到达滴定终点时,溶液中离子浓度的大小顺序为______ 。
(1)常温下,盐酸和氨水混合,所得溶液pH=7,则此时溶液中c(NH
 )
)(2)滴定法是化学分析的常用方法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。酸碱滴定和氧化还原滴定是常见的两种滴定方法:
I.氧化还原滴定:双氧水常用于医用伤口消毒、环境消毒和食品消毒。化学兴趣小组欲准确测定某市售双氧水中H2O2的含量:取双氧水25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准液滴定,其反应的离子方程式为2MnO
 +5H2O2+6H+=2Mn2++5O2↑+8H2O。
+5H2O2+6H+=2Mn2++5O2↑+8H2O。①滴定时,将高锰酸钾标准溶液注入

②滴定到达终点的现象是
Ⅱ.酸碱中和滴定:常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到如图滴定曲线:

①表示滴定盐酸的曲线是
②当用NaOH标准溶液滴定醋酸溶液,到达滴定终点时,溶液中离子浓度的大小顺序为
您最近一年使用:0次
10 . B、N、F、Ti、Fe、As、Se等元素及其化合物的研究对工农业生产意义重大,回答下列问题:
(1)写出Ti基态原子的电子排布式_____ 。
(2)基态Fe2+与Fe3+离子中未成对的电子数之比为_____ 。
(3)VIA族元素中O、S、Se的电负性由大到小的顺序为_____ 。
(4)BF3的空间构型为_____ ;其中B原子采用_____ 杂化,根据对角线规则,B的一些化学性质与元素_____ 的相似。
(5)元素As与N同族。As的氢化物的沸点比NH3的_____ (填“高”或“低”),其判断理由是_____ 。
(1)写出Ti基态原子的电子排布式
(2)基态Fe2+与Fe3+离子中未成对的电子数之比为
(3)VIA族元素中O、S、Se的电负性由大到小的顺序为
(4)BF3的空间构型为
(5)元素As与N同族。As的氢化物的沸点比NH3的
您最近一年使用:0次
2023-05-04更新
|
285次组卷
|
2卷引用:云南省丽江市2022-2023学年高二上学期期末考试化学试题



