名校
解题方法
1 . 高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。回答下列问题:
(1)SiO2属于___________ (填“酸性”“碱性”或“两性”)氧化物。盛装NaOH溶液的试剂瓶不能用玻璃塞,其原因为___________ (用离子方程式表示)。
(2)用氮化硅(Si3N4)陶瓷制造发动机,能大幅度提高发动机的热效率。工业上制备氮化硅的原理为:3SiCl4+2N2+6H2 Si3N4+12HCl。
Si3N4+12HCl。
①SiCl4是___________ (填“离子化合物”或“共价化合物”)。
②若该反应转移3mol电子,生成Si3N4的质量为___________ g。
(3)芯片制作中的部分流程如图:___________ 。
Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是___________ 。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.铁坩埚
②去除磷硅玻璃即除去扩散制结过程中产生的SiO2,下列试剂合适的为___________ (填标号),写出其化学方程式:___________ 。
a.浓硫酸 b.氢氟酸 c.稀硝酸
(1)SiO2属于
(2)用氮化硅(Si3N4)陶瓷制造发动机,能大幅度提高发动机的热效率。工业上制备氮化硅的原理为:3SiCl4+2N2+6H2
 Si3N4+12HCl。
Si3N4+12HCl。①SiCl4是
②若该反应转移3mol电子,生成Si3N4的质量为
(3)芯片制作中的部分流程如图:

Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是
A.普通玻璃坩埚 B.石英玻璃坩埚 C.铁坩埚
②去除磷硅玻璃即除去扩散制结过程中产生的SiO2,下列试剂合适的为
a.浓硫酸 b.氢氟酸 c.稀硝酸
您最近一年使用:0次
名校
解题方法
2 . 如图所示,是原电池的装置图。请回答:___________ ;在反应中溶液中的阴离子移向___________ (填“A”或“B”),反应进行一段时间后溶液C中H+浓度___________ 。(填“增大”“减小”或“基本不变”)
(2)若需将反应Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为___________ ,B极电极反应式为___________ 。
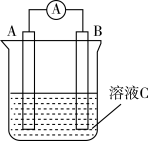
(2)若需将反应Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为
您最近一年使用:0次
名校
解题方法
3 . 化学电源是人类生产和生活的重要能量来源之一,回答下列问题。
(1)为了探究化学反应中的能量变化,某同学设计了如下两个实验。___________ (填序号)。
A.图1和图2的气泡均产生在锌棒表面
B.图1中温度计的示数高于图2的示数
C.图2中产生气体的速度比1快
D.图1和图2中温度计的示数相等,且均高于室温
②图②装置中,正极的电极反应方程式为___________ 。
(2)将反应2Fe3++Fe=3Fe2+设计成原电池装置,负极的电极反应方程式为___________ ,离子导体为___________ 。
(3)甲烷碱性燃料电池以KOH溶液为电解质溶液,电池反应为CH4+2O2+2OH- CO
CO +3H2O,该电池的负极电极反应方程式为
+3H2O,该电池的负极电极反应方程式为___________ ,K+向___________ 极(填正或负)移动,若电路中通过0.4mol电子,则理论上消耗甲烷的体积为(标况)___________ 。
(1)为了探究化学反应中的能量变化,某同学设计了如下两个实验。
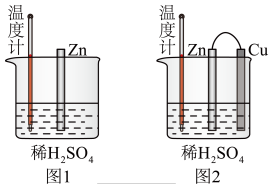
A.图1和图2的气泡均产生在锌棒表面
B.图1中温度计的示数高于图2的示数
C.图2中产生气体的速度比1快
D.图1和图2中温度计的示数相等,且均高于室温
②图②装置中,正极的电极反应方程式为
(2)将反应2Fe3++Fe=3Fe2+设计成原电池装置,负极的电极反应方程式为
(3)甲烷碱性燃料电池以KOH溶液为电解质溶液,电池反应为CH4+2O2+2OH-
 CO
CO +3H2O,该电池的负极电极反应方程式为
+3H2O,该电池的负极电极反应方程式为
您最近一年使用:0次
4 . 电解质的水溶液跟日常生活、工农业生产和环境保护息息相关。常温下,叠氮酸 是一元弱酸,高锰酸
是一元弱酸,高锰酸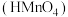 是一元强酸,
是一元强酸, 的高铼酸
的高铼酸 、
、 的高锰酸
的高锰酸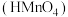 溶液分别与
溶液分别与 的
的 溶液等体积混合,所得溶液均呈中性。请回答下列问题:
溶液等体积混合,所得溶液均呈中性。请回答下列问题:
(1)高铼酸属于___________ (填“强”或“弱”)酸,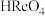 中Re的化合价为
中Re的化合价为___________ 。
(2)常温下,已知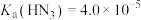 ,则
,则 的
的 溶液中
溶液中
___________  。
。
(3)已知25°C时, 的
的 ;
; 的:
的: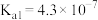
 ;HCN的
;HCN的 ,回答下列问题:
,回答下列问题:
①25°C时,向NaCN溶液中通入少量 ,反应的离子方程式为
,反应的离子方程式为___________ 。
②下列措施中能使醋酸的水溶液中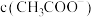 增大的同时
增大的同时 减小的是
减小的是___________ (填标号)。
A.加入 固体 B.加入固体
固体 B.加入固体 C.加入NaCN固体 D.升高温度
C.加入NaCN固体 D.升高温度
(4)常温时
 溶液,
溶液, 浓度为
浓度为___________ ,由水电离的 为
为___________ 。
 是一元弱酸,高锰酸
是一元弱酸,高锰酸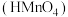 是一元强酸,
是一元强酸, 的高铼酸
的高铼酸 、
、 的高锰酸
的高锰酸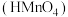 溶液分别与
溶液分别与 的
的 溶液等体积混合,所得溶液均呈中性。请回答下列问题:
溶液等体积混合,所得溶液均呈中性。请回答下列问题:(1)高铼酸属于
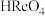 中Re的化合价为
中Re的化合价为(2)常温下,已知
 ,则
,则 的
的 溶液中
溶液中
 。
。(3)已知25°C时,
 的
的 ;
; 的:
的: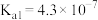
 ;HCN的
;HCN的 ,回答下列问题:
,回答下列问题:①25°C时,向NaCN溶液中通入少量
 ,反应的离子方程式为
,反应的离子方程式为②下列措施中能使醋酸的水溶液中
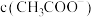 增大的同时
增大的同时 减小的是
减小的是A.加入
 固体 B.加入固体
固体 B.加入固体 C.加入NaCN固体 D.升高温度
C.加入NaCN固体 D.升高温度(4)常温时

 溶液,
溶液, 浓度为
浓度为 为
为
您最近一年使用:0次
名校
5 . 回答下列问题:
(1)一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物分别经过浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重6.6g。求乙醇和氧气物质的量分别是___________ 、___________ 。
(2)若将0.6mol乙醇与11.5g金属钠充分反应,则标况下生成气体的体积是___________ 。
(1)一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物分别经过浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重6.6g。求乙醇和氧气物质的量分别是
(2)若将0.6mol乙醇与11.5g金属钠充分反应,则标况下生成气体的体积是
您最近一年使用:0次
名校
6 . 按照要求填空:
(1)判断下列分子的极性、分子的空间构型和中心原子的杂化方式。
(2)① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ 。
。
①既有 键,又有
键,又有 键的是
键的是_______ (用序号作答);既含有极性键又含有非极性键的极性分子的电子式为_______ ;既含有极性键又含有非极性键的非极性分子中碳原子的杂化方式为________ ;苯环中存在的大 键可表示为
键可表示为________ 。
②属于离子化合物的物质的电子式为______ ; 与
与 结构相似,则
结构相似,则 的电子式为
的电子式为_____ ; 中
中 键和
键和 键之比为
键之比为______ 。
(1)判断下列分子的极性、分子的空间构型和中心原子的杂化方式。
| 序号 | 化学式 | 分子的极性 | 空间构型 | 中心原子的杂化方式 |
| ① |  | |||
| ② |  | |||
| ③ |  | - |
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ 。
。①既有
 键,又有
键,又有 键的是
键的是 键可表示为
键可表示为②属于离子化合物的物质的电子式为
 与
与 结构相似,则
结构相似,则 的电子式为
的电子式为 中
中 键和
键和 键之比为
键之比为
您最近一年使用:0次
名校
解题方法
7 . 按要求回答下列问题:
(1)基态 原子中,核外电子排布式为
原子中,核外电子排布式为________ ,核外电子占据的最高能层电子的电子云轮廓图形状为_______ ,它在周期表中的位置为_______ ,与钛同周期元素的基态原子中,未成对电子数与钛相同的元素有____ 种。
(2) 与
与 形成
形成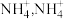 中
中 键角比
键角比 中
中 键角大,原因是
键角大,原因是______ , 中
中 键角
键角__  中
中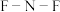 键角(填写“大于”“小于”或“等于”)。
键角(填写“大于”“小于”或“等于”)。
(3)比较①乙酸②甲酸③二氯乙酸的酸性由强到弱的顺序为_______ (填序号);比较① ②
② ③
③ 的熔点由低到高的顺序为
的熔点由低到高的顺序为________ (填序号);比较①晶体硅 ②晶体锗 ③ ④
④ 的熔点由低到高的顺序为
的熔点由低到高的顺序为_______ (填序号)。
(4)在周期表中,与 化学性质最相似的邻族元素是
化学性质最相似的邻族元素是______ ,该元素的最高正价氧化物对应的水化物与氢氧化钠反应的离子方程式为______ 。
(5) 等是有机反应中重要的中间体。碳正离子
等是有机反应中重要的中间体。碳正离子 可以通过
可以通过 在“超强酸”中获得1个
在“超强酸”中获得1个 而得到,而
而得到,而 失去
失去 可得
可得 。
。
① 是反应性很强的正离子,是缺电子的,其电子式是
是反应性很强的正离子,是缺电子的,其电子式是______ 。
② 中4个原子是共平面的,3个键角相等,键角应是
中4个原子是共平面的,3个键角相等,键角应是_______ 。
(1)基态
 原子中,核外电子排布式为
原子中,核外电子排布式为(2)
 与
与 形成
形成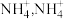 中
中 键角比
键角比 中
中 键角大,原因是
键角大,原因是 中
中 键角
键角 中
中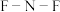 键角(填写“大于”“小于”或“等于”)。
键角(填写“大于”“小于”或“等于”)。(3)比较①乙酸②甲酸③二氯乙酸的酸性由强到弱的顺序为
 ②
② ③
③ 的熔点由低到高的顺序为
的熔点由低到高的顺序为 ④
④ 的熔点由低到高的顺序为
的熔点由低到高的顺序为(4)在周期表中,与
 化学性质最相似的邻族元素是
化学性质最相似的邻族元素是(5)
 等是有机反应中重要的中间体。碳正离子
等是有机反应中重要的中间体。碳正离子 可以通过
可以通过 在“超强酸”中获得1个
在“超强酸”中获得1个 而得到,而
而得到,而 失去
失去 可得
可得 。
。①
 是反应性很强的正离子,是缺电子的,其电子式是
是反应性很强的正离子,是缺电子的,其电子式是②
 中4个原子是共平面的,3个键角相等,键角应是
中4个原子是共平面的,3个键角相等,键角应是
您最近一年使用:0次
名校
解题方法
8 . 根据化学反应速率和化学反应限度的知识回答下列问题:
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:___________ 。
(2)反应开始至4 min时,A的平均反应速率为___________ 。
(3)4 min时,反应是否达平衡状态?___________ (填“是”或“否”),8 min时,v正___________ v逆。(填“>”“<”或“=”)
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。___________ 。
(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为___________ 。
②反应达到平衡时,放出的热量___________ (填字母,下同)。
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为___________ 。
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)__________
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:
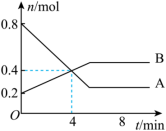
(2)反应开始至4 min时,A的平均反应速率为
(3)4 min时,反应是否达平衡状态?
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。

(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为
②反应达到平衡时,放出的热量
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)

您最近一年使用:0次
2024-04-30更新
|
385次组卷
|
2卷引用:宁夏石嘴山市第三中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
9 . 运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3: ,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。 ___________ (填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)课本里介绍的合成氨技术叫哈伯法: ,应用此法反应达到平衡时反应物的转化率不高。
,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是___________ (填编号)。
A.使用更高效的催化剂 B.升高温度
C.减小体积 D.充入氮气,增大氮气的浓度(保持容器体积不变)
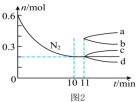
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2 的物质的量随时间的变化曲线。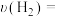
___________ 。从第11min起,扩大容器的体积为4 L,则n(N2) 的变化曲线为___________ (填编号)。
(3)实验室模拟用浓硫酸脱除氮氧化物,装置如图所示,实验开始后装置C中发生反应:NO+NO2+2H2SO4(浓)=2NOHSO4+H2O。___________ ,装置B的作用是___________ 。
②理论上应控制相同时间内a、b处通入气体的物质的量之比为___________ 。
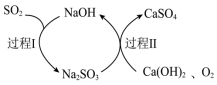
(4)可用双碱法(氢氧化钙为悬浊液)脱硫处理工业废气中的SO2,原理如图所示,双碱法脱硫的总反应方程式为___________ 。
(1)硫酸生产中,SO2催化氧化生成SO3:
 ,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。 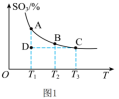
②若反应进行到状态D时,

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)课本里介绍的合成氨技术叫哈伯法:
 ,应用此法反应达到平衡时反应物的转化率不高。
,应用此法反应达到平衡时反应物的转化率不高。①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是
A.使用更高效的催化剂 B.升高温度
C.减小体积 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2 的物质的量随时间的变化曲线。
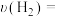
(3)实验室模拟用浓硫酸脱除氮氧化物,装置如图所示,实验开始后装置C中发生反应:NO+NO2+2H2SO4(浓)=2NOHSO4+H2O。
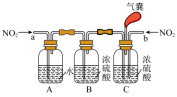
②理论上应控制相同时间内a、b处通入气体的物质的量之比为
(4)可用双碱法(氢氧化钙为悬浊液)脱硫处理工业废气中的SO2,原理如图所示,双碱法脱硫的总反应方程式为
您最近一年使用:0次
名校
解题方法
10 . 甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
(1)甲醇可以替代汽油和柴油作为内燃机燃料。汽油的主要成分之一是辛烷[C8H18(l)]。已知:25°C、101 kPa 时,1 molC8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应燃烧热的热化学方程式为_______ 。
(2)甲醇的合成以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。_________ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH______ 。(填“变大”“变小”或“不变”)
(3)已知下列反应的焓变
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1= -870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH2= -393.5kJ/mol
③2H2(g)+O2(g) =2H2O(l) ΔH3= -285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=__________ 。
(1)甲醇可以替代汽油和柴油作为内燃机燃料。汽油的主要成分之一是辛烷[C8H18(l)]。已知:25°C、101 kPa 时,1 molC8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应燃烧热的热化学方程式为
(2)甲醇的合成以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
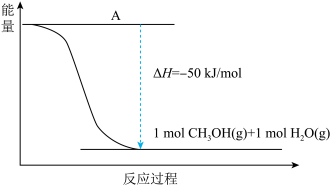
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH
(3)已知下列反应的焓变
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1= -870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH2= -393.5kJ/mol
③2H2(g)+O2(g) =2H2O(l) ΔH3= -285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=
您最近一年使用:0次



