名校
解题方法
1 . 氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。
Ⅰ.甲醇-水催化重整可获得氢气。
(1)表中数据是该反应中相关物质的标准摩尔生成焓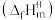 数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
则

_______  ,该反应在
,该反应在_______ (填“高温”“低温”或“任意温度”)下能自发进行。
Ⅱ.乙醇-水催化重整亦可获得,主要反应如下:
反应①: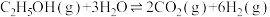
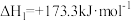
反应②:
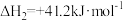
(2)向恒容密闭容器中充入1mol 和3mol
和3mol  发生上述反应①和②,初始时体系压强为100kPa.平衡时
发生上述反应①和②,初始时体系压强为100kPa.平衡时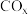 的分布分数
的分布分数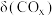 、
、 的产率随温度的变化曲线如图所示。
的产率随温度的变化曲线如图所示。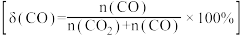
_______ (写出2条)。
②200℃以后,解释曲线a随温度变化趋势的原因:_______ 。
③温度为500℃时,反应经10min达到平衡,此时乙醇的转化率为60%,则0~10min内
___  ,该温度下,反应②的
,该温度下,反应②的
_______ (保留小数点后两位)。
(3)乙醇燃料电池(电极材料a和b均为惰性电极)广泛应用于微型电源、能源汽车、家用电源、国防等领域,工作原理如图所示,写出负极的电极反应式:_______ ,当转移1.2mol电子时,正极消耗的氧气的体积为_______ L(标准状况下)。
Ⅰ.甲醇-水催化重整可获得氢气。
(1)表中数据是该反应中相关物质的标准摩尔生成焓
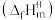 数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。| 物质 |  |  |  |  |
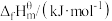 | 0 | -393.5 | -241.8 | -200.7 |


 ,该反应在
,该反应在Ⅱ.乙醇-水催化重整亦可获得,主要反应如下:
反应①:
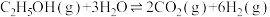
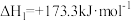
反应②:

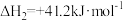
(2)向恒容密闭容器中充入1mol
 和3mol
和3mol  发生上述反应①和②,初始时体系压强为100kPa.平衡时
发生上述反应①和②,初始时体系压强为100kPa.平衡时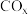 的分布分数
的分布分数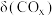 、
、 的产率随温度的变化曲线如图所示。
的产率随温度的变化曲线如图所示。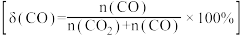

②200℃以后,解释曲线a随温度变化趋势的原因:
③温度为500℃时,反应经10min达到平衡,此时乙醇的转化率为60%,则0~10min内

 ,该温度下,反应②的
,该温度下,反应②的
(3)乙醇燃料电池(电极材料a和b均为惰性电极)广泛应用于微型电源、能源汽车、家用电源、国防等领域,工作原理如图所示,写出负极的电极反应式:

您最近一年使用:0次
2024-06-08更新
|
142次组卷
|
3卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学
名校
解题方法
2 . Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是______ ;基态Se原子的价电子运动状态有____ 种。
(2)已知液态的二氧化硫可以发生类似水的自电离: 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为_______ , 的空间结构为
的空间结构为_______ 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为________ ,二者中更易与 形成配位键的是
形成配位键的是________ 。 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是______ 。
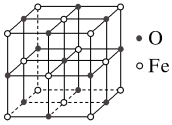
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为______ ,Fe2+与O2-最短核间距为_____ pm。
(1)Se与O同族,电负性较大的是
(2)已知液态的二氧化硫可以发生类似水的自电离:
 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为 的空间结构为
的空间结构为(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是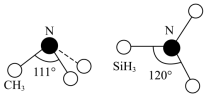
 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为
您最近一年使用:0次
名校
3 . 水合肼(N2H4·H2O)作为一种重要的精细化工原料,主要用于合成AC、D1PA,TSH等发泡剂。工业上常用尿素[CO(NH2)2]、NaOH、NaClO溶液反应制备水合肼。
已知:①Cl2与NaOH反应为放热反应,Cl2与热的NaOH溶液反应会生成NaClO3。
②N2H4·H2O沸点为118℃,具有强还原性。
回答下列问题:
Ⅰ.制备NaClO溶液(实验装置如图所示):_______ 。
(2)装置C中发生反应的离子方程式为_______ ,用冰水浴控制温度在25℃以下,其主要目的是_______ 。
Ⅱ.制备水合肼:
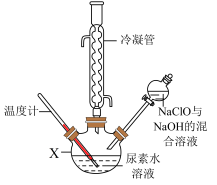
将制得的NaClO与NaOH的混合溶液滴入尿素水溶液中,在一定温度下加热,装置如图所示(夹持及控温装置已略),充分反应后,仪器X中的溶液经蒸馏获得水合肼粗品,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3·10H2O。_______ ,X中发生反应的化学方程式是_______ 。
(4)若滴加NaClO溶液的速度较快时,水合肼的产率会下降,原因是_______ 。
(5)水合肼是二元弱碱,在溶液中可发生类似NH3·H2O的电离。写出水合肼和HCl控物质的量之比为1∶1反应的离子方程式:_____ 。
(6)实验室可用碘测定水合肼的浓度,称取5.0g水合肼样品,加入适量水、稀硫酸、碳酸氢钠,配成500mL溶液,从中取出20.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.200mol·L-1I2标准溶液进行滴定,滴定终点的现象是_______ ,测得消耗标准溶液的体积为24.00mL,则样品中水合肼(N2H4·H2O)的质量分数为______ (已知:N2H4·H2O+2I2+H2SO4+6NaHCO3=N2↑+4NaI+6CO2↑+Na2SO4+7H2O)。
已知:①Cl2与NaOH反应为放热反应,Cl2与热的NaOH溶液反应会生成NaClO3。
②N2H4·H2O沸点为118℃,具有强还原性。
回答下列问题:
Ⅰ.制备NaClO溶液(实验装置如图所示):
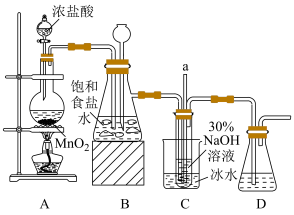
(2)装置C中发生反应的离子方程式为
Ⅱ.制备水合肼:
将制得的NaClO与NaOH的混合溶液滴入尿素水溶液中,在一定温度下加热,装置如图所示(夹持及控温装置已略),充分反应后,仪器X中的溶液经蒸馏获得水合肼粗品,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3·10H2O。
(4)若滴加NaClO溶液的速度较快时,水合肼的产率会下降,原因是
(5)水合肼是二元弱碱,在溶液中可发生类似NH3·H2O的电离。写出水合肼和HCl控物质的量之比为1∶1反应的离子方程式:
(6)实验室可用碘测定水合肼的浓度,称取5.0g水合肼样品,加入适量水、稀硫酸、碳酸氢钠,配成500mL溶液,从中取出20.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.200mol·L-1I2标准溶液进行滴定,滴定终点的现象是
您最近一年使用:0次
2024-06-02更新
|
113次组卷
|
2卷引用:2024届宁夏回族自治区石嘴山市平罗县平罗中学高三下学期模拟预测理综试题-高中化学
名校
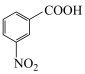
4 . 安立生坦是一种治疗肺动脉高血压药物,由芳香化合物A合成其中间体G的一种合成路线如下:
(1)A的化学名称是___________ ,由C生成D的反应类型是___________ 。
(2)D的结构简式是___________ ,F的结构简式是___________ 。
(3)B与NaOH溶液反应的化学方程式是___________ 。
(4)含有两个苯环的芳香化合物X是E的同分异构体,X中不含其他环状结构,X在酸性条件下水解只生成一种有机物,则X有___________ 种,其中核磁振氢谱有3组峰,峰面积之比为3:2:2的化合物的结构简式为___________ 。
(5)写出用甲烷和苯为原料制备化合物2,4,6-三硝基苯甲酸的合成路线:___________ (无机试剂任选)。

②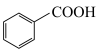
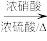
(1)A的化学名称是
(2)D的结构简式是
(3)B与NaOH溶液反应的化学方程式是
(4)含有两个苯环的芳香化合物X是E的同分异构体,X中不含其他环状结构,X在酸性条件下水解只生成一种有机物,则X有
(5)写出用甲烷和苯为原料制备化合物2,4,6-三硝基苯甲酸的合成路线:
您最近一年使用:0次
2024-06-02更新
|
422次组卷
|
4卷引用:2024届宁夏石嘴山市第三中学高三下学期四模理综试题-高中化学
名校
解题方法
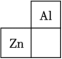
5 . 锌在工业中有重要作用,也是人体必需的微量元素。锌元素在周期表中的位置如图所示。___________ ,其核外电子共占据 ___________ 条轨道。
(2)自然界中共存在五种常见的锌的稳定同位素,其中丰度最高的核素含有34个中子,该核素可以表示为 ___________。
(3)中医典籍中记载了炉甘石(ZnCO3)可用于治疗皮肤炎症或表面创伤。ZnCO3中,负离子的空间构型为 ___________ ,Zn、C、O的电负性由小到大的顺序是 ___________ 。
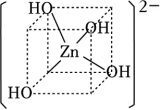
(4)锌的氢氧化物既能溶于强酸,又能溶于强碱。Zn(OH)2溶于强碱生成[Zn(OH)4]2﹣,结构如图所示。该微粒中OH﹣提供孤电子对,Zn2+提供___________ ,Zn2+的杂化方式为 ___________ 。
解释ZnCl2与ZnBr2熔点存在差异的原因 ___________ 。
(6)ZnF2晶胞如图所示,一个晶胞中含有___________ 个F﹣。若NA表示阿伏加德罗常数的值,则ZnF2晶体(摩尔质量为M)的密度为 ___________ g•cm-3(用含a、c、M、NA的代数式表示)。
(2)自然界中共存在五种常见的锌的稳定同位素,其中丰度最高的核素含有34个中子,该核素可以表示为 ___________。
| A.34Zn | B.34Zn | C.64Zn | D.64Zn |
(4)锌的氢氧化物既能溶于强酸,又能溶于强碱。Zn(OH)2溶于强碱生成[Zn(OH)4]2﹣,结构如图所示。该微粒中OH﹣提供孤电子对,Zn2+提供
| 卤化锌 | ZnCl2 | ZnBr2 |
| 熔点/℃ | 283 | 394 |
(6)ZnF2晶胞如图所示,一个晶胞中含有

您最近一年使用:0次
6 . 铬酸铅(PbCrO4)又称铬黄,是一种重要的黄色颜料,常用作橡胶、水彩、色纸的着色剂。以含铅废渣(主要成分是PbSO4和ZnO,还含Fe3O4、SiO2等)为原料制备铬酸铅的流程如下:
②常温下,几种难溶电解质的溶度积如下:
回答下列问题:
(1)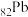 位于周期表第
位于周期表第___________ 周期___________ 族,PbCrO4中Cr的化合价为___________ 。
(2)“碱浸”中PbSO4转化反应的离子方程式为___________ 。
(3)已知:“酸浸”中6.3gHNO3作氧化剂时转移0.3mol电子。气体R在空气中的颜色变化为___________ 。
(4)“酸浸”中铅元素浸出率与温度、硝酸浓度的关系如图所示。“酸浸”最佳条件为___________ 。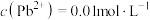 ,“除铁”中控制pH范围为
,“除铁”中控制pH范围为___________ 。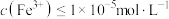 ,则表明Fe3+已完全沉淀。
,则表明Fe3+已完全沉淀。
(6)“沉铬”中生成PbCrO4反应的离子方程式为___________ 。
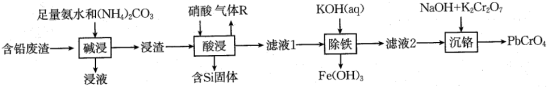
②常温下,几种难溶电解质的溶度积如下:
| 电解质 | PbCO3 | PbSO4 | PbCrO4 | Pb(OH)2 | Fe(OH)3 |
 | 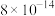 |  | 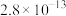 | 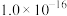 | 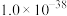 |
(1)
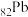 位于周期表第
位于周期表第(2)“碱浸”中PbSO4转化反应的离子方程式为
(3)已知:“酸浸”中6.3gHNO3作氧化剂时转移0.3mol电子。气体R在空气中的颜色变化为
(4)“酸浸”中铅元素浸出率与温度、硝酸浓度的关系如图所示。“酸浸”最佳条件为
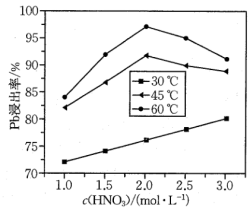
 ,“除铁”中控制pH范围为
,“除铁”中控制pH范围为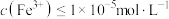 ,则表明Fe3+已完全沉淀。
,则表明Fe3+已完全沉淀。(6)“沉铬”中生成PbCrO4反应的离子方程式为
您最近一年使用:0次
2024-05-18更新
|
77次组卷
|
2卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学
名校
解题方法
7 . 氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示:_____ 。
(2)关于这两种晶体的说法,正确的是______ 。(填序号)
a.立方相氮化硼含有 键和
键和 键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的 键均为共价键 d.两种晶体均为分子晶体
键均为共价键 d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为_______ ,其结构与石墨相似却不导电,原因是_______ 。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为_____ 。该晶体的天然矿物在青藏高原地下约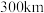 的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是
的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是_______ 。
(5)单质硼有无定形和晶体两种,参考下列数据:
①晶体硼的晶体类型属于________ 晶体。
②已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图所示),各正二十面体之间以 键相互联结,在每个正二十面体中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由
键相互联结,在每个正二十面体中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由______ 个硼原子构成,其中 键之间的键角是
键之间的键角是_____ 。

(2)关于这两种晶体的说法,正确的是
a.立方相氮化硼含有
 键和
键和 键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软c.两种晶体中的
 键均为共价键 d.两种晶体均为分子晶体
键均为共价键 d.两种晶体均为分子晶体(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为
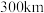 的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是
的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是(5)单质硼有无定形和晶体两种,参考下列数据:
| 晶体 | 金刚石 | 晶体硅 | 晶体硼 |
熔点 | 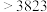 | 1683 | 2573 |
沸点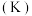 | 5100 | 2628 | 2823 |
硬度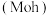 | 10 | 7.0 | 9.5 |
②已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图所示),各正二十面体之间以
 键相互联结,在每个正二十面体中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由
键相互联结,在每个正二十面体中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由 键之间的键角是
键之间的键角是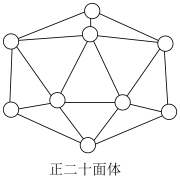
您最近一年使用:0次
名校
解题方法
8 . 按照要求回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_____ 方法区分晶体、准晶体和非晶体。
(2) 单质为体心立方晶体,其晶胞参数
单质为体心立方晶体,其晶胞参数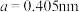 ,晶胞中铁原子的配位数为
,晶胞中铁原子的配位数为______ ,铁原子半径为______ ,列式表示铁晶胞的空间利用率____ 。(不必计算出结果)
(3)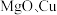 和干冰的晶胞示意图如图:
和干冰的晶胞示意图如图:________ 。
②在 晶体中,与
晶体中,与 相邻且最近的
相邻且最近的 个数为
个数为_______ ; 配位数为
配位数为_______ 。
③每个 晶胞中平均有
晶胞中平均有_____ 个 原子。
原子。
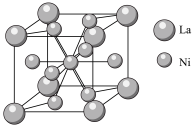
④金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,若阿伏加德罗常数为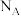 晶胞边长为
晶胞边长为 ,晶胞的密度为
,晶胞的密度为______ 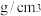 。
。 晶胞中,
晶胞中, 原子半径为
原子半径为 原子半径为
原子半径为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,
表示, 的密度可表示为
的密度可表示为____  。
。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)
 单质为体心立方晶体,其晶胞参数
单质为体心立方晶体,其晶胞参数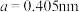 ,晶胞中铁原子的配位数为
,晶胞中铁原子的配位数为(3)
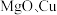 和干冰的晶胞示意图如图:
和干冰的晶胞示意图如图: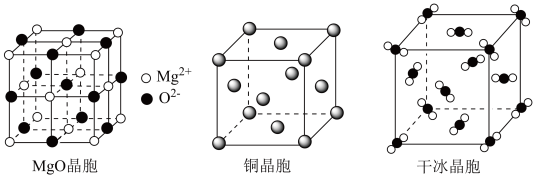
②在
 晶体中,与
晶体中,与 相邻且最近的
相邻且最近的 个数为
个数为 配位数为
配位数为③每个
 晶胞中平均有
晶胞中平均有 原子。
原子。④金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,若阿伏加德罗常数为
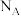 晶胞边长为
晶胞边长为 ,晶胞的密度为
,晶胞的密度为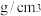 。
。
 晶胞中,
晶胞中, 原子半径为
原子半径为 原子半径为
原子半径为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,
表示, 的密度可表示为
的密度可表示为 。
。
您最近一年使用:0次
名校
解题方法
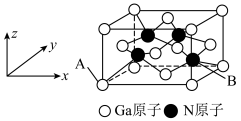
9 . A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的电负性由小到大的顺序为_______ (用元素符号表示)。
(2)B单质的熔点比C单质熔点_______ ,B的氯化物的熔点比C的氯化物的熔点_______ (填高或低)。理由_______ 。
(3) 形成某种化合物的晶胞结构如图所示,该化合物的化学式为
形成某种化合物的晶胞结构如图所示,该化合物的化学式为_______ 。_______ 。
(1)A、B、C、D的电负性由小到大的顺序为
(2)B单质的熔点比C单质熔点
(3)
 形成某种化合物的晶胞结构如图所示,该化合物的化学式为
形成某种化合物的晶胞结构如图所示,该化合物的化学式为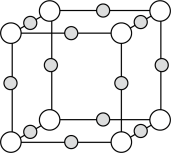
您最近一年使用:0次
名校
解题方法
10 . 锰元素在一些有机物的氧化过程中会以中间体形式出现一种美丽的亮蓝色离子MnO (次锰酸根离子)。工业上可用低品位锰矿(主要成分MnO2,含Fe、Al、Ni等元素的杂质)与废FeSO4经过一系列转化得到高品位MnO2,同时继续制备次锰酸盐,流程如下:
(次锰酸根离子)。工业上可用低品位锰矿(主要成分MnO2,含Fe、Al、Ni等元素的杂质)与废FeSO4经过一系列转化得到高品位MnO2,同时继续制备次锰酸盐,流程如下:
(1)次锰酸根离子MnO 中Mn的化合价为
中Mn的化合价为___________ 。
(2)“焙烧”过程中的氧化剂为___________ 、___________ (填化学式)。
(3)“除铝”过程中的离子方程式为___________ 。
(4)“滤渣2”的主要成分为___________ 、___________ (填化学式)。
(5)“沉锰”时,Mn2+会转化为MnCO3.若常温下控制溶液pH=8,且最终c(HCO )=0.1 mol·L-1,则此时溶液中c(Mn2+)=
)=0.1 mol·L-1,则此时溶液中c(Mn2+)=___________ mol·L-1。
(6)在“共熔”过程中,需要向煅烧后产生的MnO2固体中添加一定比例的NaNO3、NaOH,反应得到Na2MnO4及一种单质气体,则该反应的化学方程式为___________ 。
 (次锰酸根离子)。工业上可用低品位锰矿(主要成分MnO2,含Fe、Al、Ni等元素的杂质)与废FeSO4经过一系列转化得到高品位MnO2,同时继续制备次锰酸盐,流程如下:
(次锰酸根离子)。工业上可用低品位锰矿(主要成分MnO2,含Fe、Al、Ni等元素的杂质)与废FeSO4经过一系列转化得到高品位MnO2,同时继续制备次锰酸盐,流程如下: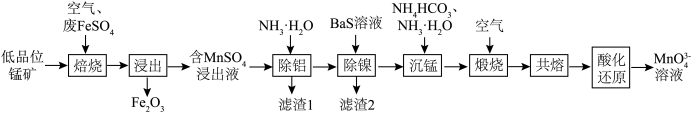
| 物质 | MnCO3 | H2CO3 |
| 25℃数值 | Ksp=2.0×10-11 | Ka1=4×10-7 Ka2=5×10-11 |
(1)次锰酸根离子MnO
 中Mn的化合价为
中Mn的化合价为(2)“焙烧”过程中的氧化剂为
(3)“除铝”过程中的离子方程式为
(4)“滤渣2”的主要成分为
(5)“沉锰”时,Mn2+会转化为MnCO3.若常温下控制溶液pH=8,且最终c(HCO
 )=0.1 mol·L-1,则此时溶液中c(Mn2+)=
)=0.1 mol·L-1,则此时溶液中c(Mn2+)=(6)在“共熔”过程中,需要向煅烧后产生的MnO2固体中添加一定比例的NaNO3、NaOH,反应得到Na2MnO4及一种单质气体,则该反应的化学方程式为
您最近一年使用:0次



