名校
解题方法
1 . 完成下列问题
(1)把盛满 和
和 的混合气体的试管倒立于水中。
的混合气体的试管倒立于水中。
①若一段时间内水上升且充满试管,则原混合气体中 和
和 的体积比是
的体积比是___________ ,若假设生成的溶质不向外扩散,且为标准状况。则所得溶液的物质的量浓度应为___________ 。(保留二位有效数字)
②若一段时间后上升的水只升到试管容积的一半,则剩余的气体为___________ (用化学式表示)。原混合气体中, 和
和 的体积比是
的体积比是___________ 。
(2)二氧化氮和氨气在一定条件下,充分反应,得到非常稳定的产物,其化学方程式为: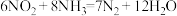 ,若
,若 和
和 的混合气体在一定条件下发生上述反应,已知实际参加反应的
的混合气体在一定条件下发生上述反应,已知实际参加反应的 比
比 少2mL,则原混合气体中
少2mL,则原混合气体中 和
和 的物质的量之比可能为___________。
的物质的量之比可能为___________。
(1)把盛满
 和
和 的混合气体的试管倒立于水中。
的混合气体的试管倒立于水中。①若一段时间内水上升且充满试管,则原混合气体中
 和
和 的体积比是
的体积比是②若一段时间后上升的水只升到试管容积的一半,则剩余的气体为
 和
和 的体积比是
的体积比是(2)二氧化氮和氨气在一定条件下,充分反应,得到非常稳定的产物,其化学方程式为:
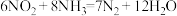 ,若
,若 和
和 的混合气体在一定条件下发生上述反应,已知实际参加反应的
的混合气体在一定条件下发生上述反应,已知实际参加反应的 比
比 少2mL,则原混合气体中
少2mL,则原混合气体中 和
和 的物质的量之比可能为___________。
的物质的量之比可能为___________。| A.3:4 | B.3:2 | C.1:2 | D.3:7。 |
您最近一年使用:0次
名校
解题方法
2 . 按照要求填空:
(1)在①NaCl晶体②干冰③液态醋酸④铜⑤硫酸钡固体⑥熔融KNO3⑦CuSO4·5H2O⑧稀硫酸⑨盐酸⑩酒精中,属于电解质的是___________ ,属于强电解质的是___________ ,属于非电解质的是___________ ,能导电的是___________ 。
(2)在H+、Mg2+、Fe2+、Fe3+、S2-、I-、S中,只有还原性的是___________ ,既有氧化性又有还原性的是___________ 。
(3)过氧化钠常用作供氧剂,可以与二氧化碳或水反应放出氧气,在过氧化钠中阳离子与阴离子的个数比为___________ ;它与盐酸反应的化学方程式为___________ 。
(4)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
①该反应中的还原剂是___________ 。
②写出该反应的化学方程式并用单线桥标出电子转移的方向和数目___________ 。
③如反应转移了0.3mol电子,则产生的气体在标准状况下体积为___________ 。
(5)19.6克硫酸中含有___________ 个原子,将其溶于水配成500mL溶液则溶液的物质的量浓度为___________ ,从中取出100mL可以消耗1mol/L的NaOH溶液___________ mL。
(6)物质的量相等的SO2和SO3,其质量之比为________ ,所含原子数之比为________ ,所含质子数之比为________ ,质量相等的SO2和SO3,所含氧原子数之比为___________ 。
(7)标准状况下,1.6g某气态氧化物RO2体积为0.56L,R的相对原子量为___________ 。36g 中质子数为
中质子数为___________ ,电子数为___________ (用NA表示)。
(8)CO和CO2的混合气体36g,完全燃烧后测得STP下CO2体积为22.4L,那么混合气体中CO的质量是___________ ,混合气体的平均摩尔质量为___________ ,混合气体中CO2在标准状况下的体积是___________ ,混合气体在标准状况下的密度是___________ ,该混合气体对氢气的相对密度为___________ 。
(1)在①NaCl晶体②干冰③液态醋酸④铜⑤硫酸钡固体⑥熔融KNO3⑦CuSO4·5H2O⑧稀硫酸⑨盐酸⑩酒精中,属于电解质的是
(2)在H+、Mg2+、Fe2+、Fe3+、S2-、I-、S中,只有还原性的是
(3)过氧化钠常用作供氧剂,可以与二氧化碳或水反应放出氧气,在过氧化钠中阳离子与阴离子的个数比为
(4)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
①该反应中的还原剂是
②写出该反应的化学方程式并用单线桥标出电子转移的方向和数目
③如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
(5)19.6克硫酸中含有
(6)物质的量相等的SO2和SO3,其质量之比为
(7)标准状况下,1.6g某气态氧化物RO2体积为0.56L,R的相对原子量为
 中质子数为
中质子数为(8)CO和CO2的混合气体36g,完全燃烧后测得STP下CO2体积为22.4L,那么混合气体中CO的质量是
您最近一年使用:0次
名校
3 . 按要求完成。
(1)19.6克硫酸是___________ molH2SO4,含有___________ 个原子,1.7克NH3在同温同压下与___________ 克H2S气体含有的氢原子数相同。
(2)标准状况下,密度为0.75g/L的NH3与CH4组成的混合气体中,NH3的体积分数___________ ,混合气体的平均摩尔质量为___________ 该气体对氢气的相对密度为___________ 。
(3)已知Wg气体A含有a个分子,那么在标准状况下,bg气体A所占的体积是___________ (其中阿伏加德罗常数用NA表示)。
(4)将MgCl2·xH2O的晶体4.06g溶于水配成100mL溶液,取出50mL溶液正好与0.02moL的AgNO3溶液完全作用,4.06g的MgCl2·xH2O物质的量为___________ 式中x的数值___________ 。
(5)配制100mL1mol·L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为___________ mL。
(6)现要配制1mol·L-1Na2CO3溶液250mL
①需要含结晶水的碳酸钠晶体(Na2CO3·10H2O)___________ g;
②在配制上述溶液的过程中,可能导致配制溶液浓度偏小的有___________
A.固体Na2CO3·10H2O放在右盘(1g以下用游码);
B.容量瓶用碳酸钠溶液先润洗;
C.转移溶液时未洗涤烧杯
D.定容时溶液未冷却;
E.定容时视线仰视;
F.摇匀时,发现液面低于容量瓶刻度线,但未补加水;
G.容量瓶未干燥。
(1)19.6克硫酸是
(2)标准状况下,密度为0.75g/L的NH3与CH4组成的混合气体中,NH3的体积分数
(3)已知Wg气体A含有a个分子,那么在标准状况下,bg气体A所占的体积是
(4)将MgCl2·xH2O的晶体4.06g溶于水配成100mL溶液,取出50mL溶液正好与0.02moL的AgNO3溶液完全作用,4.06g的MgCl2·xH2O物质的量为
(5)配制100mL1mol·L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为
(6)现要配制1mol·L-1Na2CO3溶液250mL
①需要含结晶水的碳酸钠晶体(Na2CO3·10H2O)
②在配制上述溶液的过程中,可能导致配制溶液浓度偏小的有
A.固体Na2CO3·10H2O放在右盘(1g以下用游码);
B.容量瓶用碳酸钠溶液先润洗;
C.转移溶液时未洗涤烧杯
D.定容时溶液未冷却;
E.定容时视线仰视;
F.摇匀时,发现液面低于容量瓶刻度线,但未补加水;
G.容量瓶未干燥。
您最近一年使用:0次
名校
解题方法
4 . 在2L的NaCl和MgCl2的混合溶液中,部分离子浓度大小如图所示,回答下列问题:

(1)混合溶液中,Na+的物质的量为____ moL,MgCl2的物质的量为_____ moL,Cl-的物质的量为_____ moL 。
(2)混合溶液中含溶质的总质量为______ g 。
(3)将该混合溶液加水稀释至体积为1L,稀释后溶液中的Cl-物质的量浓度为___ moL·L-1。

(1)混合溶液中,Na+的物质的量为
(2)混合溶液中含溶质的总质量为
(3)将该混合溶液加水稀释至体积为1L,稀释后溶液中的Cl-物质的量浓度为
您最近一年使用:0次
名校
解题方法
5 . (1)标准状况下,1molCO2中氧原子的物质的量为____ ,CO2的粒子数为_____ ,CO2的摩尔质量为_____ ,CO2的质量为_____ ,CO2的体积为_____ 。
(2)常温下,10.6gNa2CO3溶于水配成500mL溶液,Na2CO3的物质的量为____ ,所得溶液的物质的量浓度为_____ .
(2)常温下,10.6gNa2CO3溶于水配成500mL溶液,Na2CO3的物质的量为
您最近一年使用:0次
名校
解题方法
6 . 标准状况下,用铝箔(过量)包裹0.1 mol金属钠,用针扎一些小孔,放入水中,完全反应后,生成的气体的体积是(标准状况下)____________ 。
您最近一年使用:0次
7 . (1)0.5 mol气态高能燃料乙硼烷 在氧气中燃烧生成固态三氧化二硼和液态水放出1082.5 kJ的热量,其热化学方程式为
在氧气中燃烧生成固态三氧化二硼和液态水放出1082.5 kJ的热量,其热化学方程式为_________ 。已知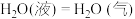
 ,则STP条件下,11.2 L乙硼烷完全燃烧生成气态水时放出的热量
,则STP条件下,11.2 L乙硼烷完全燃烧生成气态水时放出的热量____________
(2)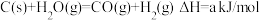 ,
,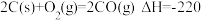
 ,又已知
,又已知 、
、 和
和 键的键能分别为
键的键能分别为 、
、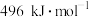 和
和 ,则a为
,则a为__________ 。
(3)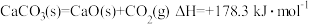 ,
, ,该反应能够自发进行,则温度所满足的条件是
,该反应能够自发进行,则温度所满足的条件是______________ 。
(4)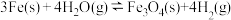 平衡常数的表达式为
平衡常数的表达式为____________ 。反应 的平衡常数为49,则该温度下反应
的平衡常数为49,则该温度下反应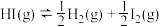 的平衡常数为
的平衡常数为____________ 。
 在氧气中燃烧生成固态三氧化二硼和液态水放出1082.5 kJ的热量,其热化学方程式为
在氧气中燃烧生成固态三氧化二硼和液态水放出1082.5 kJ的热量,其热化学方程式为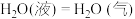
 ,则STP条件下,11.2 L乙硼烷完全燃烧生成气态水时放出的热量
,则STP条件下,11.2 L乙硼烷完全燃烧生成气态水时放出的热量(2)
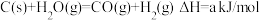 ,
,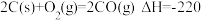
 ,又已知
,又已知 、
、 和
和 键的键能分别为
键的键能分别为 、
、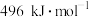 和
和 ,则a为
,则a为(3)
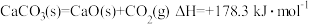 ,
, ,该反应能够自发进行,则温度所满足的条件是
,该反应能够自发进行,则温度所满足的条件是(4)
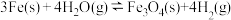 平衡常数的表达式为
平衡常数的表达式为 的平衡常数为49,则该温度下反应
的平衡常数为49,则该温度下反应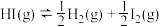 的平衡常数为
的平衡常数为
您最近一年使用:0次
2020-12-07更新
|
221次组卷
|
2卷引用:宁夏石嘴山市第三中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
8 . 金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制的工业方法,其反应原理:2NaCl(熔融) 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是____________ 。
A.放在棕色瓶中 B.放在细沙中 C.放在水中 D.放在煤油中
(2)将一小块金属钠放在干燥的坩埚中,用酒精灯加热充分反应,请写出发生反应的化学方程式:________ ,生成物的颜色为_______ 。
(3)将Na、Na2O、Na2O2、NaOH久置于空气中,最终都是变为_______________ (填化学式)。将少量金属钠投入硫酸铜溶液中写出发生的离子反应方程式___________ 。
(4)过氧化钠中阴阳离子个数比为________ ,过氧化钠常用于呼吸面具和潜水艇氧气的来源,其原理为:__________ ,______ (用化学反应方程式表示) 。
(5)已知CO2+2NaOH=Na2CO3+H2O,Na2CO3+H2O+CO2=2NaHCO3,Na2CO3+HCl= NaHCO3,NaHCO3+HCl=H2O+CO2。现将一定量的CO2通入NaOH溶液中,再向所得溶液中逐滴滴加盐酸,所得气体的体积与加入盐酸的物质的量关系如图所示:
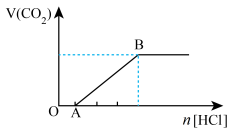
①其中OA段发生的离子反应方程式为____________ 。
②达到B点时所消耗盐酸为5mol,则原NaOH溶液中所含溶质的质量为_____ 。
 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:(1)下列各项中属于保存金属钠的正确方法是
A.放在棕色瓶中 B.放在细沙中 C.放在水中 D.放在煤油中
(2)将一小块金属钠放在干燥的坩埚中,用酒精灯加热充分反应,请写出发生反应的化学方程式:
(3)将Na、Na2O、Na2O2、NaOH久置于空气中,最终都是变为
(4)过氧化钠中阴阳离子个数比为
(5)已知CO2+2NaOH=Na2CO3+H2O,Na2CO3+H2O+CO2=2NaHCO3,Na2CO3+HCl= NaHCO3,NaHCO3+HCl=H2O+CO2。现将一定量的CO2通入NaOH溶液中,再向所得溶液中逐滴滴加盐酸,所得气体的体积与加入盐酸的物质的量关系如图所示:

①其中OA段发生的离子反应方程式为
②达到B点时所消耗盐酸为5mol,则原NaOH溶液中所含溶质的质量为
您最近一年使用:0次
9 . 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示。请回答下列问题:
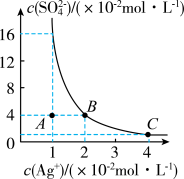
(1)A 点表示Ag2SO4是_____ ( 填“过饱和”“饱和”或“不饱和”)溶液。
(2)该温度下Ag2SO4的溶度积常数 Ksp=_____ 。(列式带入数据并计算出结果)
(3)现将足量的Ag2SO4 固体分别加入:
a.40mL0.01mol·L-1K2SO4溶液
b.10 mL 蒸馏水
c.10mL0.02mol·L-1H2SO4溶液。
则Ag2SO4的溶解程度由大到小的顺序为_____ (填字母)。
(4)向Ag2SO4悬浊液中加入足量Na2CrO4固体,可观察到有砖红色沉淀生成(Ag2CrO4为砖红色),写出沉淀转化的离子方程式:_____ 。

(1)A 点表示Ag2SO4是
(2)该温度下Ag2SO4的溶度积常数 Ksp=
(3)现将足量的Ag2SO4 固体分别加入:
a.40mL0.01mol·L-1K2SO4溶液
b.10 mL 蒸馏水
c.10mL0.02mol·L-1H2SO4溶液。
则Ag2SO4的溶解程度由大到小的顺序为
(4)向Ag2SO4悬浊液中加入足量Na2CrO4固体,可观察到有砖红色沉淀生成(Ag2CrO4为砖红色),写出沉淀转化的离子方程式:
您最近一年使用:0次
2020-07-04更新
|
104次组卷
|
4卷引用:宁夏石嘴山市第三中学2023-2024学年高二上学期第二次月考化学试题
名校
10 . 一定温度时,在4L密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示:
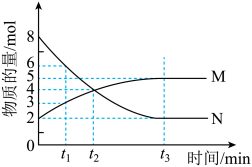
(1)t1时刻N的转化率为____________ 。
(2)0~t3时间内用M表示的化学反应速率为____________ mol/(L·min)。
(3)平衡时容器内气体的压强与起始时容器内压强的比值为____________ 。
(4)该反应的化学方程式为______ ;t2时刻,正逆反应速率大小:v正 ____ v逆(填“>”、“=”或“<”)。
(5)下列能表示上述反应达到化学平衡状态的是____________ (填编号)
A.v逆(M)=2v正(N) B.M与N的物质的量之比保持不变
C.混合气体密度保持不变 D.容器中压强保持不变
(6)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________ kJ/mol。

(1)t1时刻N的转化率为
(2)0~t3时间内用M表示的化学反应速率为
(3)平衡时容器内气体的压强与起始时容器内压强的比值为
(4)该反应的化学方程式为
(5)下列能表示上述反应达到化学平衡状态的是
A.v逆(M)=2v正(N) B.M与N的物质的量之比保持不变
C.混合气体密度保持不变 D.容器中压强保持不变
(6)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为
您最近一年使用:0次



