名校
解题方法
1 . 回答下列问题
(1)0.5 mol水中含有___________ 个氢原子。
(2)9g水与___________ g硫酸所含的分子数相等。
(3)欲配置500mL 0.6mol/L的NaOH溶液,需3mol/L的NaOH溶液___________ mL。
(4)标准状况下,和4mol 含有相同氢原子数的
含有相同氢原子数的 的体积为
的体积为___________ 。
(5)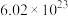 个
个 与
与___________ mol  质量相等。
质量相等。
(1)0.5 mol水中含有
(2)9g水与
(3)欲配置500mL 0.6mol/L的NaOH溶液,需3mol/L的NaOH溶液
(4)标准状况下,和4mol
 含有相同氢原子数的
含有相同氢原子数的 的体积为
的体积为(5)
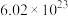 个
个 与
与 质量相等。
质量相等。
您最近一年使用:0次
名校
解题方法
2 . 移取20.00 两种一元弱酸
两种一元弱酸 和
和 的混合溶液,滴加0.1
的混合溶液,滴加0.1 的
的 至反应终点,消耗25
至反应终点,消耗25 。再取相同的上述溶液,加入50
。再取相同的上述溶液,加入50 ,0.02
,0.02
 的强碱性溶液,待其反应完成后,将溶液酸化,加入30
的强碱性溶液,待其反应完成后,将溶液酸化,加入30 0.2
0.2
 溶液,将剩余的
溶液,将剩余的 和
和 歧化生成的
歧化生成的 和
和 全部还原至
全部还原至 ,剩余的
,剩余的 溶液用上述
溶液用上述 溶液在酸性条件下反应至终点消耗18.5
溶液在酸性条件下反应至终点消耗18.5 。
。
已知:
① 在强碱性条件下还原产物为
在强碱性条件下还原产物为 ;
; 在酸性条件发生歧化反应;
在酸性条件发生歧化反应;
② 具有还原性,酸性条件下被氧化为
具有还原性,酸性条件下被氧化为 ,
, 不能被酸性高锰酸钾氧化
不能被酸性高锰酸钾氧化
(1)加入 的强碱性溶液发生的有电子转移的离子反应方程式为
的强碱性溶液发生的有电子转移的离子反应方程式为_______ 。
(2)酸化后 歧化发生离子反应方程式为
歧化发生离子反应方程式为_______ 。
(3)加入 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为_______ 。
(4)则溶液中的 的浓度为
的浓度为_______ ; 的浓度为
的浓度为_______ 。
(5)若溶液酸化后将 过滤除掉,其它操作不变,则测得的
过滤除掉,其它操作不变,则测得的 浓度将
浓度将_______ (填“偏大”、“偏小”或“不变”)。
 两种一元弱酸
两种一元弱酸 和
和 的混合溶液,滴加0.1
的混合溶液,滴加0.1 的
的 至反应终点,消耗25
至反应终点,消耗25 。再取相同的上述溶液,加入50
。再取相同的上述溶液,加入50 ,0.02
,0.02
 的强碱性溶液,待其反应完成后,将溶液酸化,加入30
的强碱性溶液,待其反应完成后,将溶液酸化,加入30 0.2
0.2
 溶液,将剩余的
溶液,将剩余的 和
和 歧化生成的
歧化生成的 和
和 全部还原至
全部还原至 ,剩余的
,剩余的 溶液用上述
溶液用上述 溶液在酸性条件下反应至终点消耗18.5
溶液在酸性条件下反应至终点消耗18.5 。
。已知:
①
 在强碱性条件下还原产物为
在强碱性条件下还原产物为 ;
; 在酸性条件发生歧化反应;
在酸性条件发生歧化反应;②
 具有还原性,酸性条件下被氧化为
具有还原性,酸性条件下被氧化为 ,
, 不能被酸性高锰酸钾氧化
不能被酸性高锰酸钾氧化(1)加入
 的强碱性溶液发生的有电子转移的离子反应方程式为
的强碱性溶液发生的有电子转移的离子反应方程式为(2)酸化后
 歧化发生离子反应方程式为
歧化发生离子反应方程式为(3)加入
 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为(4)则溶液中的
 的浓度为
的浓度为 的浓度为
的浓度为(5)若溶液酸化后将
 过滤除掉,其它操作不变,则测得的
过滤除掉,其它操作不变,则测得的 浓度将
浓度将
您最近一年使用:0次
名校
解题方法
3 . 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
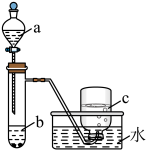
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4g铜。_______ 。硝酸所表现出的化学性质主要有_______
②待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是_______ g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用0.1mol Fe和含有0.3mol 的稀硝酸进行实验,若两种物质恰好反应都无剩余,且
的稀硝酸进行实验,若两种物质恰好反应都无剩余,且 只被还原成NO。则
只被还原成NO。则
①反应结束后的溶液中 、
、 的物质的量之比
的物质的量之比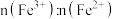 为
为_______ 。
②标准状况下,计算生成NO气体的体积_______ 。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4g铜。
②待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用0.1mol Fe和含有0.3mol
 的稀硝酸进行实验,若两种物质恰好反应都无剩余,且
的稀硝酸进行实验,若两种物质恰好反应都无剩余,且 只被还原成NO。则
只被还原成NO。则①反应结束后的溶液中
 、
、 的物质的量之比
的物质的量之比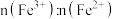 为
为②标准状况下,计算生成NO气体的体积
您最近一年使用:0次
2023-04-19更新
|
172次组卷
|
2卷引用:吉林省长春市第八中学2022-2023学年高一下学期4月考试化学试题
解题方法
4 . 铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出 的金属,就铝的这一特殊性质,回答下列问题:
的金属,就铝的这一特殊性质,回答下列问题:
(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得 的体积之比是
的体积之比是___________ 。
(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸和氢氧化钠溶液中,产生 的体积之比是
的体积之比是___________ 。
(3)足量的两份铝分别投入到等体积、一定物质的量浓度的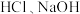 溶液中,二者产生的
溶液中,二者产生的 相等,则
相等,则 和
和 的物质的量浓度之比是
的物质的量浓度之比是___________ 。
(4)甲、乙两烧杯中各盛有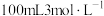 的盐酸和
的盐酸和 溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为
溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为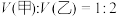 ,则加入铝粉的质量为___________(填字母)。
,则加入铝粉的质量为___________(填字母)。
 的金属,就铝的这一特殊性质,回答下列问题:
的金属,就铝的这一特殊性质,回答下列问题:(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得
 的体积之比是
的体积之比是(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸和氢氧化钠溶液中,产生
 的体积之比是
的体积之比是(3)足量的两份铝分别投入到等体积、一定物质的量浓度的
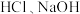 溶液中,二者产生的
溶液中,二者产生的 相等,则
相等,则 和
和 的物质的量浓度之比是
的物质的量浓度之比是(4)甲、乙两烧杯中各盛有
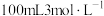 的盐酸和
的盐酸和 溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为
溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为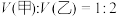 ,则加入铝粉的质量为___________(填字母)。
,则加入铝粉的质量为___________(填字母)。A. | B.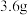 | C.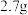 | D.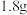 |
您最近一年使用:0次
2023-02-09更新
|
238次组卷
|
10卷引用:2016-2017学年吉林长春外国语学校高一上期末理化学卷
2016-2017学年吉林长春外国语学校高一上期末理化学卷(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第2讲 镁、铝及其重要化合物【教学案】(已下线)专题3.2 铝及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)3.2.2 物质的量在化学方程式计算中的应用(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)(已下线)考点15 铝及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第08讲 金属材料(练)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省虎林市高级中学2022-2023学年高三上学期第一次月考化学试题黑龙江省齐齐哈尔市三立高级中学2022-2023学年高三上学期期中考试化学试题第三章 金属及其化合物 第15讲 金属材料 金属冶炼(已下线)考点15 铝及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
5 . 将一定量的CO2气体通入2 L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发)。

(1)O点溶液中所含溶质的化学式为_______ ,
(2)O到a点发生反应的离子方程式:_______ 。
(3)标准状况下通入CO2气体的体积为_______ L, NaOH溶液的物质的量浓度为_______ mol·L-1。

(1)O点溶液中所含溶质的化学式为
(2)O到a点发生反应的离子方程式:
(3)标准状况下通入CO2气体的体积为
您最近一年使用:0次
名校
6 . 低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。结合下列有关图示和所学知识回答:
(1)用 催化加氢可以制取乙烯:
催化加氢可以制取乙烯: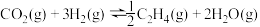 。若该反应体系的能量随反应过程变化关系如图所示,则该反应的
。若该反应体系的能量随反应过程变化关系如图所示,则该反应的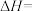
_______ (用含a、b的式子表示)。又知:相关化学键的键能如下表所示,实验测得上述反应的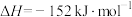 ,则表中的x=
,则表中的x=_______ 。
注:乙烯结构如图: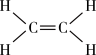
(2)用 表示阿伏加德罗常数,在
表示阿伏加德罗常数,在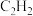 (气态)完全燃烧生成
(气态)完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有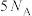 个电子转移时,放出
个电子转移时,放出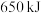 的热量。其燃烧热的热化学方程式为
的热量。其燃烧热的热化学方程式为_______ 。
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
①科学家提出由 制取C的太阳能工艺如图所示。
制取C的太阳能工艺如图所示。
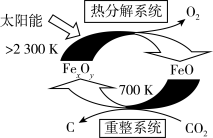
已知“重整系统”发生的反应中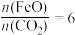 ,则
,则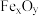 的化学式为
的化学式为_______ 。“热分解系统”中每分解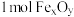 ,转移电子的物质的量为
,转移电子的物质的量为_______ mol。
②工业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知: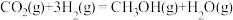
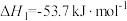 ,
,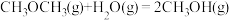
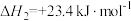 ,则
,则
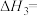
_______  。
。
(1)用
 催化加氢可以制取乙烯:
催化加氢可以制取乙烯: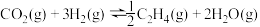 。若该反应体系的能量随反应过程变化关系如图所示,则该反应的
。若该反应体系的能量随反应过程变化关系如图所示,则该反应的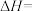
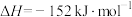 ,则表中的x=
,则表中的x=
| 化学键 | 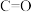 | 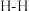 | 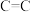 | 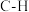 | 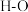 |
键能/ | 803 | 436 | x | 414 | 464 |
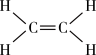
(2)用
 表示阿伏加德罗常数,在
表示阿伏加德罗常数,在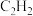 (气态)完全燃烧生成
(气态)完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有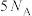 个电子转移时,放出
个电子转移时,放出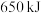 的热量。其燃烧热的热化学方程式为
的热量。其燃烧热的热化学方程式为(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
①科学家提出由
 制取C的太阳能工艺如图所示。
制取C的太阳能工艺如图所示。
已知“重整系统”发生的反应中
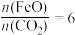 ,则
,则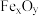 的化学式为
的化学式为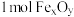 ,转移电子的物质的量为
,转移电子的物质的量为②工业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知: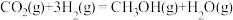
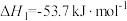 ,
,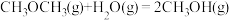
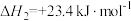 ,则
,则
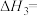
 。
。
您最近一年使用:0次
2022-05-20更新
|
295次组卷
|
2卷引用:吉林省长春吉大附中实验学校2021-2022学年高一下学期线上测试化学试题
名校
7 . 请回答下列问题:
(1)标准状况下O2、SO2、CH4的密度之比是___________ 。
(2)取一定量的Na2S样品,此样品中含有Na+ 1.2mol,则该样品的质量是___________ 。
(3)等质量的氧气和臭氧所含原子数之比为___________ ;分子的物质的量之比为___________ 。
(4)标准状况下33.6L CO2的质量是___________ 。
(1)标准状况下O2、SO2、CH4的密度之比是
(2)取一定量的Na2S样品,此样品中含有Na+ 1.2mol,则该样品的质量是
(3)等质量的氧气和臭氧所含原子数之比为
(4)标准状况下33.6L CO2的质量是
您最近一年使用:0次
名校
8 . 17gNH3共有___________ mol原子;同温同压下,同体积的NH3和H2S气体的质量比为___________ ;在标准状况下,35.5g氯气的体积是___________ L,将其与氢气完全化合,将生成的气体制成1L溶液,溶质的物质的量浓度是___________ mol·L-1。
您最近一年使用:0次
名校
9 . 回答下列问题:
(1)在0.5mol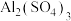 中,所含硫酸根离子个数共有
中,所含硫酸根离子个数共有___________ 。
(2)标准状况下,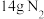 所占有的体积为
所占有的体积为___________ 。
(3)标准状况下,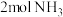 与
与___________ 
 的体积相等。
的体积相等。
(4) 和
和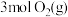 的质量之比
的质量之比___________ ,体积之比为___________ 。
(5)两份质量相等的 和
和 ,物质的量之比
,物质的量之比___________ ,所含氧原子数目之比为___________
(1)在0.5mol
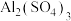 中,所含硫酸根离子个数共有
中,所含硫酸根离子个数共有(2)标准状况下,
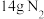 所占有的体积为
所占有的体积为(3)标准状况下,
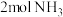 与
与
 的体积相等。
的体积相等。(4)
 和
和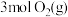 的质量之比
的质量之比(5)两份质量相等的
 和
和 ,物质的量之比
,物质的量之比
您最近一年使用:0次
10 . 一定量的Fe 、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,实验中收集到的NO气体(唯一还原产物)的体积与所得到剩余固体质量记录如表(所有的气体的体积均在标准状况下测定)
(1)该实验中所用的硝酸的物质的量浓度为_______ mol/L
(2)第1次实验后剩余固体的成分为_______ ,第2次实验后剩余固体的成分为_______ (以上两空均填化学式)
(3)V=_______ L
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| HNO3溶液的体积(mL) | 100 | 200 | 300 | 400 | 500 |
| 剩余固体的质量(g) | 17.2 | 8 | 0 | 0 | 0 |
| 气体的体积(L) | 2.24 | 4.48 | V | 7.84 | 7.84 |
(1)该实验中所用的硝酸的物质的量浓度为
(2)第1次实验后剩余固体的成分为
(3)V=
您最近一年使用:0次
2021-07-30更新
|
594次组卷
|
2卷引用:吉林省长春市十一高中2020-2021学年高二下学期第三学程考试化学试题



