1 . 计算填空:
(1)_______ molH2O中所含有的氧原子数与1.5 molCO2的氧原子数相同。
(2)质量为9.8g的H2SO4物质的量是_______ 。
(3)1.204×1024个H2的物质的量是_______ 。
(4)_______ g H2O与34g NH3含有相同的氢原子数。
(5)相同物质的量的CO2和O2,其分子数之比为_______ ,原子数之比为_______ ,氧原子数之比为_______ ;在2molNa2SO4溶液中Na+的物质的量为_______ mol
(6)1molCO2 中所含的质子的数目_______
(1)
(2)质量为9.8g的H2SO4物质的量是
(3)1.204×1024个H2的物质的量是
(4)
(5)相同物质的量的CO2和O2,其分子数之比为
(6)1molCO2 中所含的质子的数目
您最近一年使用:0次
2 . (1)某温度(t℃)时,水的KW=10-13,则该温度(填大于、等于或小于)______ 25℃,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
①若所得混合溶液为中性,则a:b=_________ ;
②若所得混合溶液pH=2,则a:b=__________ 。
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是___________
①若所得混合溶液为中性,则a:b=
②若所得混合溶液pH=2,则a:b=
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是
您最近一年使用:0次
3 . 标准状况下,0.5molCO2的质量是___ ,在标准状况下的体积是___ 。
您最近一年使用:0次
名校
4 . 在标准状况下,0.5molN2和1molO2的混合气体的体积约是___ 。
您最近一年使用:0次
名校
解题方法
5 . (1)在400℃时,将一定量的SO2和14molO2压入一个盛有催化剂的10L密闭容器中进行反应:2SO2+O2 2SO3,已知2min后,容器中剩余2molSO2和12molO2,则:
2SO3,已知2min后,容器中剩余2molSO2和12molO2,则:
①生成了__ molSO3,SO2的起始物质的量浓度是__ 。
②2min内平均反应速率:v(O2)=__ 。
(2)某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。__ ;
②由图中所给数据进行分析,该反应的化学方程式为___ ;
③若三种物质都是气体,则平衡时Y所占体积的百分比为__ 。
 2SO3,已知2min后,容器中剩余2molSO2和12molO2,则:
2SO3,已知2min后,容器中剩余2molSO2和12molO2,则:①生成了
②2min内平均反应速率:v(O2)=
(2)某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
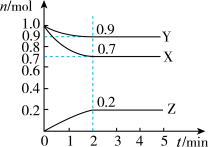
②由图中所给数据进行分析,该反应的化学方程式为
③若三种物质都是气体,则平衡时Y所占体积的百分比为
您最近一年使用:0次
2019-12-12更新
|
494次组卷
|
4卷引用:吉林省延边朝鲜族自治州汪清县第四中学2019-2020学年高二上学期第一次阶段考试化学试题
6 . (1)在标准状况下,1.7g氨气所占的体积为_______ L,它与标准状况下______ L硫化氢含有相同数目的氢原子。
(2)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_______ ,R的相对原子质量为_________ 。
(3)已知CO、CO2的混合气体质量共16.0g,标准状况下体积为8.96L,则可推知该混合气体中含CO___ g,所含CO2在标准状况下的体积为_______ L。
(4)同温同压下,SO2与Cl2的密度之比为______ ;若质量相同,两种气体的体积比为_________ 。
(2)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为
(3)已知CO、CO2的混合气体质量共16.0g,标准状况下体积为8.96L,则可推知该混合气体中含CO
(4)同温同压下,SO2与Cl2的密度之比为
您最近一年使用:0次
解题方法
7 . (1)1 mol CO2中含有________ mol C和________ mol O;
(2)1.80 mol CO2中含有________ 个CO2分子,________ 个C原子,________ 个O原子;
(3)3.60 mol CO2中所含CO2分子数与________ 个H2O分子数目相等,8.40×1026个O3分子的物质的量是________ 。
(2)1.80 mol CO2中含有
(3)3.60 mol CO2中所含CO2分子数与
您最近一年使用:0次
名校
8 . 某市售盐酸试剂瓶标签上的部分信息如下:
盐酸
分子式:HCl
相对分子质量:36.5
密度约1.18 g·cm-3
HCl的质量分数:36.5%
(1)该盐酸的物质的量浓度为_______。
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中c(HCl)等于________mol/L
(3)取稀释后的适量盐酸与足量的锌粒作用,生成0.25 mol氢气,在标准状况下气体的体积是 L。
盐酸
分子式:HCl
相对分子质量:36.5
密度约1.18 g·cm-3
HCl的质量分数:36.5%
(1)该盐酸的物质的量浓度为_______。
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中c(HCl)等于________mol/L
(3)取稀释后的适量盐酸与足量的锌粒作用,生成0.25 mol氢气,在标准状况下气体的体积是 L。
您最近一年使用:0次
2019-11-28更新
|
52次组卷
|
3卷引用:吉林省汪清县第六中学2019-2020学年高一上学期期中考试化学试题
名校
解题方法
9 . 近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)制氢的热化学方程式为_____________ 。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。①H2S的平衡转化率
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。①H2S的平衡转化率 =
=____ %,反应平衡常数K=_____ 。
(3)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,已知25℃,NH3·H2O的Kb=1.8×10−5,H2SO3的Ka1=1.3×10−2,Ka2=6.2×10−8。若氨水的浓度为2.0 mol·L−1,溶液中的c(OH−)=________ mol·L−1。将SO2通入该氨水中,当c(OH−)降至1.0×10−7 mol·L−1时,溶液中的c( )/c(
)/c(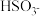 )=
)=___________________ 。
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)制氢的热化学方程式为
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。①H2S的平衡转化率
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。①H2S的平衡转化率 =
=(3)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,已知25℃,NH3·H2O的Kb=1.8×10−5,H2SO3的Ka1=1.3×10−2,Ka2=6.2×10−8。若氨水的浓度为2.0 mol·L−1,溶液中的c(OH−)=
 )/c(
)/c(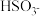 )=
)=
您最近一年使用:0次
10 . 7.2 g H2O所含有的质子数与多少克H2SO4所含的氧原子数相等,它们所含氧原子数之比是多少,氢原子数之比是多少。(要计算过程)____________
您最近一年使用:0次



