名校
解题方法
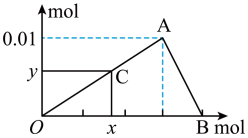
1 . 将3 mol/L氢氧化钠溶液滴入到25 mL一定浓度的氯化铝溶液中,如图是整个过程的数学分析曲线,其中横轴表示加入 的物质的量,纵轴表示产生的沉淀物质的量。图中OA曲线表示的离子反应是
的物质的量,纵轴表示产生的沉淀物质的量。图中OA曲线表示的离子反应是___________ ,由此可得A点的坐标为___________ ;AB曲线表示的离子反应是___________ ,由此可得B点的坐标为___________ 。由上述分析可求氯化铝溶液中 离子的浓度为
离子的浓度为___________ 。
 的物质的量,纵轴表示产生的沉淀物质的量。图中OA曲线表示的离子反应是
的物质的量,纵轴表示产生的沉淀物质的量。图中OA曲线表示的离子反应是 离子的浓度为
离子的浓度为
您最近一年使用:0次
名校
2 . 将0.050mol (g)和0.030mol
(g)和0.030mol (g)放入容积为1.0L的密闭容器中,在一定条件下发生反应,5.0min达到平衡,测得
(g)放入容积为1.0L的密闭容器中,在一定条件下发生反应,5.0min达到平衡,测得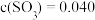 mol/L。则该条件下反应
mol/L。则该条件下反应 的转化率为
的转化率为___________ %【转化率=(发生反应的 的物质的量/原有的
的物质的量/原有的 的物质的量)×100%】,这段时间内
的物质的量)×100%】,这段时间内 的平均反应速率为
的平均反应速率为___________ 。
 (g)和0.030mol
(g)和0.030mol (g)放入容积为1.0L的密闭容器中,在一定条件下发生反应,5.0min达到平衡,测得
(g)放入容积为1.0L的密闭容器中,在一定条件下发生反应,5.0min达到平衡,测得 mol/L。则该条件下反应
mol/L。则该条件下反应 的转化率为
的转化率为 的物质的量/原有的
的物质的量/原有的 的物质的量)×100%】,这段时间内
的物质的量)×100%】,这段时间内 的平均反应速率为
的平均反应速率为
您最近一年使用:0次
名校
3 . 在容器体积可变的密闭容器中,反应N2(g)+3H2(g)  2NH3(g)在一定条件下达到平衡。完成下列填空:
2NH3(g)在一定条件下达到平衡。完成下列填空:
(1)若该反应经过2秒钟后达到平衡,NH3的浓度增加了0.6mol/L,在此期间,正反应速率v(H2)=的值为_______。
(2)在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正_______ (选填“增大”、“减小”,下同),v逆_______ ,平衡向_______ 方向移动(选填“正反应”、“逆反应”)。
(3)在其他条件不变的情况下,降低温度平衡向正反应方向移动,则正反应为_______ 反应(选填“吸热”、“放热”)。
(4)如图为反应速率(v)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是_______ (填写编号)。
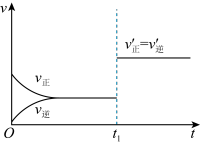
a. 增大N2的浓度 b. 扩大容器体积
c. 加入催化剂 d. 升高温度
改变条件后,平衡混合物中NH3的百分含量_______ (选填“增大”、“减小”、“不变”)。
(5)若达到平衡时,n(N2):n(H2):n(NH3)=2:2:1,保持温度不变,以2:2:1的物质的量之比再充入N2、H2、NH3,则_______。
 2NH3(g)在一定条件下达到平衡。完成下列填空:
2NH3(g)在一定条件下达到平衡。完成下列填空:(1)若该反应经过2秒钟后达到平衡,NH3的浓度增加了0.6mol/L,在此期间,正反应速率v(H2)=的值为_______。
| A.0.6mol/(L·s) | B.0.45mol/(L·s) | C.0.3mol/(L·s) | D.0.2mol/(L·s) |
(3)在其他条件不变的情况下,降低温度平衡向正反应方向移动,则正反应为
(4)如图为反应速率(v)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是

a. 增大N2的浓度 b. 扩大容器体积
c. 加入催化剂 d. 升高温度
改变条件后,平衡混合物中NH3的百分含量
(5)若达到平衡时,n(N2):n(H2):n(NH3)=2:2:1,保持温度不变,以2:2:1的物质的量之比再充入N2、H2、NH3,则_______。
| A.平衡向正反应方向移动 | B.平衡不移动 |
| C.平衡时,NH3的体积分数增大 | D.平衡时,NH3的体积分数可能减小 |
您最近一年使用:0次
2010·上海普陀·二模
4 . 钾元素可以与氧元素在不同条件下生成K2O2、KO2和KO3,如: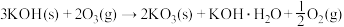
(1)KOH与O3反应,反应前后气体体积减小67.2L(S.T.P.),则生成KO3__________ g。
(2)将上述生成的混和物用液氨冷却结晶,可得到KO3晶体。它会缓慢分解为KO2和O2; .已知分解后残留固体中含氧的质量分数为0.5063,则KO3的分解百分率为
.已知分解后残留固体中含氧的质量分数为0.5063,则KO3的分解百分率为_____ 。(保留两位小数)
(3)已知某样品中含有K2O2、KO2和KO3中的两种,把71.1g该样品加入过量的Al2(SO4)3溶液中,产生白色沉淀23.4g。
①该样品中钾原子与氧原子个数的最简整数比为_______ 。(写出计算过程)
②写出可能存在的组合中两种化合物的物质的量之比_________ 。
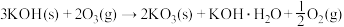
(1)KOH与O3反应,反应前后气体体积减小67.2L(S.T.P.),则生成KO3
(2)将上述生成的混和物用液氨冷却结晶,可得到KO3晶体。它会缓慢分解为KO2和O2;
 .已知分解后残留固体中含氧的质量分数为0.5063,则KO3的分解百分率为
.已知分解后残留固体中含氧的质量分数为0.5063,则KO3的分解百分率为(3)已知某样品中含有K2O2、KO2和KO3中的两种,把71.1g该样品加入过量的Al2(SO4)3溶液中,产生白色沉淀23.4g。
①该样品中钾原子与氧原子个数的最简整数比为
②写出可能存在的组合中两种化合物的物质的量之比
您最近一年使用:0次
2010·上海普陀·二模
5 . 稀有气体在一定条件下也能与某些物质反应,如:Xe与F2在一定条件下可以形成XeF4、XeF6。现有标准状况下的XeF4、XeF6的混合气体1L,密度为10.26g/L。
(1)混合气体的平均摩尔质量为_______ 。(保留两位小数,下同)
(2)混合气体中XeF4的质量为_________ g。
(3)氟化氙都是强氧化剂,如在水中都能将Cl—氧化成Cl2,并生成Xe(g)和HF。将上述标准状况下的混合气体1L通入含过量Cl—的溶液中,能生成Cl2_____ mol。
(1)混合气体的平均摩尔质量为
(2)混合气体中XeF4的质量为
(3)氟化氙都是强氧化剂,如在水中都能将Cl—氧化成Cl2,并生成Xe(g)和HF。将上述标准状况下的混合气体1L通入含过量Cl—的溶液中,能生成Cl2
您最近一年使用:0次
2011·上海普陀·零模
6 . 稀有气体在一定条件下能与某些物质反应,如:Xe与F2在一定条件下可以形成XeF4 、XeF6。现有XeF4 和XeF6的混合气体1.12L(标准状况),密度为10.26g/L。
(1)混合气体的平均摩尔质量为:________________ 。(计算结果保留两位小数,下同)
(2)混合气体中XeF4的质量为:___________________ 。
(3)氟化氙都是强氧化剂,在水中能将Cl- 氧化成Cl2,并生成Xe和HF。将标准状况下的上述混合气体1.12L通入含过量Cl- 的溶液中,能生成Cl2_____________ L(标准状况)。
(1)混合气体的平均摩尔质量为:
(2)混合气体中XeF4的质量为:
(3)氟化氙都是强氧化剂,在水中能将Cl- 氧化成Cl2,并生成Xe和HF。将标准状况下的上述混合气体1.12L通入含过量Cl- 的溶液中,能生成Cl2
您最近一年使用:0次
10-11高三上·上海普陀·期末
7 . 氢气还原氧化铜得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生反应,生成Cu2+和单质铜。
(1)现有8g氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是________________ ;
(2)若将6.8g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体________ g;
(3)若将6.8g上述混合物与足量的浓硝酸充分反应,把得到的溶液小心蒸发浓缩,把析出的晶体过滤,低温干燥,得晶体19.36g。经分析,原溶液中的Cu2+有20%残留在母液中。求所得晶体的化学式__________ (要求:写出本小题的计算过程)。
(1)现有8g氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是
(2)若将6.8g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体
(3)若将6.8g上述混合物与足量的浓硝酸充分反应,把得到的溶液小心蒸发浓缩,把析出的晶体过滤,低温干燥,得晶体19.36g。经分析,原溶液中的Cu2+有20%残留在母液中。求所得晶体的化学式
您最近一年使用:0次
2011·上海普陀·零模
8 . 钴(Co)化合物对化学键的研究有重要的作用。为测定某钴化合物[Co(NH3)x Cly]Clz的组成,进行了如下实验:
(1)称取样品0.5010 g ,加入过量NaOH溶液,煮沸,蒸出所有的NH3,冷却,得到A。产生的NH3用50.00 mL 0.5000 mol·L-1盐酸完全吸收并用蒸馏水定容到100 mL,得溶液B。取B溶液20.00 mL,用0.1000 mol·L-1 NaOH滴定,消耗NaOH溶液30.00 mL。由此可知蒸出的NH3的物质的量为_______________ mol,[Co(NH3)x Cly]Clz中氮元素的质量分数为:_____ 。(用小数表示,保留两位小数)
(2)向A中加入过量的KI固体,振荡,盐酸酸化后置于暗处,发生反应:Com+ + I- → Co2++ I2(未配平),反应完成后,稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000 mol·L-1 Na2S2O3溶液20.00 mL。反应方程式为:I2 + 2Na2S2O3 = 2NaI + Na2S4O6。Com+的物质的量为:__________________ mol(用含m的代数式表示)。
(3)另称取样品0.2505 g,溶于水,以0.1000 mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00mL。反应方程式为:[Co(NH3)x Cly]Clz + zAgNO3=[Co(NH3)x Cly](NO3)z + zAgCl↓
计算:①化合物中钴元素的化合价。________
②该钴化合物的化学式。_______
(1)称取样品0.5010 g ,加入过量NaOH溶液,煮沸,蒸出所有的NH3,冷却,得到A。产生的NH3用50.00 mL 0.5000 mol·L-1盐酸完全吸收并用蒸馏水定容到100 mL,得溶液B。取B溶液20.00 mL,用0.1000 mol·L-1 NaOH滴定,消耗NaOH溶液30.00 mL。由此可知蒸出的NH3的物质的量为
(2)向A中加入过量的KI固体,振荡,盐酸酸化后置于暗处,发生反应:Com+ + I- → Co2++ I2(未配平),反应完成后,稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000 mol·L-1 Na2S2O3溶液20.00 mL。反应方程式为:I2 + 2Na2S2O3 = 2NaI + Na2S4O6。Com+的物质的量为:
(3)另称取样品0.2505 g,溶于水,以0.1000 mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00mL。反应方程式为:[Co(NH3)x Cly]Clz + zAgNO3=[Co(NH3)x Cly](NO3)z + zAgCl↓
计算:①化合物中钴元素的化合价。
②该钴化合物的化学式。
您最近一年使用:0次
解题方法
9 . 硫酸是一种重要的化工原料。接触法生产的硫酸产品有98%的硫酸、20%的发烟硫酸(H2SO4和SO3的混合物,其中SO3的质量分数为0.2)。
完成下列计算:
(1)若不计生产过程的损耗,__________ m3 SO2(折合成标准状况)经充分转化、吸收,可产出1吨 98%的硫酸(密度为1.84g/mL)。若98%的硫酸可表示为SO3• H2O,20%的发烟硫酸可表示为SO3•aH2O,则a的值为
H2O,20%的发烟硫酸可表示为SO3•aH2O,则a的值为 ___________ (用分数表示)。
(2)铝和铝的化合物在社会生产和人类生活中也有着重要的作用。现有甲、乙两瓶无色溶液,已知它们可能是Na[Al(OH)4]溶液和H2SO4溶液。现经实验获得如下数据:
(已知:2Na[Al(OH)4]+H2SO4→2Al(OH)3↓+Na2SO4+2H2O)
请通过必要的计算推断过程回答:乙溶液中的溶质是什么________ ?其物质的量浓度为多少________ ?
完成下列计算:
(1)若不计生产过程的损耗,
 H2O,20%的发烟硫酸可表示为SO3•aH2O,则a的值为
H2O,20%的发烟硫酸可表示为SO3•aH2O,则a的值为 (2)铝和铝的化合物在社会生产和人类生活中也有着重要的作用。现有甲、乙两瓶无色溶液,已知它们可能是Na[Al(OH)4]溶液和H2SO4溶液。现经实验获得如下数据:
(已知:2Na[Al(OH)4]+H2SO4→2Al(OH)3↓+Na2SO4+2H2O)
| 组别 | 甲(mL) | 乙(mL) | 沉淀的物质的量(mol) |
| ① | 140 | 10 | 0.02 |
| ② | 10 | 140 | 0.02 |
| ③ | 20 | 560 | 0.04 |
请通过必要的计算推断过程回答:乙溶液中的溶质是什么
您最近一年使用:0次
14-15高三上·上海宝山·阶段练习
名校
解题方法
10 . 某化工厂以甲烷为原料合成甲醇的反应为:(所有气体体积均已折算为标准状况)
反应器①中: CH4(g)+H2O(g)→CO(g)+3H2(g)
反应器②中: CO(g)+2H2(g)→CH3OH(g)
(该反应CO的转化率为 )
)
(1)在反应器①中通入体积为672m3的甲烷和足量的水蒸气,充分反应后通入反应器②,则反应剩余物中n(CO)=________________ ,n(H2)=__________________ 。
(2)为增大产量,该厂在原工艺的基础上,将下列反应运用于生产甲醇原料气:反应器③中2CH4(g)+O2(g)→2CO(g)+4H2(g),若新工艺中充入反应器 ①的甲烷体积为a,水蒸气足量,反应器③的甲烷体积为b,最终反应产物中:V(CO)︰V(H2) = 1︰3。
①求充入反应器①③的甲烷的体积比a︰b=________ ;
②若最终反应剩余物中有N2,且V ( N2) = V(CO),则该空气中氧气的体积分数为多少?(要求:写出本小题的计算过程)________________
反应器①中: CH4(g)+H2O(g)→CO(g)+3H2(g)
反应器②中: CO(g)+2H2(g)→CH3OH(g)
(该反应CO的转化率为
 )
)(1)在反应器①中通入体积为672m3的甲烷和足量的水蒸气,充分反应后通入反应器②,则反应剩余物中n(CO)=
(2)为增大产量,该厂在原工艺的基础上,将下列反应运用于生产甲醇原料气:反应器③中2CH4(g)+O2(g)→2CO(g)+4H2(g),若新工艺中充入反应器 ①的甲烷体积为a,水蒸气足量,反应器③的甲烷体积为b,最终反应产物中:V(CO)︰V(H2) = 1︰3。
①求充入反应器①③的甲烷的体积比a︰b=
②若最终反应剩余物中有N2,且V ( N2) = V(CO),则该空气中氧气的体积分数为多少?(要求:写出本小题的计算过程)
您最近一年使用:0次



