名校
解题方法
1 . 已知酸度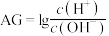
 常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
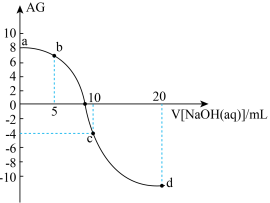
(1)a 点溶液的pH为___________ ,常温下 Kₐ(HA)=___________ 。
(2)若升高温度,0.1 mol∙L−1NaOH 溶液的酸度(AG)将___________ (填“变大”、“变小”或“不变”)。
(3)c 点加入 NaOH 溶液的体积___________ (填“>”、“<”或“=”)10mL。
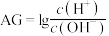
 常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
(1)a 点溶液的pH为
(2)若升高温度,0.1 mol∙L−1NaOH 溶液的酸度(AG)将
(3)c 点加入 NaOH 溶液的体积
您最近一年使用:0次
名校
解题方法
2 . 完成下列问题
(1)标准状况下,6.72LC2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7kJ热量,请写出表示C2H2燃烧热的热化学方程式:___________ 。
(2)已知:C(石墨,s)+O2(g)=CO2(g) ΔH1=—akJ·mol−1
H2(g)+ O2(g)=H2O(l) ΔH2=—bkJ·mol−1
O2(g)=H2O(l) ΔH2=—bkJ·mol−1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3=—ckJ·mol−1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的ΔH为___________ kJ·mol-1(用含a、b、c的式子表示)。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示。
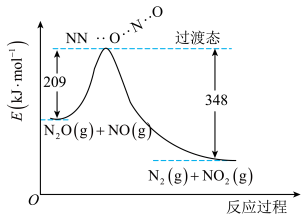
则反应过程中,每生成2molN2理论上放出的热量为___________ 。
(1)标准状况下,6.72LC2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7kJ热量,请写出表示C2H2燃烧热的热化学方程式:
(2)已知:C(石墨,s)+O2(g)=CO2(g) ΔH1=—akJ·mol−1
H2(g)+
 O2(g)=H2O(l) ΔH2=—bkJ·mol−1
O2(g)=H2O(l) ΔH2=—bkJ·mol−1CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3=—ckJ·mol−1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的ΔH为
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示。

则反应过程中,每生成2molN2理论上放出的热量为
您最近一年使用:0次
名校
3 . 通过计算回答以下问题:
(1)已知标准状况下,双原子分子气体A的密度为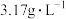 ,则气体A的相对分子质量为
,则气体A的相对分子质量为_________ ,可能是_________ 气体(用化学式表示)。
(2)标准状况下,1.92g某气体的体积为672mL,则此气体的摩尔质量为_________ 。
(3)在一定条件下, 完全分解生成
完全分解生成 、
、 、
、 ,按要求填空。
,按要求填空。
①若所得混合气体对 的相对密度为d,则混合气体的物质的量为
的相对密度为d,则混合气体的物质的量为_________ 。 的摩尔质量为
的摩尔质量为_________ (用含m、d的代数式表示)。
②若所得混合气体的密度折合成标准状况为 ,则混合气体的平均摩尔质量为
,则混合气体的平均摩尔质量为_________ (用含 的代数式表示)。
的代数式表示)。
③若在该条件下,所得 、
、 、
、 的体积分数分别为
的体积分数分别为 、
、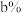 、
、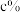 ,则混合气体的平均相对分子质量为
,则混合气体的平均相对分子质量为_________ (用含a、b、c的代数式表示)。
(4)在25℃、101kPa的条件下,等质量的 和A气体的体积之比为15:8,则A的摩尔质量为
和A气体的体积之比为15:8,则A的摩尔质量为_________ 。
(5)相同条件下,有两份 和
和 的体积比为
的体积比为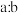 和质量比为
和质量比为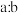 的混合气体,其平均相对分子质量分别
的混合气体,其平均相对分子质量分别_________ 和_________ 。
(1)已知标准状况下,双原子分子气体A的密度为
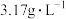 ,则气体A的相对分子质量为
,则气体A的相对分子质量为(2)标准状况下,1.92g某气体的体积为672mL,则此气体的摩尔质量为
(3)在一定条件下,
 完全分解生成
完全分解生成 、
、 、
、 ,按要求填空。
,按要求填空。①若所得混合气体对
 的相对密度为d,则混合气体的物质的量为
的相对密度为d,则混合气体的物质的量为 的摩尔质量为
的摩尔质量为②若所得混合气体的密度折合成标准状况为
 ,则混合气体的平均摩尔质量为
,则混合气体的平均摩尔质量为 的代数式表示)。
的代数式表示)。③若在该条件下,所得
 、
、 、
、 的体积分数分别为
的体积分数分别为 、
、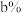 、
、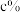 ,则混合气体的平均相对分子质量为
,则混合气体的平均相对分子质量为(4)在25℃、101kPa的条件下,等质量的
 和A气体的体积之比为15:8,则A的摩尔质量为
和A气体的体积之比为15:8,则A的摩尔质量为(5)相同条件下,有两份
 和
和 的体积比为
的体积比为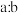 和质量比为
和质量比为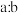 的混合气体,其平均相对分子质量分别
的混合气体,其平均相对分子质量分别
您最近一年使用:0次
2022-11-15更新
|
626次组卷
|
2卷引用:上海市控江中学2022-2023学年高一上学期期中考试化学试题
4 . 已知NH3和Cl2在常温下可快速反应生成氮气:2NH3+3Cl2=N2+6HCl。当NH3过量时,会发生反应NH3+HCl=NH4Cl,产生白烟,因此当Cl2和NH3比例不同时,产物有差异。
(1)若利用该反应处理含有氨气和氯气的尾气,用于制备盐酸,则Cl2和NH3的最佳比例为_________ 。该反应可用于检验化工生产中氯气是否泄漏。若氯气有少量泄漏,用氨气检验时有明显现象,此过程中发生反应的Cl2和NH3的体积比范围为_______ 。
(2)体积为1.12L,质量为3.335g的Cl2和N2的混合气体通过浓氨水后,体积变为0.672L(其中Cl2体积分数为50%)。两位同学想要根据这些数据计算被氧化的NH3的质量。下面是两位学生从不同角度解题时所列的第一步算式,请判断他们所列未知数X分别表示什么量,并填写在表格内:(单位没列出)
(3)有Cl2和N2的混合气体,其中N2的体积分数为x,将1L该混合气体与1L的氨气混合,讨论x取不同范围的数值时,所得气体体积y与x的关系式______ (所得气体体积均在相同状况下测定)
(1)若利用该反应处理含有氨气和氯气的尾气,用于制备盐酸,则Cl2和NH3的最佳比例为
(2)体积为1.12L,质量为3.335g的Cl2和N2的混合气体通过浓氨水后,体积变为0.672L(其中Cl2体积分数为50%)。两位同学想要根据这些数据计算被氧化的NH3的质量。下面是两位学生从不同角度解题时所列的第一步算式,请判断他们所列未知数X分别表示什么量,并填写在表格内:(单位没列出)
| 学生编号 | 所列第一步算式 | 未知数X表示的意义 |
| 甲 | 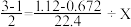 | |
| 乙 |  |
(3)有Cl2和N2的混合气体,其中N2的体积分数为x,将1L该混合气体与1L的氨气混合,讨论x取不同范围的数值时,所得气体体积y与x的关系式
您最近一年使用:0次
2020-12-03更新
|
652次组卷
|
2卷引用:上海市复旦大学附属中学2020-2021学年高一上学期期中考试化学试题
名校
解题方法
5 . 已知19.2g Cu与过量的200mL 6mol/L硝酸充分反应,反应结束后,除了产生Cu(NO3)2以外,还产生了NO与NO2两种气体共8.96L(标准状况下测定),请计算(忽略反应前后溶液体积的变化):
(1)反应中转移电子的物质的量为______ mol。
(2)反应产生的混合气体中,产生NO气体的体积为______ mL(标准状况下测定)。
(3)反应后,NO 的物质的量浓度为
的物质的量浓度为______ mol/L。
(1)反应中转移电子的物质的量为
(2)反应产生的混合气体中,产生NO气体的体积为
(3)反应后,NO
 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
2020-12-03更新
|
738次组卷
|
2卷引用:上海市复旦大学附属中学2020-2021学年高一上学期期中考试化学试题
名校
解题方法
6 . 氯气的实验室制法有多种,其中一种可以用重铬酸钾和浓盐酸制取。其变化可表述为:K2Cr2O7+14HCl (浓)=2KCl+2CrCl3+3Cl2 ↑+7H2O。
(1)请标出上述方程式的电子转移方向和数目__________ 。
(2)上述反应中被还原的元素为________ 。
(3)氧化产物与还原产物的物质的量之比为___________ 。
(4)浓盐酸在反应中显示出来的性质是________________ 。
(5)若有14.7g K2Cr2O7 发生上述反应,则转移的电子数为_____ 个, 产生的气体在标准状况下的体积为________ L。
(1)请标出上述方程式的电子转移方向和数目
(2)上述反应中被还原的元素为
(3)氧化产物与还原产物的物质的量之比为
(4)浓盐酸在反应中显示出来的性质是
(5)若有14.7g K2Cr2O7 发生上述反应,则转移的电子数为
您最近一年使用:0次
2020-10-22更新
|
237次组卷
|
2卷引用:上海市控江中学2019-2020学年高一上学期期中考试化学试题
名校
解题方法
7 . 电解26.8%的食盐水1500g,若食盐的利用率为87.3%,求:
(1)在标准状况下可制得Cl2多少升?___ (不考虑氯气溶解)
(2)电解液中氢氧化钠的质量百分比浓度为多少?___
(3)取一定量的氢气和氯气混合,点燃充分反应,所得混合物用100mL15.67%的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。求溶液中NaCl的物质的量浓度___ ,以及所取氢气和氯气的混合气体相对于同温同压下空气的相对密度,假设反应前后溶液体积不变,结果保留两位小数。___
(1)在标准状况下可制得Cl2多少升?
(2)电解液中氢氧化钠的质量百分比浓度为多少?
(3)取一定量的氢气和氯气混合,点燃充分反应,所得混合物用100mL15.67%的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。求溶液中NaCl的物质的量浓度
您最近一年使用:0次
2020-10-04更新
|
382次组卷
|
2卷引用:上海市复旦大学附属中学2019-2020学年高一上学期期中考试化学试题
解题方法
8 . Cl2在70℃的NaOH溶液中,能同时发生两个自身氧化还原(氧化剂和还原剂都是同一种物质)反应,反应的化学方程式为:
(1)产物中有NaClO:___ ;
(2)产物中有NaClO3___ ;
反应完全后测得溶液中NaClO和NaClO3的数目之比为4:1,则产物的溶液中NaCl和NaClO的物质的量之比为___ 。
(1)产物中有NaClO:
(2)产物中有NaClO3
反应完全后测得溶液中NaClO和NaClO3的数目之比为4:1,则产物的溶液中NaCl和NaClO的物质的量之比为
您最近一年使用:0次
9 . 已知:2H2(g)+O2(g)→2H2O(g)+483.6kJ
H2(g)+ O2(g)→H2O(l)+285.8kJ
O2(g)→H2O(l)+285.8kJ
1mol水变成水蒸气需要完全燃烧1.32g焦炭。
(1)1g气态水变成液态水需___ (填“吸收”或“放出”)___ kJ的热量。
(2)单质碳完全燃烧的热化学方程式___ 。
H2(g)+
 O2(g)→H2O(l)+285.8kJ
O2(g)→H2O(l)+285.8kJ1mol水变成水蒸气需要完全燃烧1.32g焦炭。
(1)1g气态水变成液态水需
(2)单质碳完全燃烧的热化学方程式
您最近一年使用:0次
10 . Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂。Na2SO3在30℃时的溶解度为35.5g/100gH2O。
(1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数ω。___ (保留2位小数)
(2)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3•7H2O晶体79.5g。计算10℃时Na2SO3在水中的溶解度。___
(1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数ω。
(2)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3•7H2O晶体79.5g。计算10℃时Na2SO3在水中的溶解度。
您最近一年使用:0次
2020-08-18更新
|
53次组卷
|
2卷引用:上海理工大附中2014-2015学年高一上学期期末化学试卷



