1 . 以芳香族化合物A为原料制备某药物中间体G的路线如下:
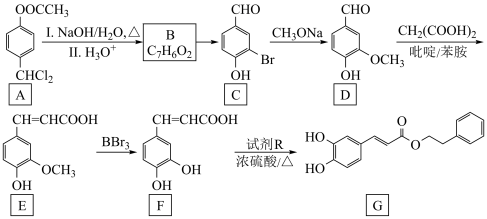
已知:同一碳原子上连两个羟基时不稳定,易发生反应:RCH(OH)2→RCHO+H2O。
请回答下列问题:
(1)A中含氧 官能团的名称是___________ 。
(2)B的化学名称为___________ 。
(3)C在一定条件与H2按照物质的量1:4发生加成反应生成化合物H,加成产物H含有手性碳原子的数目为___________ 。
(4)F→G的反应类型___________ 。
(5)D→E有CO2生成,该反应的化学方程式为___________ 。
(6)I是D的同分异构体,同时满足下列条件的I有___________ 种(不包括立体异构)。
条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③能发生银镜反应。
其中,核磁共振氢谱显示5组峰,且峰面积比为2:2:2:1:1的结构简式为___________ 。
(7)根据上述路线中的相关知识,设计以 和乙酸为原料制备
和乙酸为原料制备 的合成路线
的合成路线___________ (其他试剂任选)。

已知:同一碳原子上连两个羟基时不稳定,易发生反应:RCH(OH)2→RCHO+H2O。
请回答下列问题:
(1)A中
(2)B的化学名称为
(3)C在一定条件与H2按照物质的量1:4发生加成反应生成化合物H,加成产物H含有手性碳原子的数目为
(4)F→G的反应类型
(5)D→E有CO2生成,该反应的化学方程式为
(6)I是D的同分异构体,同时满足下列条件的I有
条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③能发生银镜反应。
其中,核磁共振氢谱显示5组峰,且峰面积比为2:2:2:1:1的结构简式为
(7)根据上述路线中的相关知识,设计以
 和乙酸为原料制备
和乙酸为原料制备 的合成路线
的合成路线
您最近一年使用:0次
解题方法
2 . 硫、铬、铁、铜等元素分别是人体必须的常量元素和微量元素,在生产中有着广泛应用。回答下列问题。
(1)硫元素在周期表中的位置为___________ 。
(2)下列不同状态的Cr微粒中,电离最外层一个电子所需能量最大的是___________(填标号)。
(3)CO易与人体的血红蛋白结合,导致人体供氧不足而出现中毒症状。血红蛋白的局部结构如下图所示。
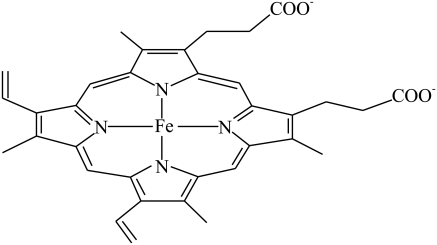
①血红蛋白中铁(II)的配位数为___________ ;
②基态Fe2+的核外价层电子排布式为___________ 。
(4)Cu可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定该物质是晶体还是非晶体,最科学的方法是对它进行________ 实验;加热该物质时,首先失去的是H2O分子,原因是________ 。
(5)金属晶体铜的晶胞如图所示。铜原子间的最短距离为apm,密度为ρg·cm-3,NA为阿伏加德罗常数。
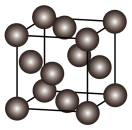
①Cu原子周围紧邻的Cu原子数目是___________ 。
②铜的相对原子质量为___________ (用a、ρ、NA表示,写出计算式即可)。
(1)硫元素在周期表中的位置为
(2)下列不同状态的Cr微粒中,电离最外层一个电子所需能量最大的是___________(填标号)。
| A.[Ar]3d54s1 | B.[Ar]3d44s14p1 | C.[Ar]3d5 | D.[Ar]3d54p1 |

①血红蛋白中铁(II)的配位数为
②基态Fe2+的核外价层电子排布式为
(4)Cu可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定该物质是晶体还是非晶体,最科学的方法是对它进行
(5)金属晶体铜的晶胞如图所示。铜原子间的最短距离为apm,密度为ρg·cm-3,NA为阿伏加德罗常数。

①Cu原子周围紧邻的Cu原子数目是
②铜的相对原子质量为
您最近一年使用:0次
解题方法
3 . 乙醇酸钠(HOCH2COONa)又称羟基乙酸钠,它是一种有机原料,其相对分子质量为98。羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。实验室拟用氯乙酸(ClCH2COOH)和NaOH溶液制备少量羟基乙酸钠,此反应为剧烈的放热反应,具体实验步骤如下:
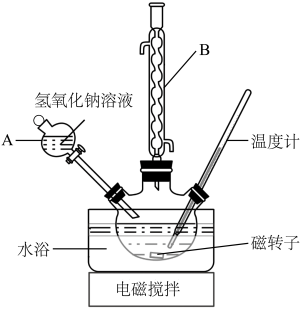
步骤1:如图所示装置的三颈烧瓶中,加入132.3g氯乙酸、50mL水,搅拌。逐步加入40%NaOH溶液,在95℃继续搅拌反应2小时,反应过程控制pH约为9至10之间。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤,滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加入适量乙醇中,冷却结晶,过滤、干燥,得到羟基乙酸钠。
请回答下列问题:
(1)装置中仪器A的名称为___________ 。
(2)上图装置中仪器B为球形冷凝管,下列说法正确的是___________ (填字母)。
A.球形冷凝管与直形冷凝管相比,冷却面积更大,效果更好
B.球形冷凝管既可以作倾斜式蒸馏装置,也可用于垂直回流装置
C.在使用冷凝管进行蒸馏操作时,一般蒸馏物的沸点越高,蒸气越易冷凝
(3)步骤1中,发生反应的化学方程式是___________ 。
(4)逐步加入40%NaOH溶液的目的是___________ ,___________ 。
(5)步骤2中,三颈烧瓶中如果忘加磁转子该如何操作___________ 。
(6)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的___________ 。
(7)步骤4中,得到纯净羟基乙酸钠98.0g,则实验产率为___________ (结果保留1位小数)。

步骤1:如图所示装置的三颈烧瓶中,加入132.3g氯乙酸、50mL水,搅拌。逐步加入40%NaOH溶液,在95℃继续搅拌反应2小时,反应过程控制pH约为9至10之间。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤,滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加入适量乙醇中,冷却结晶,过滤、干燥,得到羟基乙酸钠。
请回答下列问题:
(1)装置中仪器A的名称为
(2)上图装置中仪器B为球形冷凝管,下列说法正确的是
A.球形冷凝管与直形冷凝管相比,冷却面积更大,效果更好
B.球形冷凝管既可以作倾斜式蒸馏装置,也可用于垂直回流装置
C.在使用冷凝管进行蒸馏操作时,一般蒸馏物的沸点越高,蒸气越易冷凝
(3)步骤1中,发生反应的化学方程式是
(4)逐步加入40%NaOH溶液的目的是
(5)步骤2中,三颈烧瓶中如果忘加磁转子该如何操作
(6)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的
(7)步骤4中,得到纯净羟基乙酸钠98.0g,则实验产率为
您最近一年使用:0次
解题方法
4 . 碳是地球上组成生命的最基本元素之一、不仅能形成丰富多彩的有机化合物,还能形成多种无机化合物,碳及其化合物的用途广泛。根据要求回答下列问题:
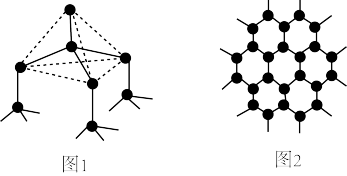
(1)下图中分别代表了碳单质的两种常见晶体,图1晶体中C原子的杂化方式为___________ ,图2晶体中,每个六元环占有___________ 个C原子。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为___________ 。
(3)丙炔( )分子中π键、σ键数目之比为
)分子中π键、σ键数目之比为___________ 。
(4)碳和氢形成的最简单碳正离子CH 的空间构型为
的空间构型为___________ 。
(5)双烯合成即狄尔斯-阿尔德反应(Diels—Alder反应),由共轭双烯与烯烃或炔烃反应生成六元环的反应,是有机化学合成反应中非常重要的碳碳键形成的手段之一、例如: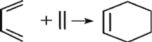 。现用2—甲基—1,3—丁二烯(
。现用2—甲基—1,3—丁二烯(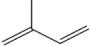 )通过狄尔斯-阿尔德反应合成A(
)通过狄尔斯-阿尔德反应合成A(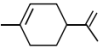 ),在合成A的过程中还可以生成A的多种同分异构体,写出其中一种同分异构体的结构简式
),在合成A的过程中还可以生成A的多种同分异构体,写出其中一种同分异构体的结构简式___________ 。
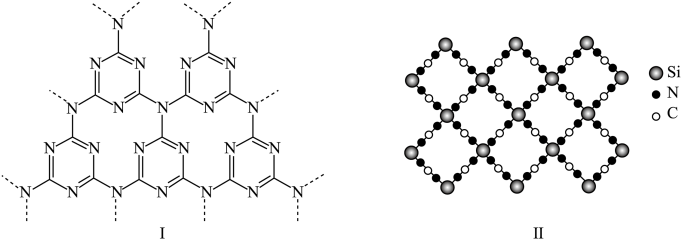
(6)g-C3N4具有和石墨相似的层状结构,其中一种二维平面结构如下图(I)所示,用硅原子替换氮化碳的部分碳原子可形成具有相似性质的化合物如下图(II)所示,该化合物的化学式为___________ ,该化合物中所有元素的电负性由大到小的顺序为___________ 。
(1)下图中分别代表了碳单质的两种常见晶体,图1晶体中C原子的杂化方式为

(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为(3)丙炔(
 )分子中π键、σ键数目之比为
)分子中π键、σ键数目之比为(4)碳和氢形成的最简单碳正离子CH
 的空间构型为
的空间构型为(5)双烯合成即狄尔斯-阿尔德反应(Diels—Alder反应),由共轭双烯与烯烃或炔烃反应生成六元环的反应,是有机化学合成反应中非常重要的碳碳键形成的手段之一、例如:
 。现用2—甲基—1,3—丁二烯(
。现用2—甲基—1,3—丁二烯( )通过狄尔斯-阿尔德反应合成A(
)通过狄尔斯-阿尔德反应合成A( ),在合成A的过程中还可以生成A的多种同分异构体,写出其中一种同分异构体的结构简式
),在合成A的过程中还可以生成A的多种同分异构体,写出其中一种同分异构体的结构简式(6)g-C3N4具有和石墨相似的层状结构,其中一种二维平面结构如下图(I)所示,用硅原子替换氮化碳的部分碳原子可形成具有相似性质的化合物如下图(II)所示,该化合物的化学式为

您最近一年使用:0次
5 . 硒化锌(ZnSe)是一种重要的半导体材料;其晶胞结构如图甲所示,乙图为晶胞的俯视图,已知晶胞参数为anm,硒原子和锌原子的半径分别为r1nm和r2nm,下列说法不正确的是
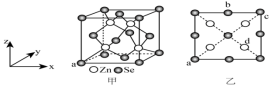

| A.Zn与距离最近的Se所形成的键的夹角为109°28ˊ |
B.晶胞中d点原子分数坐标为( , , , , ) ) |
| C.相邻两个Zn原子的最短距离为0.5anm |
D.硒原子和锌原子的空间利用率为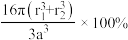 |
您最近一年使用:0次
2023-06-30更新
|
264次组卷
|
2卷引用:重庆市江津中学等七校2022-2023学年高二下学期期末联考化学试题
名校
解题方法
6 . 已知在有机化合物中,吸电子基团(吸引电子云密度靠近)能力:-Cl>-C≡CH>-C6H5>-CH=CH2>-H,推电子基团(排斥电子云密度偏离)能力:-C(CH3)3>-CH(CH3)2>-CH2CH3>-CH3>-H,一般来说,体系越缺电子,酸性越强;体系越富电子,碱性越强。下列说法正确的是
| A.碳原子杂化轨道中s成分占比:CH2=CH2>CH≡CH |
| B.酸性:CH3COOH>ClCH2COOH |
C.羟基的活性: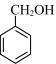 >CH3CH2OH >CH3CH2OH |
D.碱性: > > |
您最近一年使用:0次
2023-06-30更新
|
183次组卷
|
2卷引用:重庆市江津中学等七校2022-2023学年高二下学期期末联考化学试题
7 . 下列说法正确的是
A.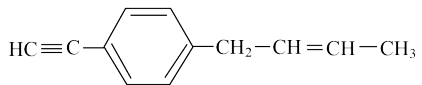 分子中,处在同一条直线上的碳原子最多为4个 分子中,处在同一条直线上的碳原子最多为4个 |
| B.分子式为C4H6O的同分异构体中能够发生银镜反应的有5种(考虑立体异构) |
C.螺环化合物( )与环氧乙烷( )与环氧乙烷( )互为同系物 )互为同系物 |
| D.总质量一定的C2H2和CH3CHO无论以何种比例混合完全燃烧,总耗氧量不变 |
您最近一年使用:0次
名校
解题方法
8 . 下列实验操作和现象以及所得结论均正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向丙烯醛(CH2=CHCHO)中滴加溴水,溴水褪色 | 丙烯醛中含碳碳双键 |
| B | 在溴乙烷中加入氢氧化钠溶液,加热一段时间,再滴入几滴硝酸银溶液,未出现黄色沉淀 | 溴乙烷未水解 |
| C | 液溴和苯在铁粉作用下剧烈放热,将产生的气体通入AgNO3溶液,出现浅黄色沉淀 | 苯和液溴发生了取代反应 |
| D | 淀粉溶液中加入稀硫酸加热后,再滴加碘水呈无色 | 淀粉完全水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-30更新
|
229次组卷
|
2卷引用:重庆市江津中学等七校2022-2023学年高二下学期期末联考化学试题
名校
9 . 中科院国家纳米科学中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了多年的问题提供了直观证据。下列有关氢键的说法中正确的是
| A.H2O的稳定性高,是因为水分子间存在氢键 |
B.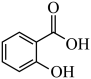 比 比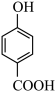 熔点高 熔点高 |
| C.H2O比HF沸点高是由于1molH2O中氢键O-H…O数目多于1molHF中F-H…F |
| D.可燃冰(CH4·8H2O)中甲烷分子与水分子之间形成了氢键 |
您最近一年使用:0次
2023-06-30更新
|
177次组卷
|
2卷引用:重庆市江津中学等七校2022-2023学年高二下学期期末联考化学试题
10 . 某金属有机多孔材料(MOFA)对CO2具有超高吸附能力,并能催化CO2与环氧丙烷反应,其工作原理如图所示。下列说法错误的是
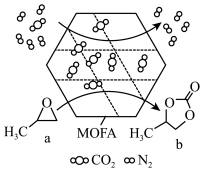

| A.b分子中碳原子采用sp2和sp3杂化 |
| B.b的一氯代物有3种 |
| C.1molb最多可与2molNaOH反应 |
| D.a转化为b发生取代反应,并有极性共价键的形成 |
您最近一年使用:0次



