解题方法
1 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231 ℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为________ 。
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________ ;此锡粉样品中锡的质量分数:____________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
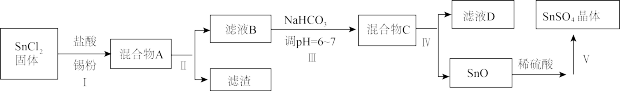
①步骤Ⅰ加入Sn粉的作用:____________________ 及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、________________________ 。
③步骤Ⅲ生成SnO的离子方程式:__________________________ 。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是___________________ ,证明已洗净。
⑤步骤Ⅴ操作依次为___________________ 、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:_____________ 。实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是_______________
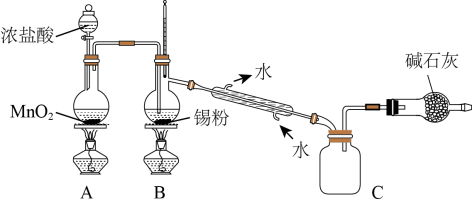
(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是______________________ 。
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
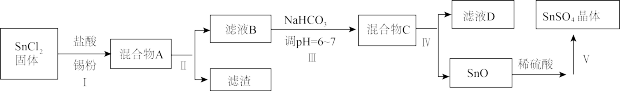
①步骤Ⅰ加入Sn粉的作用:
②步骤Ⅱ用到的玻璃仪器有烧杯、
③步骤Ⅲ生成SnO的离子方程式:
④步骤Ⅳ中检验SnO是否洗涤干净的操作是
⑤步骤Ⅴ操作依次为
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:

(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是
您最近一年使用:0次
2016-12-09更新
|
258次组卷
|
4卷引用:2017届广东省华侨中学高三上学期摸底考试理综化学试卷
2 . 亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:
[实验Ⅰ] NaClO2晶体按如下图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C起的是__________________ 的作用。
(2)已知装置B中的产物有ClO2气体,则B中产生气体的化学方程式为__________ ;装置D中生成NaClO2和一种助燃气体,其反应的化学方程式为_________________ ;装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还一定含有的一种阴离子是_________ ;检验该离子的方法是:取少量反应后的溶液于试管中,__________________ 。
(3)从装置D反应后的溶液中获得NaClO2晶体的操作步骤为:①减压在55℃蒸发结晶;②__________ ;③用38℃~60℃热水洗涤;④低于___________ ℃干燥;得到成品。
(4)反应结束后,打开K1,装置A起的作用是_________________ ;如果撤去D中的冷水浴,可能导致产品中混有的杂质是______________ 。
[实验Ⅱ]样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度:准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣),则所称取的样品中NaClO2的物质的量为________________ 。
[实验Ⅰ] NaClO2晶体按如下图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C起的是
(2)已知装置B中的产物有ClO2气体,则B中产生气体的化学方程式为
(3)从装置D反应后的溶液中获得NaClO2晶体的操作步骤为:①减压在55℃蒸发结晶;②
(4)反应结束后,打开K1,装置A起的作用是
[实验Ⅱ]样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度:准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣),则所称取的样品中NaClO2的物质的量为
您最近一年使用:0次
3 . (一)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
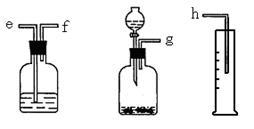
(1)标出各仪器连接的顺序_______ ,量筒在实验中的作用是_______________________
(2)有一块表面氧化成Na2O的金属钠,其质量为1.0g,实验后在量筒中收集到0.224L水,求样品中金属钠的质量是________ 。(假设在标准状况下测定)
(二)为探究碳酸氢钠的热稳定性,并验证其产物与过氧化钠的反应,按以下装置图进行实验,填写有关现象及化学方程式。

(1)写出A中发生反应的化学方程式为____________________
(2)B中浓硫酸的作用是____________________
(3)C中发生反应的化学方程式为___________________ ,每反应1molNa2O2转移________ mol电子
(4)E中收集的气体是__________________

(1)标出各仪器连接的顺序
(2)有一块表面氧化成Na2O的金属钠,其质量为1.0g,实验后在量筒中收集到0.224L水,求样品中金属钠的质量是
(二)为探究碳酸氢钠的热稳定性,并验证其产物与过氧化钠的反应,按以下装置图进行实验,填写有关现象及化学方程式。

(1)写出A中发生反应的化学方程式为
(2)B中浓硫酸的作用是
(3)C中发生反应的化学方程式为
(4)E中收集的气体是
您最近一年使用:0次
4 . 化学上常用燃烧法测定有机物的分子式,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
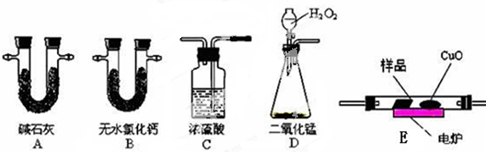
实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:___________ (每种装置只用一次);
(2)实验数据记录和处理
上表中①、②分别指哪个装置?____________ 、 _____________ 。
(3)若实验准确称取4.4 g样品,经燃烧后测得产生CO28.8 g,水蒸气3.6g。要确定该有机物的分子式,还必须知道的数据是________ ;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式___________ ,与该有机物相对分子质量相同的烃的一氯代物有_____ 种。

实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:
(2)实验数据记录和处理
| 物理量实验序号 | 燃烧有机物的质量 | ① | ② | ||
| 实验前质量 | 实验后质量 | 实验前质量 | 实验后质量 | ||
| 1 | m1 | m2 | m3 | m4 | m5 |
上表中①、②分别指哪个装置?
(3)若实验准确称取4.4 g样品,经燃烧后测得产生CO28.8 g,水蒸气3.6g。要确定该有机物的分子式,还必须知道的数据是
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式
您最近一年使用:0次
2016-12-09更新
|
643次组卷
|
3卷引用:2014-2015学年广东省广州市高二下学期期末五校联考化学试卷
名校
解题方法
5 . 铁是人类较早使用的金属之一,铁及其化合物在现代社会各个领域仍有广泛的应用。
I.氧化物—Fe2O3:用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:
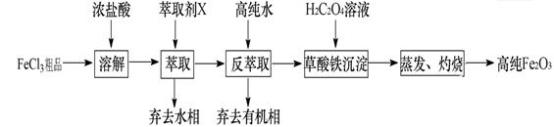
已知:HCl(浓)+ FeCl3 HFeCl4。试回答下列问题:
HFeCl4。试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
① Ca2+、Mn2+、Cu2+等杂质离子主要在__________ (填“水”或“有机”)相。
② 若实验时共用萃取剂X 150mL,萃取率最高的方法是__________ (填字母)。
a.一次性萃取,150mL b.分2次萃取,每次75mL c.分3次萃取,每次50mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是________________ (写化学式);反萃取能发生的原因是___________________ 。
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是________________ 。
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式___________________ 。
II.含氧酸盐—铁酸铜(CuFe2O4)是很有前景的热化学分解水制氢的材料,CuFe2O4在制氢过程中可以循环使用。在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
(5)根据以上提示,写出氧缺位体与水常温下反应制氢的化学方程式____________ 。
(6)课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=__________ 。(结果保留小数点后2位)
I.氧化物—Fe2O3:用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:

已知:HCl(浓)+ FeCl3
 HFeCl4。试回答下列问题:
HFeCl4。试回答下列问题:(1)用萃取剂X萃取,该步骤中:
① Ca2+、Mn2+、Cu2+等杂质离子主要在
② 若实验时共用萃取剂X 150mL,萃取率最高的方法是
a.一次性萃取,150mL b.分2次萃取,每次75mL c.分3次萃取,每次50mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式
II.含氧酸盐—铁酸铜(CuFe2O4)是很有前景的热化学分解水制氢的材料,CuFe2O4在制氢过程中可以循环使用。在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
(5)根据以上提示,写出氧缺位体与水常温下反应制氢的化学方程式
(6)课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=
您最近一年使用:0次
2016-12-09更新
|
335次组卷
|
2卷引用:2016届广东省清远市高三上学期期末考试化学试卷
解题方法
6 . 亚氯酸钠(NaClO2)是重要的漂白剂。某小组开展如下实验,按如图装置制取无水NaClO2晶体,回答下列问题:

已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是_________________ ;
(2)已知装置B中的产物有ClO2气体,则B中反应的方程式为_________________ ;装置D中反应生成NaClO2的化学方程式为_________________ ;
(3)从装置D反应后的溶液中获得无水NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②__________ ;③用38℃~60℃热水_____________ ;④在_________ 条件下干燥得到成品。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_________ 和_________ ;
(5)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应: +4I-+4H+=2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol•L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2
+4I-+4H+=2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol•L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2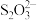 =2I-+
=2I-+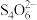 )。请计算所称取的样品中NaClO2的质量为
)。请计算所称取的样品中NaClO2的质量为_________ 。

已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是
(2)已知装置B中的产物有ClO2气体,则B中反应的方程式为
(3)从装置D反应后的溶液中获得无水NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是
(5)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:
 +4I-+4H+=2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol•L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2
+4I-+4H+=2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol•L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2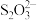 =2I-+
=2I-+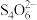 )。请计算所称取的样品中NaClO2的质量为
)。请计算所称取的样品中NaClO2的质量为
您最近一年使用:0次
真题
名校
7 . 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

回答下列问题:
(1)步骤①中得到的氧化产物是_________ ,溶解温度应控制在60~70度,原因是__________ 。
(2)写出步骤③中主要反应的离子方程式___________ 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________ (写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是______________________________ 。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有__________ (填字母)
(6)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________ 。

回答下列问题:
(1)步骤①中得到的氧化产物是
(2)写出步骤③中主要反应的离子方程式
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是
(4)上述工艺中,步骤⑥不能省略,理由是
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有
| A.分馏塔 | B.离心机 | C.反应釜 | D.框式压滤机 |
(6)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为
您最近一年使用:0次
2015-06-24更新
|
4994次组卷
|
6卷引用:2016届广东省深圳第二外国语学校高三上学期第二次教学质检化学试卷
解题方法
8 . 某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质。
Ⅰ、他们先把铜粉放在空气中灼烧,再与稀硝酸反应制取硝酸铜。
(1)如果直接用铜屑与稀硝酸反应来制取硝酸铜,可能导致的两个不利因素是_______________ 、________________ 。
(2)实验中铜粉应该放在_________ (填“蒸发皿”“坩埚”或“烧杯”)中灼烧。欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序分别是_________ 、________ 、过滤。
Ⅱ、为了探究Cu(NO3)2在酸性条件下跟铁单质的反应。他们取一支试管,加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,实验后没有固体残留物质。
(3)该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验。请按下表格式补充写出实验操作步骤、预期现象与结论。
Ⅰ、他们先把铜粉放在空气中灼烧,再与稀硝酸反应制取硝酸铜。
(1)如果直接用铜屑与稀硝酸反应来制取硝酸铜,可能导致的两个不利因素是
(2)实验中铜粉应该放在
Ⅱ、为了探究Cu(NO3)2在酸性条件下跟铁单质的反应。他们取一支试管,加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,实验后没有固体残留物质。
(3)该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验。请按下表格式补充写出实验操作步骤、预期现象与结论。
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,① |
| 步骤2: 取少量溶液,滴加酸性KMnO4溶液 | ② |
| 步骤3: ③ | 若溶液变为红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
您最近一年使用:0次
解题方法
9 . 某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质。
Ⅰ、他们先把铜粉放在空气中灼烧,再与稀硝酸反应制取硝酸铜。
(1)如果直接用铜屑与稀硝酸反应来制取硝酸铜:
①铜屑与稀硝酸反应的化学反应方程式为____________________ ;
②可能导致的两个不利因素是_____________ 、________________ 。
(2)实验中,欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序是_____ 、______ 、过滤、晾干。
Ⅱ、为了探究Cu(NO3)2在酸性条件下跟铁单质的反应。他们取一支试管,加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,实验后没有固体残留物质。
(3)该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验。请按下表格式补充写出实验操作步骤、预期现象与结论。
Ⅰ、他们先把铜粉放在空气中灼烧,再与稀硝酸反应制取硝酸铜。
(1)如果直接用铜屑与稀硝酸反应来制取硝酸铜:
①铜屑与稀硝酸反应的化学反应方程式为
②可能导致的两个不利因素是
(2)实验中,欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序是
Ⅱ、为了探究Cu(NO3)2在酸性条件下跟铁单质的反应。他们取一支试管,加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,实验后没有固体残留物质。
(3)该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验。请按下表格式补充写出实验操作步骤、预期现象与结论。
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,① |
| 步骤2:取少量溶液,滴加酸性KMnO4溶液 | ② |
| 步骤3:③另取少量溶液,滴加KSCN溶 | ③ |
您最近一年使用:0次



