名校
解题方法
1 .  纳米材料是一种很有发展前景的储能材料,用菱锰矿(主要成分为
纳米材料是一种很有发展前景的储能材料,用菱锰矿(主要成分为 ,含有少量CaO、MgO、FeO、
,含有少量CaO、MgO、FeO、 、
、 等)制备
等)制备 纳米材料的工艺流程如图所示。
纳米材料的工艺流程如图所示。 如表所示。
如表所示。
回答下列问题:
(1)“酸浸”中提高反应速率的可行措施有___________ (任答一条);酸浸渣的主要成分是___________ (填化学式)。
(2)加入 的目的是氧化
的目的是氧化___________ (填离子符号),写出该离子被氧化生成沉淀的离子方程式:___________ 。
(3)回收的沉淀可与浓硫酸反应生成能腐蚀玻璃的气体, 与浓硫酸在加热的条件下反应的化学方程式为
与浓硫酸在加热的条件下反应的化学方程式为___________ ;25℃时,沉淀后的滤液中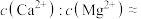
___________ (写最简整数比)。
(4)用去离子水多次洗涤 纳米材料,检验沉淀是否洗涤干净的操作为
纳米材料,检验沉淀是否洗涤干净的操作为___________ 。
(5)“高压釜水热反应”溶液pH应调节为中性,而不能过高的原因是___________ 。
 纳米材料是一种很有发展前景的储能材料,用菱锰矿(主要成分为
纳米材料是一种很有发展前景的储能材料,用菱锰矿(主要成分为 ,含有少量CaO、MgO、FeO、
,含有少量CaO、MgO、FeO、 、
、 等)制备
等)制备 纳米材料的工艺流程如图所示。
纳米材料的工艺流程如图所示。
 如表所示。
如表所示。| 物质 |  |  |  |  |
 | 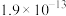 |  | 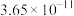 | 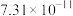 |
| 物质 |  |  |  | |
 | 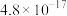 | 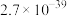 |  |
(1)“酸浸”中提高反应速率的可行措施有
(2)加入
 的目的是氧化
的目的是氧化(3)回收的沉淀可与浓硫酸反应生成能腐蚀玻璃的气体,
 与浓硫酸在加热的条件下反应的化学方程式为
与浓硫酸在加热的条件下反应的化学方程式为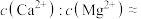
(4)用去离子水多次洗涤
 纳米材料,检验沉淀是否洗涤干净的操作为
纳米材料,检验沉淀是否洗涤干净的操作为(5)“高压釜水热反应”溶液pH应调节为中性,而不能过高的原因是
您最近一年使用:0次
2024-05-26更新
|
163次组卷
|
2卷引用:2024届重庆市渝西中学高三下学期模拟预测化学试题
2 . 一种从分银渣(含CuO、 、
、 、
、 、
、 、Ag、
、Ag、 等)回收金属资源的工艺流程如下:
等)回收金属资源的工艺流程如下:
Ⅰ.CuCl难溶于水,但溶于浓盐酸。
Ⅱ.“富锑铋铜液”中含 (铋离子)、
(铋离子)、 (锑离子)、
(锑离子)、 、
、 。
。
Ⅲ.该工艺条件下,有关金属离子沉淀时的相关pH见下表:
回答下列问题:
(1)写出分银渣中的Ag与盐酸、溶解氧反应的离子方程式:___________________ 。
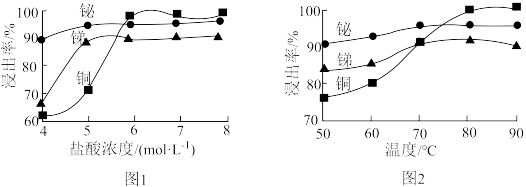
(2)“酸浸”时,盐酸浓度对锑、铋、铜浸出率的影响如图1所示,温度对锑、铋、铜浸出率的影响如图2所示。______ ;浸出时温度以80℃为宜,其原因是_____________________ 。
(3)①已知“滤渣2”的主要成分是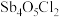 ,则“一次水解”时主要发生反应的化学方程式为
,则“一次水解”时主要发生反应的化学方程式为________ 。
②已知“滤渣3”的主要成分是BiOCl和 ,则“二次水解”时调节pH的范围应该是
,则“二次水解”时调节pH的范围应该是______ 。
(4)“滤渣1”中的AgCl可用硫酸-硫脲(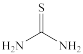 )浸出,生成配合物
)浸出,生成配合物 ,写出该反应的化学方程式:
,写出该反应的化学方程式:________________ ;该配合物中不存在__________ (填标号)。
A.离子键 B.极性共价键 C.配位键 D.范德华力 E.非极性共价键
(5)写出一种从“富铜溶液”中回收金属资源的方法:_________________ 。
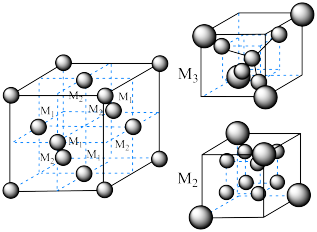
(6)尖晶石属于立方晶系,其晶胞可视为 、
、 两种结构交替无隙并置而成(如图所示),其中
两种结构交替无隙并置而成(如图所示),其中 可以为
可以为 、
、 、
、 、
、 等,
等, 可以为
可以为 、
、 、
、 等。已知尖晶石型
等。已知尖晶石型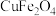 的晶胞参数为842pm,则该晶体的密度为
的晶胞参数为842pm,则该晶体的密度为________  。(列出计算式,阿伏加德罗常数的值为
。(列出计算式,阿伏加德罗常数的值为 )
)
 、
、 、
、 、
、 、Ag、
、Ag、 等)回收金属资源的工艺流程如下:
等)回收金属资源的工艺流程如下: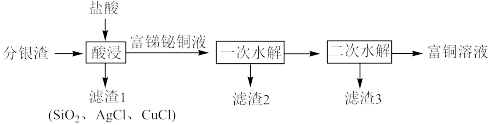
Ⅰ.CuCl难溶于水,但溶于浓盐酸。
Ⅱ.“富锑铋铜液”中含
 (铋离子)、
(铋离子)、 (锑离子)、
(锑离子)、 、
、 。
。Ⅲ.该工艺条件下,有关金属离子沉淀时的相关pH见下表:
金属离子 |
|
|
|
|
开始沉淀时( | 0.5 | 1.5 | 4.7 | 1.5 |
完全沉淀时( | 1.4 | 2.5 | 6.7 | 3.2 |
(1)写出分银渣中的Ag与盐酸、溶解氧反应的离子方程式:
(2)“酸浸”时,盐酸浓度对锑、铋、铜浸出率的影响如图1所示,温度对锑、铋、铜浸出率的影响如图2所示。
(3)①已知“滤渣2”的主要成分是
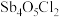 ,则“一次水解”时主要发生反应的化学方程式为
,则“一次水解”时主要发生反应的化学方程式为②已知“滤渣3”的主要成分是BiOCl和
 ,则“二次水解”时调节pH的范围应该是
,则“二次水解”时调节pH的范围应该是(4)“滤渣1”中的AgCl可用硫酸-硫脲(
 )浸出,生成配合物
)浸出,生成配合物 ,写出该反应的化学方程式:
,写出该反应的化学方程式:A.离子键 B.极性共价键 C.配位键 D.范德华力 E.非极性共价键
(5)写出一种从“富铜溶液”中回收金属资源的方法:
(6)尖晶石属于立方晶系,其晶胞可视为
 、
、 两种结构交替无隙并置而成(如图所示),其中
两种结构交替无隙并置而成(如图所示),其中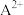 可以为
可以为 、
、 、
、 、
、 等,
等, 可以为
可以为 、
、 、
、 等。已知尖晶石型
等。已知尖晶石型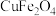 的晶胞参数为842pm,则该晶体的密度为
的晶胞参数为842pm,则该晶体的密度为 。(列出计算式,阿伏加德罗常数的值为
。(列出计算式,阿伏加德罗常数的值为 )
)
您最近一年使用:0次
3 . 实验室用磷矿脱镁废液制备 的实验过程可表示为
的实验过程可表示为 及少量
及少量 、
、 、
、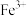 、
、 和
和 。
。
①向废液中加入 溶液调节
溶液调节 为
为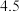 ,可达到
,可达到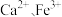 和
和 的最佳沉淀效果。其中
的最佳沉淀效果。其中 转化为
转化为 的离子方程式为
的离子方程式为_________ 。
②将除杂净化后的清液控制在一定温度,加入 浆液搅拌即可获得
浆液搅拌即可获得 固体。实验测得镁回收率、产品纯度与反应后溶液
固体。实验测得镁回收率、产品纯度与反应后溶液 关系如图所示。
关系如图所示。 小于6时,随着
小于6时,随着 增大,镁回收率上升,其原因是
增大,镁回收率上升,其原因是_______ 。 大于6时,随着
大于6时,随着 增大,产品纯度逐渐下降,其可能原因是
增大,产品纯度逐渐下降,其可能原因是_______ 。
(2)实验室用如下方案测定 产品(含有
产品(含有 杂质)的纯度:准确称取
杂质)的纯度:准确称取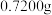 磷酸氢镁产品,加入足量稀硫酸溶解后配成
磷酸氢镁产品,加入足量稀硫酸溶解后配成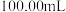 溶液。准确移取
溶液。准确移取 于锥形瓶中,用
于锥形瓶中,用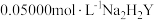 标准液滴定(离子方程式为
标准液滴定(离子方程式为 )至终点,平行滴定三次,平均消耗
)至终点,平行滴定三次,平均消耗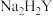 标准液
标准液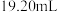 。计算该产品中
。计算该产品中 的纯度
的纯度_______ (写出计算过程)。
(3)恒温转化后的母液中主要含 和
和 。已知:水溶液中各含磷微粒的分布如图-2所示,
。已知:水溶液中各含磷微粒的分布如图-2所示, 和
和 的溶解度曲线如图-3所示;常温下
的溶解度曲线如图-3所示;常温下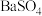 、
、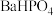 的溶度积常数依次为
的溶度积常数依次为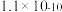 和
和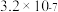 。请补充完整由恒温转化后的母液制备
。请补充完整由恒温转化后的母液制备 晶体的实验方案:用比浊法测定母液中
晶体的实验方案:用比浊法测定母液中 的浓度后,在搅拌下向一定体积的母液中
的浓度后,在搅拌下向一定体积的母液中_______ ,过滤、用无水乙醇洗涤,干燥。
 的实验过程可表示为
的实验过程可表示为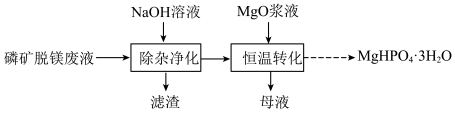
 及少量
及少量 、
、 、
、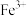 、
、 和
和 。
。①向废液中加入
 溶液调节
溶液调节 为
为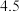 ,可达到
,可达到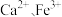 和
和 的最佳沉淀效果。其中
的最佳沉淀效果。其中 转化为
转化为 的离子方程式为
的离子方程式为②将除杂净化后的清液控制在一定温度,加入
 浆液搅拌即可获得
浆液搅拌即可获得 固体。实验测得镁回收率、产品纯度与反应后溶液
固体。实验测得镁回收率、产品纯度与反应后溶液 关系如图所示。
关系如图所示。 小于6时,随着
小于6时,随着 增大,镁回收率上升,其原因是
增大,镁回收率上升,其原因是
 大于6时,随着
大于6时,随着 增大,产品纯度逐渐下降,其可能原因是
增大,产品纯度逐渐下降,其可能原因是(2)实验室用如下方案测定
 产品(含有
产品(含有 杂质)的纯度:准确称取
杂质)的纯度:准确称取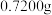 磷酸氢镁产品,加入足量稀硫酸溶解后配成
磷酸氢镁产品,加入足量稀硫酸溶解后配成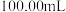 溶液。准确移取
溶液。准确移取 于锥形瓶中,用
于锥形瓶中,用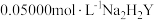 标准液滴定(离子方程式为
标准液滴定(离子方程式为 )至终点,平行滴定三次,平均消耗
)至终点,平行滴定三次,平均消耗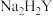 标准液
标准液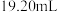 。计算该产品中
。计算该产品中 的纯度
的纯度(3)恒温转化后的母液中主要含
 和
和 。已知:水溶液中各含磷微粒的分布如图-2所示,
。已知:水溶液中各含磷微粒的分布如图-2所示, 和
和 的溶解度曲线如图-3所示;常温下
的溶解度曲线如图-3所示;常温下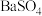 、
、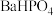 的溶度积常数依次为
的溶度积常数依次为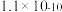 和
和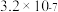 。请补充完整由恒温转化后的母液制备
。请补充完整由恒温转化后的母液制备 晶体的实验方案:用比浊法测定母液中
晶体的实验方案:用比浊法测定母液中 的浓度后,在搅拌下向一定体积的母液中
的浓度后,在搅拌下向一定体积的母液中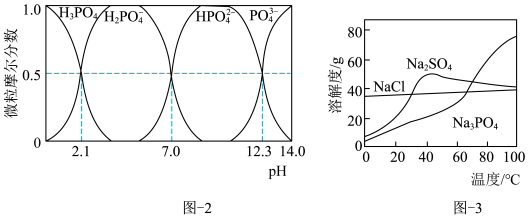
您最近一年使用:0次
4 . 以软锰矿浆(含 及少量
及少量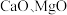 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。
(1)吸收 。
。
①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
②脱硫过程中软锰矿浆的 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是_______ 。 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿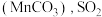 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是_______ 。
(2)净化 。
。
①过滤脱硫后的软锰矿浆液,用 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于_______  。(已知:
。(已知: 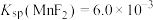 、
、 ,
, 、)
、)
②净化时生成的 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为_______ 。 。
。
①向反应器中加入 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:_______ 。
②实际生产中,常将 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入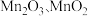 等,其原因是
等,其原因是_______ 。
 及少量
及少量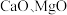 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。(1)吸收
 。
。①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的
 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:②脱硫过程中软锰矿浆的
 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是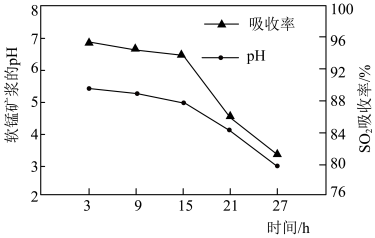
 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿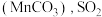 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是(2)净化
 。
。①过滤脱硫后的软锰矿浆液,用
 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于 。(已知:
。(已知: 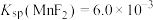 、
、 ,
, 、)
、)②净化时生成的
 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为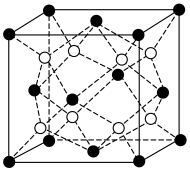
 。
。①向反应器中加入
 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:②实际生产中,常将
 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入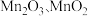 等,其原因是
等,其原因是
您最近一年使用:0次
2024-05-25更新
|
319次组卷
|
2卷引用:江苏省苏锡常镇四市2024届高三下学期教学情况调研(二)(二模)化学试题
5 . 工业上处理含铬( )酸性废水有多种方法,其中两种方法如下:
)酸性废水有多种方法,其中两种方法如下:
Ⅰ. 还原法:含铬酸性废水
还原法:含铬酸性废水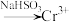 (含
(含 等)
等)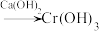 沉淀(含
沉淀(含 等沉淀)
等沉淀)
Ⅱ.电解法:含铬酸性废水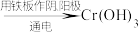 沉淀[含
沉淀[含 等沉淀]
等沉淀]
下列说法错误的是
 )酸性废水有多种方法,其中两种方法如下:
)酸性废水有多种方法,其中两种方法如下:Ⅰ.
 还原法:含铬酸性废水
还原法:含铬酸性废水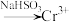 (含
(含 等)
等)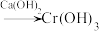 沉淀(含
沉淀(含 等沉淀)
等沉淀)Ⅱ.电解法:含铬酸性废水
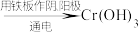 沉淀[含
沉淀[含 等沉淀]
等沉淀]下列说法错误的是
A. 和 和 中的S原子都采用 中的S原子都采用 杂化 杂化 |
B.Ⅰ和Ⅱ中,等量的 发生还原反应时消耗的 发生还原反应时消耗的 的量不同 的量不同 |
C.Ⅰ中参加反应的 |
D.Ⅱ中处理含 的废水转移6mol电子 的废水转移6mol电子 |
您最近一年使用:0次
解题方法
6 . 利用热镀锌厂在生产过程中产生的副产品锌灰(主要成分为ZnO、 及少量
及少量 、CuO、PbO等)为原料制备氧化锌或皓矾(
、CuO、PbO等)为原料制备氧化锌或皓矾( )工艺流程如下:
)工艺流程如下: 、
、 进入溶液;
进入溶液;
②25℃时, ,
, ;
;
③深度除杂标准:溶液中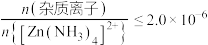 ;
;
④有机萃取剂(用HR表示)可萃取出 ,其萃取原反应为:
,其萃取原反应为: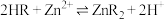 。
。
(1)浸渣中含有的物质包括PbOCl、______ 。
(2)除砷时, 转化为
转化为 沉淀,写出该反应的离子方程式
沉淀,写出该反应的离子方程式______ 。
(3)若深度除铜所得滤液中 的浓度为0.2
的浓度为0.2 ,则溶液中
,则溶液中 (不考虑水解)浓度至少为
(不考虑水解)浓度至少为______  ,才能达到深度除杂标准。
,才能达到深度除杂标准。
(4)反萃取加入的X最佳物质为______ 。
(5)“沉锌”过程获得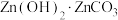 ,离子方程式为
,离子方程式为______ 。
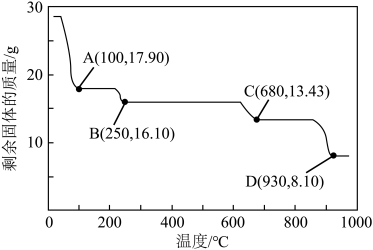
(6)获取皓矾的一系列操作包括______ 、过滤、洗涤、干燥。取28.7g产品加热至不同温度,剩余固体的质量变化如图所示。已知B→D的过程中产生两种气体,分析数据,写出该过程的化学方程式______ 。
 及少量
及少量 、CuO、PbO等)为原料制备氧化锌或皓矾(
、CuO、PbO等)为原料制备氧化锌或皓矾( )工艺流程如下:
)工艺流程如下:
 、
、 进入溶液;
进入溶液;②25℃时,
 ,
, ;
;③深度除杂标准:溶液中
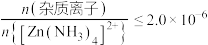 ;
;④有机萃取剂(用HR表示)可萃取出
 ,其萃取原反应为:
,其萃取原反应为: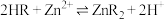 。
。(1)浸渣中含有的物质包括PbOCl、
(2)除砷时,
 转化为
转化为 沉淀,写出该反应的离子方程式
沉淀,写出该反应的离子方程式(3)若深度除铜所得滤液中
 的浓度为0.2
的浓度为0.2 ,则溶液中
,则溶液中 (不考虑水解)浓度至少为
(不考虑水解)浓度至少为 ,才能达到深度除杂标准。
,才能达到深度除杂标准。(4)反萃取加入的X最佳物质为
(5)“沉锌”过程获得
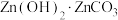 ,离子方程式为
,离子方程式为(6)获取皓矾的一系列操作包括
您最近一年使用:0次
名校
解题方法
7 . 锑白 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的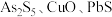 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: ;
;
②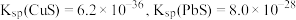 。
。
回答下列问题:
(1)“粉碎”辉锑矿的目的是___________ 。
(2)“滤渣Ⅰ”的主要成分除不溶性杂质外还有S、___________ (填化学式); 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为___________ 。
(3)“除砷”时,反应中氧化剂与还原剂的物质的量之比为___________ (P转化为最高价态)。
(4)若浸取液中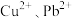 的浓度均为
的浓度均为 ,则c(S2-)≥
,则c(S2-)≥___________  才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时
才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时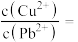
___________ 。
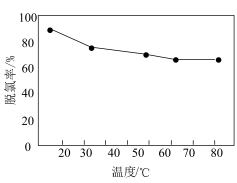
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:___________ 。
(6)锑可用于制备超亮光电极材料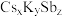 ,其晶胞结构如图所示,晶体a的化学式为
,其晶胞结构如图所示,晶体a的化学式为___________ ,晶体b中与 距离最近的
距离最近的 的个数为
的个数为___________ 。
 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的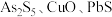 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: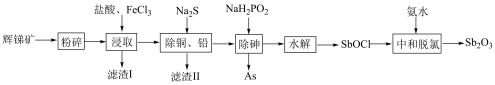
 ;
;②
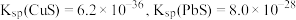 。
。回答下列问题:
(1)“粉碎”辉锑矿的目的是
(2)“滤渣Ⅰ”的主要成分除不溶性杂质外还有S、
 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为(3)“除砷”时,反应中氧化剂与还原剂的物质的量之比为
(4)若浸取液中
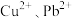 的浓度均为
的浓度均为 ,则c(S2-)≥
,则c(S2-)≥ 才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时
才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时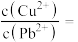
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:
(6)锑可用于制备超亮光电极材料
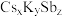 ,其晶胞结构如图所示,晶体a的化学式为
,其晶胞结构如图所示,晶体a的化学式为 距离最近的
距离最近的 的个数为
的个数为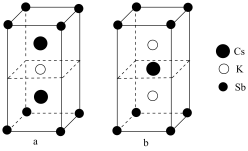
您最近一年使用:0次
解题方法
8 . 三氯氧钒( )是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。某兴趣小组利用如图所示装置以氯气、
)是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。某兴趣小组利用如图所示装置以氯气、 和碳粉为原料制备三氯氧钒。
和碳粉为原料制备三氯氧钒。 ;熔点为-77℃,沸点为126℃;
;熔点为-77℃,沸点为126℃;
②三氯氧钒遇水会迅速水解生成HCl和一种氧化物。
回答下列问题:
(1)仪器X的名称为___________ ,仪器Y为球形冷凝管,冷却水应从___________ 口(填“M”或“N”)进入。仪器X可以换为如图装置,其优点是___________ 。 ,正确的连接顺序为
,正确的连接顺序为___________ →d→e→h(按气流方向,用小写字母表示,装置可重复使用)。
(3)装置C的作用是为了防止___________ 反应发生(写化学方程式)。
(4)管式炉中发生反应生成CO的化学方程式为___________ 。
(5)已知: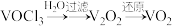 ,
, 的立方晶胞结构如图所示,晶胞参数为a pm。
的立方晶胞结构如图所示,晶胞参数为a pm。___________ 。
②晶体的密度为___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(6)取装置B烧瓶中的液体少许,先溶于水再过滤,在滤渣中加入稀硫酸溶解后,向其中加入0.2000
 溶液25mL,再用0.1000
溶液25mL,再用0.1000
 溶液滴定过量的草酸溶液至终点,消耗
溶液滴定过量的草酸溶液至终点,消耗 溶液的体积为4mL,则所取液体中
溶液的体积为4mL,则所取液体中 的质量为
的质量为___________ g(保留1位小数)。已知: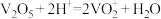 ,
,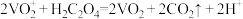 。
。
 )是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。某兴趣小组利用如图所示装置以氯气、
)是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。某兴趣小组利用如图所示装置以氯气、 和碳粉为原料制备三氯氧钒。
和碳粉为原料制备三氯氧钒。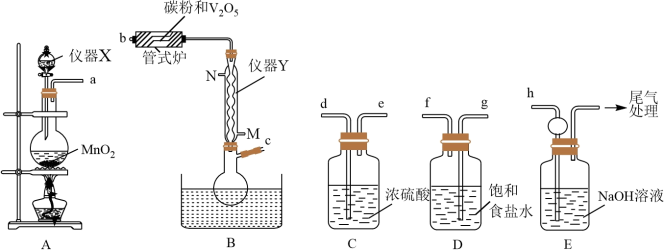
 ;熔点为-77℃,沸点为126℃;
;熔点为-77℃,沸点为126℃;②三氯氧钒遇水会迅速水解生成HCl和一种氧化物。
回答下列问题:
(1)仪器X的名称为

 ,正确的连接顺序为
,正确的连接顺序为(3)装置C的作用是为了防止
(4)管式炉中发生反应生成CO的化学方程式为
(5)已知:
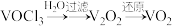 ,
, 的立方晶胞结构如图所示,晶胞参数为a pm。
的立方晶胞结构如图所示,晶胞参数为a pm。
②晶体的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。(6)取装置B烧瓶中的液体少许,先溶于水再过滤,在滤渣中加入稀硫酸溶解后,向其中加入0.2000

 溶液25mL,再用0.1000
溶液25mL,再用0.1000
 溶液滴定过量的草酸溶液至终点,消耗
溶液滴定过量的草酸溶液至终点,消耗 溶液的体积为4mL,则所取液体中
溶液的体积为4mL,则所取液体中 的质量为
的质量为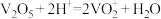 ,
,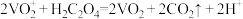 。
。
您最近一年使用:0次
解题方法
9 .  (
(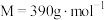 )是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备
)是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备
 并测定其纯度:
并测定其纯度:
Ⅰ.制备
ⅰ.如图连接装置,向三颈烧瓶中依次加入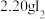 、
、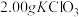 和
和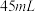 水,然后控制均匀速度滴加少量浓度为
水,然后控制均匀速度滴加少量浓度为 的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成
的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成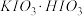 。
。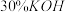 溶液,然后逐滴加入
溶液,然后逐滴加入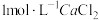 溶液,不断搅拌,生成
溶液,不断搅拌,生成 沉淀;
沉淀;
ⅲ.将混合物冷却后抽滤、依次水洗、醇洗,晾干后得产品;
Ⅱ.测定 产品纯度
产品纯度
ⅳ.称取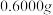 产品于烧杯中,加入
产品于烧杯中,加入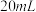 一定浓度
一定浓度 溶液(高氯酸不参与反应),将所得溶液冷却后转移至
溶液(高氯酸不参与反应),将所得溶液冷却后转移至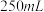 容量瓶中,定容;
容量瓶中,定容;
ⅴ.移取 溶液,加入
溶液,加入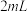 一定浓度
一定浓度 溶液和
溶液和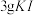 (过量),加
(过量),加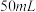 水,用
水,用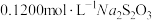 标准液(发生反应:
标准液(发生反应: )滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积
)滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积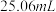 ;
;
ⅵ.做空白实验,平均消耗标准液体积 。
。
回答下列问题:
(1)装置中A处应安装的仪器为________ (填名称);三颈烧瓶的容积最适合的是________ (填选项字母);
A.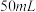 B.
B.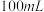 C.
C.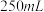 D.
D.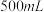
(2)滴加盐酸的仪器选用了恒压滴液漏斗,与分液漏斗相比该仪器的优点为________ ;
(3)步骤ⅰ中,生成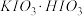 的化学方程式为
的化学方程式为________________ ;
(4)步骤ⅱ中,能够生成 的原因为
的原因为________________ ;
(5)步骤ⅲ中,醇洗的目的是________________ ;
(6)步骤ⅴ中,滴加的指示剂为________ ;滴定终点溶液颜色变化为________ ;
(7) 产品纯度为
产品纯度为________ %(保留两位有效数字)。
 (
(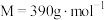 )是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备
)是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备 并测定其纯度:
并测定其纯度:Ⅰ.制备

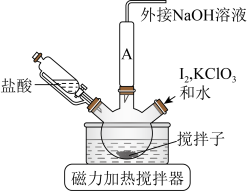
ⅰ.如图连接装置,向三颈烧瓶中依次加入
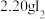 、
、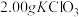 和
和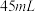 水,然后控制均匀速度滴加少量浓度为
水,然后控制均匀速度滴加少量浓度为 的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成
的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成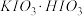 。
。
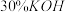 溶液,然后逐滴加入
溶液,然后逐滴加入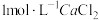 溶液,不断搅拌,生成
溶液,不断搅拌,生成 沉淀;
沉淀;ⅲ.将混合物冷却后抽滤、依次水洗、醇洗,晾干后得产品;
Ⅱ.测定
 产品纯度
产品纯度ⅳ.称取
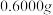 产品于烧杯中,加入
产品于烧杯中,加入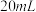 一定浓度
一定浓度 溶液(高氯酸不参与反应),将所得溶液冷却后转移至
溶液(高氯酸不参与反应),将所得溶液冷却后转移至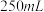 容量瓶中,定容;
容量瓶中,定容;ⅴ.移取
 溶液,加入
溶液,加入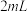 一定浓度
一定浓度 溶液和
溶液和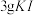 (过量),加
(过量),加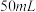 水,用
水,用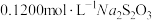 标准液(发生反应:
标准液(发生反应: )滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积
)滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积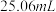 ;
;ⅵ.做空白实验,平均消耗标准液体积
 。
。回答下列问题:
(1)装置中A处应安装的仪器为
A.
 B.
B. C.
C.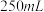 D.
D.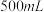
(2)滴加盐酸的仪器选用了恒压滴液漏斗,与分液漏斗相比该仪器的优点为
(3)步骤ⅰ中,生成
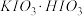 的化学方程式为
的化学方程式为(4)步骤ⅱ中,能够生成
 的原因为
的原因为(5)步骤ⅲ中,醇洗的目的是
(6)步骤ⅴ中,滴加的指示剂为
(7)
 产品纯度为
产品纯度为
您最近一年使用:0次
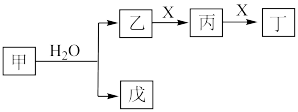
10 . I.某些常见无机物质存在如图的化学转化关系(部分生成物和反应条件略去),回答下列问题:________ 。
(2)若甲是一种淡黄色固体,丙是一种温室气体,则X的化学式为________ ,当 甲和水生成乙和戊时,反应转移电子的物质的量为
甲和水生成乙和戊时,反应转移电子的物质的量为________ 。
(3)若甲是由两种常见的元素组成的化合物,乙是气体且水溶液呈碱性,X为大气中的一种主要成分,写出丁与水反应的化学方程式________ 。戊是氢氧化物,既能和强酸反应又能和强碱反应,则甲的化学式为________ 。
Ⅱ.固体化合物X由3种元素组成,其转化关系如图,混合气体经过无水 时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:
时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:____________ 。
(5)X的化学式为________ ,X能和浓盐酸反应生成黄绿色气体,X在反应中作________ (填“氧化剂”或“还原剂”),若反应了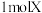 ,该反应转移电子的个数为
,该反应转移电子的个数为________ 。
(2)若甲是一种淡黄色固体,丙是一种温室气体,则X的化学式为
 甲和水生成乙和戊时,反应转移电子的物质的量为
甲和水生成乙和戊时,反应转移电子的物质的量为(3)若甲是由两种常见的元素组成的化合物,乙是气体且水溶液呈碱性,X为大气中的一种主要成分,写出丁与水反应的化学方程式
Ⅱ.固体化合物X由3种元素组成,其转化关系如图,混合气体经过无水
 时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:
时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题: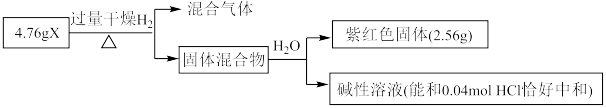
(5)X的化学式为
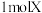 ,该反应转移电子的个数为
,该反应转移电子的个数为
您最近一年使用:0次

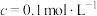 )的pH
)的pH )的pH
)的pH

