1 . 用磷铁渣(含Fe、FeP、Fe2P及少量杂质)制备FePO4·2H2O(磷酸铁)的工艺流程如下:
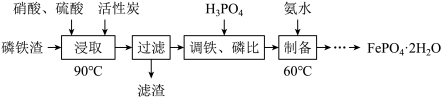
(1)“浸取”时,在密闭反应器中加入硝酸、硫酸及活性炭,硝酸首先分解生成NO2和O2,O2将铁和磷分别氧化为Fe2O3、P2O5。
①Fe2P与O2反应的化学方程式为__________ 。
②加入硫酸的目的是__________ ;加入活性炭能降低有害气体的产生,这是因为__________ 。
③c(HNO3)与磷铁渣溶解率关系,如题图-1所示,当c(HNO3)在1.5~2.0mol·L-1时,磷铁渣溶解率随硝酸的浓度增大而减小的原因是__________
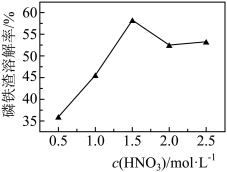 图-1
图-1
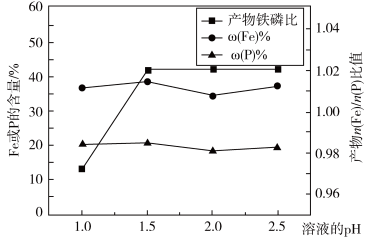 图-2
图-2
(2)“制备”时,溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响,如题图-2所示(考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值])。在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是___________ ;写出生成FePO4·2H2O的离子方程式:__________________________ 。

(1)“浸取”时,在密闭反应器中加入硝酸、硫酸及活性炭,硝酸首先分解生成NO2和O2,O2将铁和磷分别氧化为Fe2O3、P2O5。
①Fe2P与O2反应的化学方程式为
②加入硫酸的目的是
③c(HNO3)与磷铁渣溶解率关系,如题图-1所示,当c(HNO3)在1.5~2.0mol·L-1时,磷铁渣溶解率随硝酸的浓度增大而减小的原因是
 图-1
图-1 图-2
图-2(2)“制备”时,溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响,如题图-2所示(考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值])。在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是
您最近一年使用:0次
名校
2 . 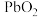 是褐色固体,受热分解为Pb的
是褐色固体,受热分解为Pb的 和
和 价的混合氧化物,
价的混合氧化物, 价的Pb能氧化浓盐酸生成
价的Pb能氧化浓盐酸生成 ,
, 价的Pb还原成
价的Pb还原成 价的Pb;现将
价的Pb;现将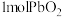 加热分解得到
加热分解得到 ,向剩余固体中加入足量的浓盐酸得到
,向剩余固体中加入足量的浓盐酸得到 ,
, 和
和 的物质的量之比为
的物质的量之比为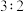 ,则剩余固体的组成及物质的量比是
,则剩余固体的组成及物质的量比是
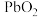 是褐色固体,受热分解为Pb的
是褐色固体,受热分解为Pb的 和
和 价的混合氧化物,
价的混合氧化物, 价的Pb能氧化浓盐酸生成
价的Pb能氧化浓盐酸生成 ,
, 价的Pb还原成
价的Pb还原成 价的Pb;现将
价的Pb;现将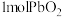 加热分解得到
加热分解得到 ,向剩余固体中加入足量的浓盐酸得到
,向剩余固体中加入足量的浓盐酸得到 ,
, 和
和 的物质的量之比为
的物质的量之比为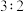 ,则剩余固体的组成及物质的量比是
,则剩余固体的组成及物质的量比是A. 混合的 混合的 、 、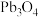 | B.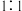 混合的 混合的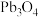 、PbO 、PbO |
C.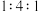 混合的 混合的 、 、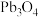 、PbO 、PbO | D.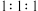 混合的 混合的 、 、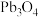 、PbO 、PbO |
您最近一年使用:0次
2020-02-06更新
|
1481次组卷
|
5卷引用:江苏省前黄高级中学2023-2024学年高三上学期第二次阶段考试化学试题
真题
名校
3 . 聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO4·7H2O)和KClO3在水溶液中反应得到。下列说法不正确 的是
| A.KClO3作氧化剂,每生成1 mol [Fe(OH)SO4]n消耗6/n mol KClO3 |
| B.生成聚合硫酸铁后,水溶液的pH增大 |
| C.聚合硫酸铁可在水中形成氢氧化铁胶体而净水 |
| D.在相同条件下,Fe3+比[Fe(OH)]2+的水解能力更强 |
您最近一年使用:0次
2019-04-12更新
|
5924次组卷
|
36卷引用:化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷
化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷2019年4月浙江省普通高校招生选考科目考试化学试题福建省华安一中2018-2019学年高二下学期期末考试化学试题湖南省长沙市第一中学2020届高三第一次月考化学试题江西省宜春市奉新县第一中学2020届高三上学期第二次月考化学试题黑龙江省牡丹江市第一高级中学2020届高三10月月考化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题2020届高考化学小题狂练(全国通用版)专练5 氧化还原反应辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题江西省吉安市五校2019-2020学年高二上学期第二次联考化学试题2020届高三化学化学二轮复习——高考常考题:氧化还原反应的实际应用【精编选择25题】专题1.3 氧化还原反应(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题六 元素化合物的性质、应用及转化(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)广东省佛山市第一中学2020-2021学年高二上学期期中考试化学(选考)试题安徽省池州市第一中学2020-2021学年高二12月月考化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练上海交通大学附属中学2021届高三下学期3月月考化学试题(已下线)课时17 铁及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)3.3.1 盐类的水解-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题05.元素及其化合物-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)湖南省长沙市雅礼中学2022-2023学年高三上学期第五次月考化学试题第三章 金属及其化合物 第13讲 铁及其重要化合物湖南省株洲市第四中学2023届高三第六次月考化学试题(已下线)题型27 铁及其化合物的性质、用途及相关计算重庆市万州第二高级中学2022-2023学年高三下学期5月月考化学试题新疆喀什地区伽师县2022-2023学年高三上学期11月期中考试化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)北京市第八十中学2024届高三上学期10月月考化学试题
4 . 二氧化氯(ClO2)和臭氧(O3)均具有强氧化性,可用于水处理。ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸;O3是一种微溶于水的蓝色气体,其体积分数超过25%时容易引起爆炸。
(1)以FeS2作还原剂,在硫酸介质中还原NaClO3制备ClO2,同时得到Fe2(SO4)3、Na2SO4,该反应的化学方程式为___________________________________________________ 。
(2)以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图1所示。
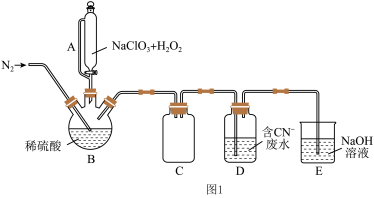
①反应容器B应置于30 ℃左右的水浴中,目的是__________________________________ 。
②通入氮气的目的除了有利于将ClO2排出,还有_________________________________ 。
③ClO2处理含CN-废水的离子方程式为_______________________________________ 。
④装置D的作用是________________________________ 。
(3)某科研机构经多次实验,利用O3、KCl和工业废渣(主要成分为NaNO3和NaNO2)制得KNO3,相关工艺参数如图2和图3[浓缩蒸发水量=m(反应液蒸发的水量)/m(反应液的总质量)]。
请选择最佳实验方案,参与完成他们的制备:将100 g废渣加入80 mL热水中,充分搅拌,__________________________________________ ,在50 ℃恒温水浴锅中充分反应后,过滤,__________________________ ,趁热过滤,________________________ , 过滤得KNO3粗品,再重结晶提纯得到KNO3。(需使用的试剂及用量:60 L 0.008 g/L O3和80 g KCl固体)

(1)以FeS2作还原剂,在硫酸介质中还原NaClO3制备ClO2,同时得到Fe2(SO4)3、Na2SO4,该反应的化学方程式为
(2)以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图1所示。

①反应容器B应置于30 ℃左右的水浴中,目的是
②通入氮气的目的除了有利于将ClO2排出,还有
③ClO2处理含CN-废水的离子方程式为
④装置D的作用是
(3)某科研机构经多次实验,利用O3、KCl和工业废渣(主要成分为NaNO3和NaNO2)制得KNO3,相关工艺参数如图2和图3[浓缩蒸发水量=m(反应液蒸发的水量)/m(反应液的总质量)]。
请选择最佳实验方案,参与完成他们的制备:将100 g废渣加入80 mL热水中,充分搅拌,

您最近一年使用:0次
2019-02-20更新
|
959次组卷
|
3卷引用:【市级联考】江苏省泰州市2019届高三上学期期末考试化学试题
【市级联考】江苏省泰州市2019届高三上学期期末考试化学试题(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测江西省瑞金市第二中学2022-2023学年高三上学期开学考试化学试题
5 . 将甘油(C3H8O3)转化成高附加值产品是当前热点研究方向,甘油和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ: C3H8O3(l)+3H2O(g) 3CO2(g)+7H2(g) ΔH1
3CO2(g)+7H2(g) ΔH1
反应Ⅱ: 2C3H8O3(l)+3O2(g)⇌6CO2(g)+8H2(g) ΔH2=a kJ·mol-1
反应Ⅲ: 2H2(g)+O2(g)⇌2H2O(g) ΔH3=b kJ·mol-1
(1)ΔH1=__________ 。
(2)酸性条件下,甘油可在纳米TiO2Pt复合膜阳极上转化为甘油醛(C3H6O3),该电极方程式为________________________________ 。
(3)硝化甘油(C3H5O9N3)是治疗心绞痛的速效药,也可用作开采矿物的炸药。
①硝化甘油能治疗心绞痛的原理是在人体中释放NO,实验室中也可通过干法制备NO,方程式为3KNO2+KNO3+Cr2O3 2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为
2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为________ mol。
②硝化甘油爆炸时会彻底分解为N2、O2、CO2和H2O,反应的化学方程式为__________________________________________ 。
(4)①反应Ⅰ制备H2时的副产物很多,主要有CH4、C2H4等,生产过程中必须采取措施抑制副产物产生,目的是__________________________________________________________ 。
②为了有效提高反应Ⅰ氢气的产率,研究人员还采用CaO吸附增强制氢的方法。如图1所示,请分析加入CaO提高氢气产率的原因_________________________________________ 。
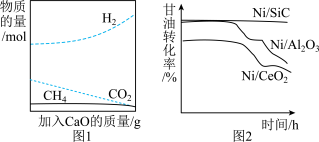
(5)高效的催化剂是这种制氢方法能大规模应用的重要因素。图2为三种不同催化剂在一段时间内与甘油转化率的关系,则Ni/SiC催化剂的优点是________________________________________________________________________ 。
反应Ⅰ: C3H8O3(l)+3H2O(g)
 3CO2(g)+7H2(g) ΔH1
3CO2(g)+7H2(g) ΔH1反应Ⅱ: 2C3H8O3(l)+3O2(g)⇌6CO2(g)+8H2(g) ΔH2=a kJ·mol-1
反应Ⅲ: 2H2(g)+O2(g)⇌2H2O(g) ΔH3=b kJ·mol-1
(1)ΔH1=
(2)酸性条件下,甘油可在纳米TiO2Pt复合膜阳极上转化为甘油醛(C3H6O3),该电极方程式为
(3)硝化甘油(C3H5O9N3)是治疗心绞痛的速效药,也可用作开采矿物的炸药。
①硝化甘油能治疗心绞痛的原理是在人体中释放NO,实验室中也可通过干法制备NO,方程式为3KNO2+KNO3+Cr2O3
 2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为
2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为②硝化甘油爆炸时会彻底分解为N2、O2、CO2和H2O,反应的化学方程式为
(4)①反应Ⅰ制备H2时的副产物很多,主要有CH4、C2H4等,生产过程中必须采取措施抑制副产物产生,目的是
②为了有效提高反应Ⅰ氢气的产率,研究人员还采用CaO吸附增强制氢的方法。如图1所示,请分析加入CaO提高氢气产率的原因

(5)高效的催化剂是这种制氢方法能大规模应用的重要因素。图2为三种不同催化剂在一段时间内与甘油转化率的关系,则Ni/SiC催化剂的优点是
您最近一年使用:0次
名校
解题方法
6 . 聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.747 5 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为[已知:K2Cr2O7+6FeSO4+7H2SO4=K2SO4+Cr2(SO4)3+3Fe2(SO4)3+7H2O]( )
| A.1∶1 | B.2∶1 | C.3∶1 | D.2∶5 |
您最近一年使用:0次
2018-12-15更新
|
1547次组卷
|
7卷引用:2016-2017学年江苏省徐州一中高一上期中化学卷
2016-2017学年江苏省徐州一中高一上期中化学卷(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (题型专练)(已下线)2019年1月2日 《每日一题》高考二轮复习-以物质的量为核心的计算【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高二下学期第三次月考化学试题辽宁省铁岭市六校2020-2021学年高二下学期期末联考化学试题辽宁省沈阳市东北育才学校2020届高三上学期第一次模拟考试化学试题苏教2020版化学必修第二册专题9第三单元 金属材料的性能及应用课后习题
名校
7 . 向400mL 稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出 NO气体 8.96L(标准状况),同时溶液质量增加 13.2g。下列判断正确的是
| A.反应后的溶液中 c(Fe2+)︰c(Fe3+) =1︰2 |
| B.原溶液中投入铁粉物质的量是 0.4 mol |
| C.原溶液中 HNO3 的浓度是 4.0 mol/L |
| D.反应后的溶液中还可溶解 4.8g 铜 |
您最近一年使用:0次
名校
8 . 从定性分析到定量研究是高中生化学学习的重要发展历程。请你根据所学知识对以下化学问题进行定量分析。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O,请用单线桥法标出该反应中电子转移的方向和数目:
6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O________________
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为__________ , 被氧化的N原子的物质的量为__________ 。
(3)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为_________ 、_________ 、_________ 。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O,请用单线桥法标出该反应中电子转移的方向和数目:
6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为
(3)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为
您最近一年使用:0次
2017-12-06更新
|
1330次组卷
|
2卷引用:江苏省东台市创新学校2019届高三上学期9月月考化学试题
解题方法
9 . 天津港“8.12”特别重大爆炸事故教训深刻。氰化钠(N元素显﹣3价)属于剧毒化学品,处理氰化物的方法主要有两种:
(1)碱性氯化法是在碱性条件下通入氯气,氯气将CN﹣氧化成无污染的气体。请补充并配平该反应的离子方程式:CN﹣+OH﹣+Cl2═CO2+ + +H2O。处理35吨NaCN,理论上需要液氯 吨。
(2)过氧化氢氧化法:NaCN+H2O2+H2O═NaHCO3+NH3↑。检测水坑里氰化钠的浓度,取水样1mL,加入11mL1mol•L﹣1H2O2溶液,充分反应后,加入过量的KI固体,充分反应后调节pH至7左右,用0.2500mol•L﹣1Na2S2O3溶液8.00mL(已知:实验中涉及的部分离子方程式为: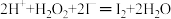 、
、 )。请计算水坑里氰化钠的浓度。
)。请计算水坑里氰化钠的浓度。
(1)碱性氯化法是在碱性条件下通入氯气,氯气将CN﹣氧化成无污染的气体。请补充并配平该反应的离子方程式:CN﹣+OH﹣+Cl2═CO2+ + +H2O。处理35吨NaCN,理论上需要液氯 吨。
(2)过氧化氢氧化法:NaCN+H2O2+H2O═NaHCO3+NH3↑。检测水坑里氰化钠的浓度,取水样1mL,加入11mL1mol•L﹣1H2O2溶液,充分反应后,加入过量的KI固体,充分反应后调节pH至7左右,用0.2500mol•L﹣1Na2S2O3溶液8.00mL(已知:实验中涉及的部分离子方程式为:
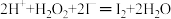 、
、 )。请计算水坑里氰化钠的浓度。
)。请计算水坑里氰化钠的浓度。
您最近一年使用:0次
解题方法
10 . 工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,在空气中煅烧冰铜时,产生一种有刺激性气味的气体A,该气体排放到空气中,是导致酸雨的形成的主要原因。

完成下列填空:
(1)为了降低污染气体A的排放,可选用下列试剂中的________ (填序号)吸收。
a. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d.石灰乳
(2)已知铝在高温下能将某些金属从其氧化物中置换出来。将铝与泡铜发生反应从而得到粗铜。泡铜冶炼粗铜的化学方程式是___________________ 。每当有1mol铝参加反应,则转移电子个数为____________
(3)SO2气体与氢氧化钠反应时,得到的盐为Na2SO3或 NaHSO3。通过计算回答:将0.3 mol SO2通入100mL含0.4 molNaOH溶液中,充分反应后得到的盐物质的量分别是多少?(写出计算过程)___________________

完成下列填空:
(1)为了降低污染气体A的排放,可选用下列试剂中的
a. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d.石灰乳
(2)已知铝在高温下能将某些金属从其氧化物中置换出来。将铝与泡铜发生反应从而得到粗铜。泡铜冶炼粗铜的化学方程式是
(3)SO2气体与氢氧化钠反应时,得到的盐为Na2SO3或 NaHSO3。通过计算回答:将0.3 mol SO2通入100mL含0.4 molNaOH溶液中,充分反应后得到的盐物质的量分别是多少?(写出计算过程)
您最近一年使用:0次



