解题方法
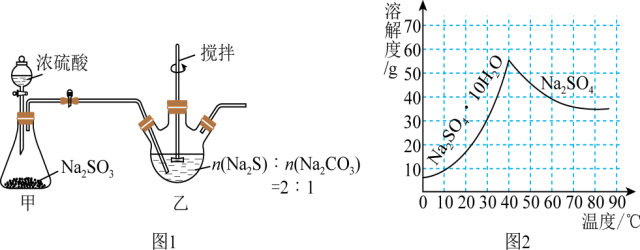
1 . Na2S2O3又名“大苏打”“海波”,易溶于水,难溶于乙醇,水溶液呈微弱的碱性,在中性和碱性环境中稳定。某化学实验小组用如图1装置(略去对乙的加热装置)制备Na2S2O3·5H2O(M=248g·mol-1),已知:Na2SO4溶解度如图2所示。_______ 。
(2)在装置乙中溶解两种固体时,需先将Na2CO3溶于水配成溶液,再将Na2S固体溶于Na2CO3的溶液中,其目的_______ ;装置乙中生成Na2S2O3的总反应方程式为_______ 。
(3)实验过程中,当装置乙中pH接近7.0时,应立即停止通SO2的原因是________ (用离子方程式表示)。
(4)装置乙中需向反应后的混合液加入一定量的无水乙醇,其目的是_______ 。
(5)设计实验测定Na2S2O3·5H2O的纯度:
步骤1:准确称取16.00g样品,溶于水,加入10mL甲醛,配成200mL溶液。
步骤2:准确称取0.294gK2Cr2O7于碘量瓶中,加入 蒸馏水溶解,再加入5mL2mol·L-1硫酸溶液和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
蒸馏水溶解,再加入5mL2mol·L-1硫酸溶液和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL1%淀粉溶液,用待测Na2S2O3溶液滴定碘量瓶中溶液至终点,消耗Na2S2O3溶液 。(已知:I2+2S2O
。(已知:I2+2S2O =2I-+S4O
=2I-+S4O ),试计算Na2S2O3·5H2O的纯度为
),试计算Na2S2O3·5H2O的纯度为_______ (保留三位有效数字)。
(6)利用甲装置中的残渣(Na2SO4和Na2SO3的混合物)制备Na2SO4·10H2O晶体,将下列实验方案补充完整:将固体混合物溶于水配成溶液,_______ ,洗涤、干燥得Na2SO4·10H2O晶体。(实验中须使用氧气、pH计)
(2)在装置乙中溶解两种固体时,需先将Na2CO3溶于水配成溶液,再将Na2S固体溶于Na2CO3的溶液中,其目的
(3)实验过程中,当装置乙中pH接近7.0时,应立即停止通SO2的原因是
(4)装置乙中需向反应后的混合液加入一定量的无水乙醇,其目的是
(5)设计实验测定Na2S2O3·5H2O的纯度:
步骤1:准确称取16.00g样品,溶于水,加入10mL甲醛,配成200mL溶液。
步骤2:准确称取0.294gK2Cr2O7于碘量瓶中,加入
 蒸馏水溶解,再加入5mL2mol·L-1硫酸溶液和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
蒸馏水溶解,再加入5mL2mol·L-1硫酸溶液和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。步骤3:向碘量瓶中加入1mL1%淀粉溶液,用待测Na2S2O3溶液滴定碘量瓶中溶液至终点,消耗Na2S2O3溶液
 。(已知:I2+2S2O
。(已知:I2+2S2O =2I-+S4O
=2I-+S4O ),试计算Na2S2O3·5H2O的纯度为
),试计算Na2S2O3·5H2O的纯度为(6)利用甲装置中的残渣(Na2SO4和Na2SO3的混合物)制备Na2SO4·10H2O晶体,将下列实验方案补充完整:将固体混合物溶于水配成溶液,
您最近一年使用:0次
2022-12-15更新
|
681次组卷
|
5卷引用:浙江省Lambda联盟2023-2024学年高三下学期第一次联考化学试题
浙江省Lambda联盟2023-2024学年高三下学期第一次联考化学试题浙江省2024届高三下学期5月选考适应性考试化学试题山东省菏泽市2022届高三二模考试化学试题(已下线)化学(福建A卷)-学易金卷:2023年高考第一次模拟考试(已下线)二轮专题强化练 大题突破2 综合实验题题型研究
2022·浙江·模拟预测
解题方法
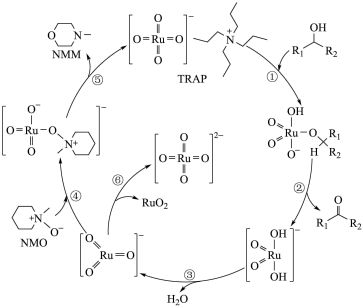
2 .  是一种温和的氧化剂,
是一种温和的氧化剂, 试剂中的RuO
试剂中的RuO 不会氧化碳碳双键,可以将醇仅氧化至醛,不会过度氧化为羧酸。
不会氧化碳碳双键,可以将醇仅氧化至醛,不会过度氧化为羧酸。 氧化醇的反应机理如下图,下列说法不正确的是
氧化醇的反应机理如下图,下列说法不正确的是
 是一种温和的氧化剂,
是一种温和的氧化剂, 试剂中的RuO
试剂中的RuO 不会氧化碳碳双键,可以将醇仅氧化至醛,不会过度氧化为羧酸。
不会氧化碳碳双键,可以将醇仅氧化至醛,不会过度氧化为羧酸。 氧化醇的反应机理如下图,下列说法不正确的是
氧化醇的反应机理如下图,下列说法不正确的是
| A.在上述6步反应中发生氧化还原反应的不只2步 |
B.步骤④⑤中NMO将RuO 还原,生成 还原,生成 试剂 试剂 |
C.步骤⑥的离子方程式为2RuO = RuO2+ RuO = RuO2+ RuO |
D.若R1为CH3CH=CH-,R2为-H,则 氧化该醇的主产物为2-丁烯醛 氧化该醇的主产物为2-丁烯醛 |
您最近一年使用:0次
名校
解题方法
3 . 已知:将Cl2通入适量NaOH溶液中,反应会放热,当温度升高后会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O。则Cl2通入NaOH溶液的产物中可能有NaCl、NaClO、NaClO3中的两种或三种,且 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是| A.与碱的反应中,Cl2既是氧化剂又是还原剂 |
| B.参加反应的Cl2物质的量为0.5a mol |
C.若某温度下,反应后 =6,则溶液中 =6,则溶液中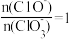 |
D.改变温度,反应中转移电子的物质的量可能为 mol mol |
您最近一年使用:0次
2022-10-24更新
|
2107次组卷
|
12卷引用:浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试(选考)化学试题
浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试(选考)化学试题江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题山东省实验中学2022-2023学年高一上学期11月期中考试化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高一上学期期中考试化学(A卷)试题北京市第八中学2022-2023学年高一上学期12月月考化学试题陕西省榆林中学2022-2023学年高一上学期期末考试化学试题江苏省苏州中学2022-2023学年高一下学期开学考试化学试题陕西省安康市2022-2023学年高一下学期开学摸底考试化学试题辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题 山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题(已下线)专题03 氧化还原反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
名校
4 . 金属铬是硬度最高的金属,常用于制造不锈钢和仪器仪表的金属表面镀铬,可用铬铁矿(主要成分为FeCr2O4,含有SiO2、Al2O3等杂质)冶炼金属铬,冶炼流程如下。

已知:4FeCr2O4+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2、Al2O3+Na2CO3
8Na2CrO4+2Fe2O3+8CO2、Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
回答下列问题:
(1)实验室氧化煅烧时需用到的仪器有坩埚、___________ 、坩埚钳、三脚架、酒精灯。
(2)下列说法正确的是___________。
(3)相关物质的溶解度曲线如图。步骤⑤需先得到较纯的Na2Cr2O7·2H2O晶体,请给出操作的正确顺序:(操作可重复)d→ → → →c→e→ → →c→e。___________

a.将溶液(或滤液)蒸发至溶液表面出现晶膜
b.在60 ℃蒸发溶剂
c.冷却至室温
d.在100 ℃蒸发溶剂
e.过滤
(4)步骤⑥除生成Cr2O3外,还生成了Na2CO3和CO,写出该反应的化学方程式:___________ 。
(5)工业上用铝粉还原Cr2O3而不用C粉还原得到单质铬的原因是___________ 。
(6)为了测定Na2Cr2O7产品的纯度,可采用FeSO4标准溶液通过氧化还原反应滴定Na2Cr2O7溶液。下列关于滴定分析的操作,不正确 的是___________ 。
A.用移液管量取25.00 mL待测液转移至锥形瓶
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.排气泡时应使管尖弯曲向上,用右手挤压玻璃珠上方,使液面充满管尖
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.第一次滴定终点时,若测得消耗标准液体积小于5.00 mL,则第二次滴定时可稀释标准溶液后重新滴定来减小误差

已知:4FeCr2O4+8Na2CO3+7O2
 8Na2CrO4+2Fe2O3+8CO2、Al2O3+Na2CO3
8Na2CrO4+2Fe2O3+8CO2、Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑回答下列问题:
(1)实验室氧化煅烧时需用到的仪器有坩埚、
(2)下列说法正确的是___________。
| A.步骤①可通过加热方式加快浸出速率 |
| B.步骤②③均可采用减压过滤的方法加快过滤速度 |
| C.步骤③为调节溶液pH可以加入适量的碱性溶液 |
| D.步骤④中可用盐酸代替硫酸调节溶液酸碱性 |

a.将溶液(或滤液)蒸发至溶液表面出现晶膜
b.在60 ℃蒸发溶剂
c.冷却至室温
d.在100 ℃蒸发溶剂
e.过滤
(4)步骤⑥除生成Cr2O3外,还生成了Na2CO3和CO,写出该反应的化学方程式:
(5)工业上用铝粉还原Cr2O3而不用C粉还原得到单质铬的原因是
(6)为了测定Na2Cr2O7产品的纯度,可采用FeSO4标准溶液通过氧化还原反应滴定Na2Cr2O7溶液。下列关于滴定分析的操作,
A.用移液管量取25.00 mL待测液转移至锥形瓶
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.排气泡时应使管尖弯曲向上,用右手挤压玻璃珠上方,使液面充满管尖
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.第一次滴定终点时,若测得消耗标准液体积小于5.00 mL,则第二次滴定时可稀释标准溶液后重新滴定来减小误差
您最近一年使用:0次
2022高三·全国·专题练习
5 . 化学上常用标准电极电势φ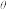 (氧化型/还原型)比较物质氧化能力。φ
(氧化型/还原型)比较物质氧化能力。φ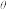 值越高,氧化型物质的氧化能力越强,φ
值越高,氧化型物质的氧化能力越强,φ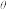 值与体系的pH有关。利用表格所给的数据分析,以下说法错误的是
值与体系的pH有关。利用表格所给的数据分析,以下说法错误的是
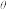 (氧化型/还原型)比较物质氧化能力。φ
(氧化型/还原型)比较物质氧化能力。φ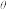 值越高,氧化型物质的氧化能力越强,φ
值越高,氧化型物质的氧化能力越强,φ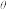 值与体系的pH有关。利用表格所给的数据分析,以下说法错误的是
值与体系的pH有关。利用表格所给的数据分析,以下说法错误的是| 氧化型/还原型 | φ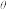 (Co3+/Co2+) (Co3+/Co2+) | φ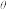 (HClO/Cl-) (HClO/Cl-) |
| 酸性介质 | 1.84V | 1.49V |
| 氧化型/还原型 | φ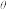 [Co(OH)3/Co(OH)2] [Co(OH)3/Co(OH)2] | φ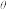 (ClO-/Cl-) (ClO-/Cl-) |
| 碱性介质 | 0.17V | x |
| A.推测:x<1.49V |
| B.Co3O4与浓盐酸发生反应:Co3O4+8H+=Co2++2Co3++4H2O |
| C.若x=0.81V,碱性条件下可发生反应:2Co(OH)2+NaClO+H2O=2Co(OH)3+NaCl |
| D.从图中数据可知,氧化型物质的氧化性随着溶液酸性增强而增强 |
您最近一年使用:0次
名校
6 . 液态化合物 是电镀行业的重要试剂,由中学阶段常见的5种元素组成。某小组按如下流程进行实验:
是电镀行业的重要试剂,由中学阶段常见的5种元素组成。某小组按如下流程进行实验:
实验1: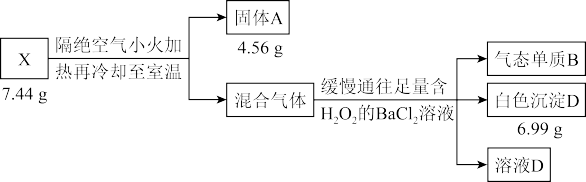
实验2:
已知:物质 与
与 溶液的反应属于非氧化还原反应。请回答:
溶液的反应属于非氧化还原反应。请回答:
(1)组成 的元素有
的元素有_______ , 的化学式为
的化学式为_______ 。
(2) 与浓
与浓 溶液共热的化学方程式为
溶液共热的化学方程式为_______ 。
(3)溶液 中的溶质有:
中的溶质有: 、
、 、
、_______ (填化学式)。
(4)溶液 中存在动态平衡,某同学欲探究物质浓度对该平衡的影响,已有方案:
中存在动态平衡,某同学欲探究物质浓度对该平衡的影响,已有方案:
①向溶液 中加
中加 固体,观察现象;
固体,观察现象;
②向溶液 中加浓
中加浓 溶液,观察现象;
溶液,观察现象;
请设计方案③:_______ (写出操作、现象及相应结论)。
 是电镀行业的重要试剂,由中学阶段常见的5种元素组成。某小组按如下流程进行实验:
是电镀行业的重要试剂,由中学阶段常见的5种元素组成。某小组按如下流程进行实验:实验1:

实验2:

已知:物质
 与
与 溶液的反应属于非氧化还原反应。请回答:
溶液的反应属于非氧化还原反应。请回答:(1)组成
 的元素有
的元素有 的化学式为
的化学式为(2)
 与浓
与浓 溶液共热的化学方程式为
溶液共热的化学方程式为(3)溶液
 中的溶质有:
中的溶质有: 、
、 、
、(4)溶液
 中存在动态平衡,某同学欲探究物质浓度对该平衡的影响,已有方案:
中存在动态平衡,某同学欲探究物质浓度对该平衡的影响,已有方案:①向溶液
 中加
中加 固体,观察现象;
固体,观察现象;②向溶液
 中加浓
中加浓 溶液,观察现象;
溶液,观察现象;请设计方案③:
您最近一年使用:0次
2022-03-21更新
|
1332次组卷
|
7卷引用:浙江省金丽衢十二校,七彩联盟2021-2022学年高三下学期3月阶段性联考化学试题
浙江省金丽衢十二校,七彩联盟2021-2022学年高三下学期3月阶段性联考化学试题 (已下线)化学-2022年高考押题预测卷03(浙江卷)(已下线)化学-2022年高考考前押题密卷(浙江卷)浙江省2022届高三考前第三次模拟考试化学试题(已下线)回归教材重难点02 常见无机物转化及应用-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点02 常见无机物转化及应用-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)新疆乌鲁木齐市第六十八中学2023-2024学年高三下学期2月月考化学试题
名校
解题方法
7 . X、Y、Z、M为短周期元素,原子序数依次增大。A~J均由该四种元素构成的单质或化合物,其转化关系如图所示,部分生成物省略。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是___________ ;D的电子式是___________ 。
(2)请写出金属单质E在生产生活中的一种作用___________ 。
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是___________ ;B在制备过程中,气体A需要过量的理由是___________ 。
(4)写出F和G反应生成H和A的化学方程式是___________ 。
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)___________ 。
(6)写出J在已知②条件下受热分解的化学方程式是___________ 。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是
(2)请写出金属单质E在生产生活中的一种作用
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是
(4)写出F和G反应生成H和A的化学方程式是
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)
(6)写出J在已知②条件下受热分解的化学方程式是
您最近一年使用:0次
2021-11-05更新
|
1096次组卷
|
2卷引用:浙江省诸暨市2018-2019学年高二下学期期末考试化学试题
20-21高二下·浙江·阶段练习
8 . 某兴趣小组对化合物X开展实验探究。
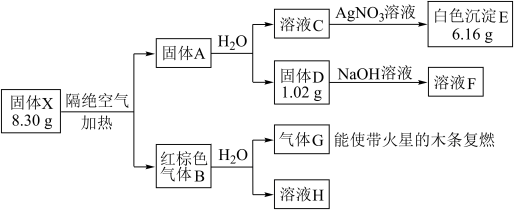
其中:X是易溶于水的强酸盐,由4种元素组成;D、E、G均为纯净物,B为混合物;溶液C、F、H均为单一溶质溶液,溶液H中含溶质0.06 mol,溶液C的焰色反应通过蓝色钴玻璃观察为紫色。
(1)组成X的4种元素是_______________ (填元素符号),E的化学式是______________ 。
(2)固体X隔绝空气加热分解的化学方程式____________________________ 。
(3)写出溶液F与少量溶液H反应的离子方程式____________________________ 。
(4)标况下,将红棕色气体B收集在一个大试管中,再倒插在水槽中,得到溶液的浓度为_______ mol/L (设溶质不扩散,)。
(5)写出红棕色气体B中的化合物气体(在答案中写出化学式)与溴蒸气的鉴别方法:______________ 。

其中:X是易溶于水的强酸盐,由4种元素组成;D、E、G均为纯净物,B为混合物;溶液C、F、H均为单一溶质溶液,溶液H中含溶质0.06 mol,溶液C的焰色反应通过蓝色钴玻璃观察为紫色。
(1)组成X的4种元素是
(2)固体X隔绝空气加热分解的化学方程式
(3)写出溶液F与少量溶液H反应的离子方程式
(4)标况下,将红棕色气体B收集在一个大试管中,再倒插在水槽中,得到溶液的浓度为
(5)写出红棕色气体B中的化合物气体(在答案中写出化学式)与溴蒸气的鉴别方法:
您最近一年使用:0次
19-20高二·浙江·期中
名校
9 . 由一种阳离子与两种酸根离子组成的盐称为混盐,CaOCl2是一种常见的混盐,下列说法不正确的是
| A.CaOCl2有较强的氧化性 |
| B.CaOCl2水溶液呈碱性 |
| C.由氯气为原料,每生成1 mol CaOCl2,转移的电子数为2NA |
| D.CaOCl2的溶液中加入足量浓硫酸,可有黄绿色的气体产生 |
您最近一年使用:0次
名校
解题方法
10 . 取一定质量的NaBr、NaI的混合物平均分成五等分,分别加水配成溶液并编号为甲、乙、丙、丁、戊,再分别向各溶液中通入一定体积的氯气,将反应后所得溶液蒸干灼烧得固体,通入氯气的体积与最终所得固体质量记录如下:
下列实验结论正确的是
| 编号 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 固体组成 | NaCl | ||||
| Cl2的体积/mL | V | 2V | 3V | 4V | 5V |
| 固体质量/g | 54.62 | 43.64 | 35.48 | 30.14 | 29.25 |
| A.甲溶液中发生的反应是Cl2+2Br-=2Cl-+Br2 |
| B.乙中固体组成为NaBr、NaCl |
| C.标准状况下Cl2的体积V为2688mL |
| D.原混合物中NaBr的物质的量为1mol |
您最近一年使用:0次
2020-11-19更新
|
1664次组卷
|
5卷引用:解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)广东省深圳外国语学校2021届高三第二次月考化学试题(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)江西省赣州市全南中学2023-2024学年高三上学期11月期中考试化学试题



