2013·河北石家庄·二模
1 . 世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色” 消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备C1O2的流程如下:
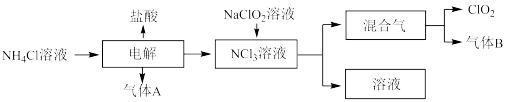
(1)C1O2中所有原子______(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用______
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是______(填选项字母)。
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,化学方程式为______ 。此法缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式为______ 此法相比欧洲方法的优点是______ 。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学方程式为______ 。此法提高了生产及储存、运输的安全性,原因是______

(1)C1O2中所有原子______(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用______
| A.饱和食盐水B.碱石灰 C.浓硫酸D.蒸馏水 |
| A.二氧化氯可广泛用于工业和饮用水处理 |
| B.二氧化氯应用在食品工业中能有效地延长食品贮藏期 |
| C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围 |
| D.在工作区和成品储藏室内,要有通风装置和检测及警报装置 |
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式为
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学方程式为
您最近一年使用:0次
2019-01-30更新
|
1051次组卷
|
6卷引用:2016届河南省三门峡市陕州中学高三下学期尖子生专题训练五化学试卷
2016届河南省三门峡市陕州中学高三下学期尖子生专题训练五化学试卷(已下线)2013届河北省石家庄市高中毕业班第二次模拟考试理综化学试卷(已下线)2014届湖北省孝感市高三第二次统考理综化学试卷(已下线)2014届江西省金溪一中高三理科综合训练题(三)化学试卷(已下线)2013届江西省临川一中高三最后一次模拟考试理科综合试卷2016届黑龙江省哈尔滨三中高三上第三次检测理综化学试卷
2 . 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如下:
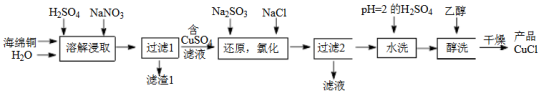
(1)“溶解浸取”时,需将海绵铜粉碎成细颗粒,其目的是___________ 。
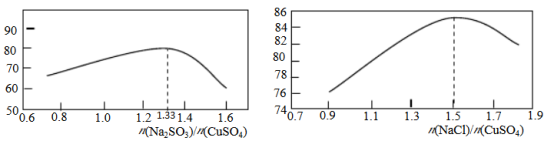
(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图所示:
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为___________ 。
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是___________ 。
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是___________ 。
(3)“粗产品”用pH=2的H2SO4水洗,若不慎用稀硝酸进行稀释,则对产品有何影响___________ 。
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为______________________ 。
(5)某同学拟测定产品中氯化亚铜的质量分数。实验过程如下:准确称取制备的氯化亚铜产品1.600g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.2000mol·L-1的KMnO4标准溶液滴定到终点,消耗KMnO4溶液15.00mL,反应中MnO4-被还原为Mn2+,则产品中氯化亚铜的质量分数为______________________ 。

(1)“溶解浸取”时,需将海绵铜粉碎成细颗粒,其目的是

(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图所示:
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是
(3)“粗产品”用pH=2的H2SO4水洗,若不慎用稀硝酸进行稀释,则对产品有何影响
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为
(5)某同学拟测定产品中氯化亚铜的质量分数。实验过程如下:准确称取制备的氯化亚铜产品1.600g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.2000mol·L-1的KMnO4标准溶液滴定到终点,消耗KMnO4溶液15.00mL,反应中MnO4-被还原为Mn2+,则产品中氯化亚铜的质量分数为
您最近一年使用:0次
名校
3 . A2、B2、C23种单质和它们离子间能发生下列反应2A- + C2 = 2C- + A2、2C- + B2 = 2B- + C2。若X-能与C2发生反应2X- + C2 = 2C- + X2有关说法中不正确的是( )
| A.氧化性B2>C2>A2 | B.还原性X->C->B- |
| C.X2与B-能发生反应 | D.B2与X-能发生反应 |
您最近一年使用:0次
2017-11-16更新
|
146次组卷
|
4卷引用:河南省许昌市长葛市第一高级中学2019-2020学年高一下学期期末考试化学试题
名校
4 . NH3和NO2在催化剂作用下反应:8NH3+6NO2=7N2+12H2O。若还原产物比氧化产物少0.1 mol,则下列判断正确的是( )
| A.转移电子3.6NA | B.生成气体的体积32.56 L(标准状况) |
| C.还原剂比氧化剂多0.2 mol | D.被还原的氮原子是11.2 g |
您最近一年使用:0次
2017-10-17更新
|
1385次组卷
|
7卷引用:河南省周口市中英文学校2020-2021学年高三上学期第一次月考化学试题
解题方法
5 . 含氮的化合物在化学反应中变化复杂。I.现用下图所示仪器(夹持装置已省略及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。已知:①NO+NO2+2OH-=2NO2-+H2O;②气体液化的温度:NO2 21℃、NO -152℃。
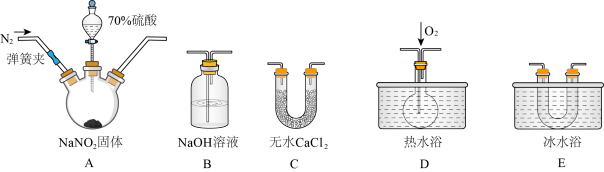
(1)为了检验装置A中生成的气体产物,上述仪器的连接顺序(按左→右连接)为__________ 。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:____________ 。
(3)在关闭弹簧夹,滴入70%硫酸后,A中产生红棕色气体。
①盛装70%浓硫酸的仪器名称是___________ ;
②实验确认有NO的现象是______________________ 。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是______________ 。
Ⅱ.NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示。


图1 图2
【资料卡片】
a.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
b.在230℃ 以上时,同时有弱光:2NH4NO3=2N2↑+ O2↑+ 4H2O
c.在400℃以上时,剧烈分解发生爆炸:4NH4NO3=3N2↑+ 2NO2↑+ 8H2O
(5)如图2 将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因_______________ 。
(6)实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是____________ (填“能”或“不能”)_____ 用硝酸铵代替氯化铵。
(7)在汽车发生碰撞时,NaN3会产生________ (填化学式)气体充满安全气囊来减轻碰撞事故中乘员伤害程度。
(8)完成离子反应IV:______ NO+ _______ H2O=______ +______ +____ H+。

(1)为了检验装置A中生成的气体产物,上述仪器的连接顺序(按左→右连接)为
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:
(3)在关闭弹簧夹,滴入70%硫酸后,A中产生红棕色气体。
①盛装70%浓硫酸的仪器名称是
②实验确认有NO的现象是
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是
Ⅱ.NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示。


图1 图2
【资料卡片】
a.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
b.在230℃ 以上时,同时有弱光:2NH4NO3=2N2↑+ O2↑+ 4H2O
c.在400℃以上时,剧烈分解发生爆炸:4NH4NO3=3N2↑+ 2NO2↑+ 8H2O
(5)如图2 将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因
(6)实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是
(7)在汽车发生碰撞时,NaN3会产生
(8)完成离子反应IV:
您最近一年使用:0次
2016-12-09更新
|
749次组卷
|
2卷引用:河南省中原名校(即豫南九校)2017-2018学年高一上学期期末联考化学试题
名校
6 . 8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
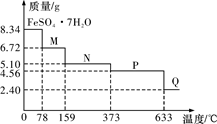

| A.温度为78 ℃时固体物质M的化学式为FeSO4·5H2O |
| B.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4 |
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O FeSO4+H2O FeSO4+H2O |
| D.温度为159 ℃时固体N的化学式为FeSO4·2H2O |
您最近一年使用:0次
2016-12-09更新
|
3470次组卷
|
10卷引用:河南省洛阳市六校联考2022-2023学年高三上学期月考化学试题
名校
解题方法
7 . 向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中正确的是
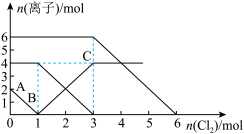

| A.离子的还原性顺序为:Fe2+>Br->I- |
| B.原混合溶液中FeBr2的物质的量为4mol |
| C.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
| D.当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
您最近一年使用:0次
2016-12-09更新
|
1854次组卷
|
7卷引用:2016届河南省西华县第一高级中学高三上学期10月联考化学试卷
名校
8 . 有一硝酸盐晶体,其化学式为R(NO3)x·yH2O,相对分子质量为242。 取1.21 g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.32g。下列叙述正确的是
| A.x=3 |
| B.金属R的相对原子质量为56 |
| C.y=2 |
| D.电解后溶液的pH=1(电解过程中溶液体积变化忽略不计) |
您最近一年使用:0次
2016-12-09更新
|
1179次组卷
|
3卷引用:河南省驻马店高级中学2023-2024学年高二上学期12月测试化学试题
名校
9 . 钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业上利用碘、烧碱和铁屑为原料可生产碘化钠,其生产流程如图所示:
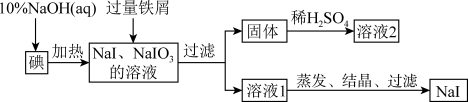
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为________________________________ 。
(2)生产流程中加入过量铁屑的目的是___________________ ,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是_________ 。
(3)溶液2中除含有H+外,一定含有的阳离子是__________________ ;试设计实验证实该金属阳离子的存在:____________________________ 。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:__________________________ ;
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式:________________ 。

(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为
(2)生产流程中加入过量铁屑的目的是
(3)溶液2中除含有H+外,一定含有的阳离子是
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式:
您最近一年使用:0次
2016-12-09更新
|
921次组卷
|
6卷引用:2015届河南周口市高三3月教学质量监测理综化学试卷
解题方法
10 . 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是____________ 。
(2)调节pH,实验记录如下:
查阅资料得知:
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是____________ 。
②推测a中白色沉淀为Ag2SO4,推测的依据是____________ 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于_________ 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是_____________ 。
②根据实验现象,分析X的性质和元素组成是____________ 。
③Ⅱ中反应的化学方程式是____________ 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:

①气体Y是___________ 。
②白色沉淀转化为X的化学方程式是____________ 。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是
(2)调节pH,实验记录如下:
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是
②推测a中白色沉淀为Ag2SO4,推测的依据是
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是
②根据实验现象,分析X的性质和元素组成是
③Ⅱ中反应的化学方程式是
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:

①气体Y是
②白色沉淀转化为X的化学方程式是
您最近一年使用:0次
2016-12-09更新
|
845次组卷
|
4卷引用:2017届河南省鹤壁高级中学高三上第三次周练化学试卷



