1 . 聚合硫酸铁(Ⅲ)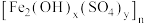 是一种新型、高效铁盐类无机高分子絮凝剂,工业上用高硫铝土矿(主要成分为
是一种新型、高效铁盐类无机高分子絮凝剂,工业上用高硫铝土矿(主要成分为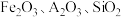 、少量
、少量 )为原料制备聚合硫酸铁的部分工艺流程如图所示。下列说法正确的是
)为原料制备聚合硫酸铁的部分工艺流程如图所示。下列说法正确的是
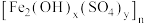 是一种新型、高效铁盐类无机高分子絮凝剂,工业上用高硫铝土矿(主要成分为
是一种新型、高效铁盐类无机高分子絮凝剂,工业上用高硫铝土矿(主要成分为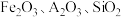 、少量
、少量 )为原料制备聚合硫酸铁的部分工艺流程如图所示。下列说法正确的是
)为原料制备聚合硫酸铁的部分工艺流程如图所示。下列说法正确的是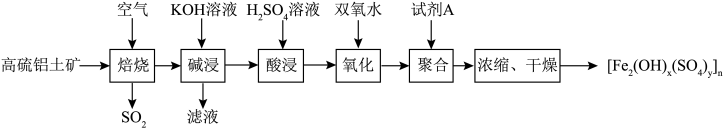
A.“焙烧”过程中若生成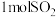 ,则转移 ,则转移 电子 电子 |
B.“滤液”中含有的阴离子主要为 |
| C.“聚合”过程中试剂A作还原剂,使各种离子发生聚合 |
| D.实际生产过程中,为了加快反应速率,整个流程均选择高温条件 |
您最近一年使用:0次
名校
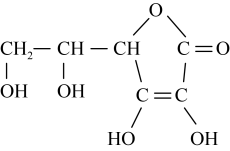
2 . 研究有机物的结构和性质对生产生活意义深远。
 .已知A-F六种有机化合物,根据要求回答问题。
.已知A-F六种有机化合物,根据要求回答问题。___________ ,B物质的分子式为:___________ 。
(2)按官能团分类,D所属的类别是___________ 。
(3)1molE与足量的金属钠反应产生___________ L氢气(标况下)。
(4)实验室制取C的化学方程式___________ 。
 .蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被
.蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被 等氧化剂氧化为脱氢维生素C.根据要求回答问题。
等氧化剂氧化为脱氢维生素C.根据要求回答问题。___________ (填名称)。
(6)脱氢维生素C中,键角①___________ 键角②(填“>”、“=”或“<”)。
(7)向碘和淀粉溶液中加入维生素C,可能观察到的现象是___________ 。
(8)标出维生素C中所有的手性碳原子(用*标注)___________ 。
 .已知A-F六种有机化合物,根据要求回答问题。
.已知A-F六种有机化合物,根据要求回答问题。A. 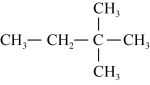 B.
B. 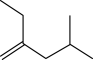 C.
C. D.
D. 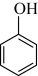 E.
E.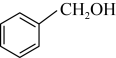
(2)按官能团分类,D所属的类别是
(3)1molE与足量的金属钠反应产生
(4)实验室制取C的化学方程式
 .蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被
.蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被 等氧化剂氧化为脱氢维生素C.根据要求回答问题。
等氧化剂氧化为脱氢维生素C.根据要求回答问题。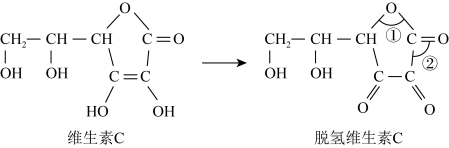
(6)脱氢维生素C中,键角①
(7)向碘和淀粉溶液中加入维生素C,可能观察到的现象是
(8)标出维生素C中所有的手性碳原子(用*标注)
您最近一年使用:0次
解题方法
3 . 化学让生活更加美好。下列对化学物质的使用所作的解释不正确的是
选项 | 化学物质的使用 | 解释 |
A | 滴眼液中含有微量硝酸银 | 银离子可使蛋白质变性 |
B | 用氢氟酸雕刻玻璃 |
|
C | 用铝罐盛放浓硫酸 | 浓硫酸不与 |
D | 维生素C常用作抗氧化剂 | 维生素C能被氧化为脱氢抗坏血酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-24更新
|
155次组卷
|
2卷引用:广东省部分学校2024届高三下学期5月份大联考化学试题
4 . [Cu(NH3)4]SO4•H2O是铜的重要配合物,其制备原料之一CuSO4可用废铜屑制备,其实验方案如下:
方案1:先灼烧废铜屑,再溶于稀硫酸,经系列操作得到CuSO4•5H2O;
方案2:加热废铜屑和98.3%硫酸的混合物;
方案3:在废铜屑和稀硫酸的混合液中滴加双氧水;
方案4:在废铜屑和稀硫酸的混合液中通入热空气。
下列叙述错误的是
方案1:先灼烧废铜屑,再溶于稀硫酸,经系列操作得到CuSO4•5H2O;
方案2:加热废铜屑和98.3%硫酸的混合物;
方案3:在废铜屑和稀硫酸的混合液中滴加双氧水;
方案4:在废铜屑和稀硫酸的混合液中通入热空气。
下列叙述错误的是
| A.方案1使用的玻璃仪器有烧杯、分液漏斗、玻璃棒和酒精灯 |
| B.方案2中参与反应的硫酸利用率为50%,且产生大气污染物 |
| C.方案3的离子方程式为Cu+H2O2+2H+=Cu2++2H2O |
D.方案4的化学方程式为2Cu+H2SO4+O2 2CuSO4+2H2O 2CuSO4+2H2O |
您最近一年使用:0次
名校
解题方法
5 . 锑白 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的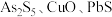 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: ;
;
②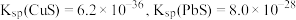 。
。
回答下列问题:
(1)“粉碎”辉锑矿的目的是___________ 。
(2)“滤渣Ⅰ”的主要成分除不溶性杂质外还有S、___________ (填化学式); 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为___________ 。
(3)“除砷”时,反应中氧化剂与还原剂的物质的量之比为___________ (P转化为最高价态)。
(4)若浸取液中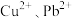 的浓度均为
的浓度均为 ,则c(S2-)≥
,则c(S2-)≥___________  才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时
才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时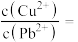
___________ 。
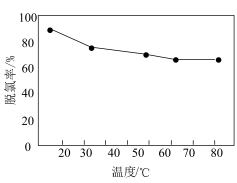
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:___________ 。
(6)锑可用于制备超亮光电极材料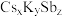 ,其晶胞结构如图所示,晶体a的化学式为
,其晶胞结构如图所示,晶体a的化学式为___________ ,晶体b中与 距离最近的
距离最近的 的个数为
的个数为___________ 。
 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: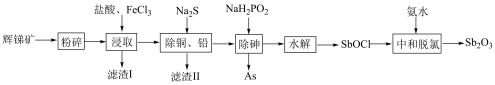
 ;
;②
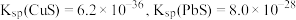 。
。回答下列问题:
(1)“粉碎”辉锑矿的目的是
(2)“滤渣Ⅰ”的主要成分除不溶性杂质外还有S、
 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为(3)“除砷”时,反应中氧化剂与还原剂的物质的量之比为
(4)若浸取液中
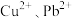 的浓度均为
的浓度均为 ,则c(S2-)≥
,则c(S2-)≥ 才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时
才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时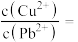
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:
(6)锑可用于制备超亮光电极材料
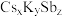 ,其晶胞结构如图所示,晶体a的化学式为
,其晶胞结构如图所示,晶体a的化学式为 距离最近的
距离最近的 的个数为
的个数为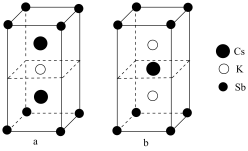
您最近一年使用:0次
解题方法
6 . 三氯氧钒( )是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。某兴趣小组利用如图所示装置以氯气、
)是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。某兴趣小组利用如图所示装置以氯气、 和碳粉为原料制备三氯氧钒。
和碳粉为原料制备三氯氧钒。 ;熔点为-77℃,沸点为126℃;
;熔点为-77℃,沸点为126℃;
②三氯氧钒遇水会迅速水解生成HCl和一种氧化物。
回答下列问题:
(1)仪器X的名称为___________ ,仪器Y为球形冷凝管,冷却水应从___________ 口(填“M”或“N”)进入。仪器X可以换为如图装置,其优点是___________ 。 ,正确的连接顺序为
,正确的连接顺序为___________ →d→e→h(按气流方向,用小写字母表示,装置可重复使用)。
(3)装置C的作用是为了防止___________ 反应发生(写化学方程式)。
(4)管式炉中发生反应生成CO的化学方程式为___________ 。
(5)已知: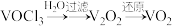 ,
, 的立方晶胞结构如图所示,晶胞参数为a pm。
的立方晶胞结构如图所示,晶胞参数为a pm。___________ 。
②晶体的密度为___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(6)取装置B烧瓶中的液体少许,先溶于水再过滤,在滤渣中加入稀硫酸溶解后,向其中加入0.2000
 溶液25mL,再用0.1000
溶液25mL,再用0.1000
 溶液滴定过量的草酸溶液至终点,消耗
溶液滴定过量的草酸溶液至终点,消耗 溶液的体积为4mL,则所取液体中
溶液的体积为4mL,则所取液体中 的质量为
的质量为___________ g(保留1位小数)。已知: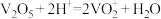 ,
,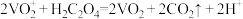 。
。
 )是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。某兴趣小组利用如图所示装置以氯气、
)是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。某兴趣小组利用如图所示装置以氯气、 和碳粉为原料制备三氯氧钒。
和碳粉为原料制备三氯氧钒。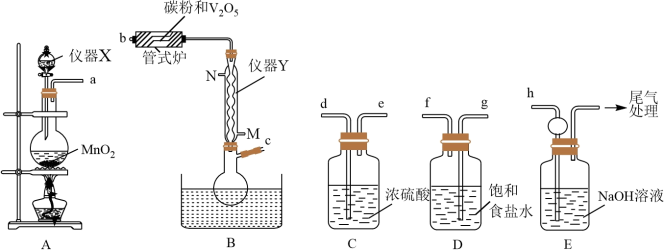
 ;熔点为-77℃,沸点为126℃;
;熔点为-77℃,沸点为126℃;②三氯氧钒遇水会迅速水解生成HCl和一种氧化物。
回答下列问题:
(1)仪器X的名称为

 ,正确的连接顺序为
,正确的连接顺序为(3)装置C的作用是为了防止
(4)管式炉中发生反应生成CO的化学方程式为
(5)已知:
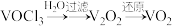 ,
, 的立方晶胞结构如图所示,晶胞参数为a pm。
的立方晶胞结构如图所示,晶胞参数为a pm。
②晶体的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。(6)取装置B烧瓶中的液体少许,先溶于水再过滤,在滤渣中加入稀硫酸溶解后,向其中加入0.2000

 溶液25mL,再用0.1000
溶液25mL,再用0.1000
 溶液滴定过量的草酸溶液至终点,消耗
溶液滴定过量的草酸溶液至终点,消耗 溶液的体积为4mL,则所取液体中
溶液的体积为4mL,则所取液体中 的质量为
的质量为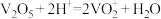 ,
,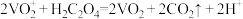 。
。
您最近一年使用:0次
解题方法
7 .  (
(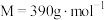 )是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备
)是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备
 并测定其纯度:
并测定其纯度:
Ⅰ.制备
ⅰ.如图连接装置,向三颈烧瓶中依次加入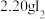 、
、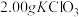 和
和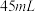 水,然后控制均匀速度滴加少量浓度为
水,然后控制均匀速度滴加少量浓度为 的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成
的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成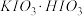 。
。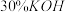 溶液,然后逐滴加入
溶液,然后逐滴加入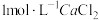 溶液,不断搅拌,生成
溶液,不断搅拌,生成 沉淀;
沉淀;
ⅲ.将混合物冷却后抽滤、依次水洗、醇洗,晾干后得产品;
Ⅱ.测定 产品纯度
产品纯度
ⅳ.称取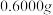 产品于烧杯中,加入
产品于烧杯中,加入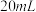 一定浓度
一定浓度 溶液(高氯酸不参与反应),将所得溶液冷却后转移至
溶液(高氯酸不参与反应),将所得溶液冷却后转移至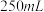 容量瓶中,定容;
容量瓶中,定容;
ⅴ.移取 溶液,加入
溶液,加入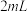 一定浓度
一定浓度 溶液和
溶液和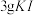 (过量),加
(过量),加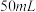 水,用
水,用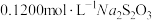 标准液(发生反应:
标准液(发生反应: )滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积
)滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积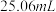 ;
;
ⅵ.做空白实验,平均消耗标准液体积 。
。
回答下列问题:
(1)装置中A处应安装的仪器为________ (填名称);三颈烧瓶的容积最适合的是________ (填选项字母);
A.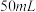 B.
B.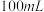 C.
C.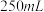 D.
D.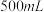
(2)滴加盐酸的仪器选用了恒压滴液漏斗,与分液漏斗相比该仪器的优点为________ ;
(3)步骤ⅰ中,生成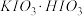 的化学方程式为
的化学方程式为________________ ;
(4)步骤ⅱ中,能够生成 的原因为
的原因为________________ ;
(5)步骤ⅲ中,醇洗的目的是________________ ;
(6)步骤ⅴ中,滴加的指示剂为________ ;滴定终点溶液颜色变化为________ ;
(7) 产品纯度为
产品纯度为________ %(保留两位有效数字)。
 (
(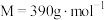 )是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备
)是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备 并测定其纯度:
并测定其纯度:Ⅰ.制备

ⅰ.如图连接装置,向三颈烧瓶中依次加入
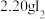 、
、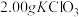 和
和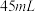 水,然后控制均匀速度滴加少量浓度为
水,然后控制均匀速度滴加少量浓度为 的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成
的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成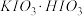 。
。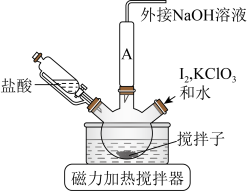
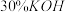 溶液,然后逐滴加入
溶液,然后逐滴加入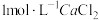 溶液,不断搅拌,生成
溶液,不断搅拌,生成 沉淀;
沉淀;ⅲ.将混合物冷却后抽滤、依次水洗、醇洗,晾干后得产品;
Ⅱ.测定
 产品纯度
产品纯度ⅳ.称取
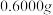 产品于烧杯中,加入
产品于烧杯中,加入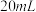 一定浓度
一定浓度 溶液(高氯酸不参与反应),将所得溶液冷却后转移至
溶液(高氯酸不参与反应),将所得溶液冷却后转移至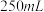 容量瓶中,定容;
容量瓶中,定容;ⅴ.移取
 溶液,加入
溶液,加入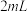 一定浓度
一定浓度 溶液和
溶液和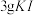 (过量),加
(过量),加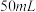 水,用
水,用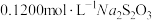 标准液(发生反应:
标准液(发生反应: )滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积
)滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积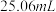 ;
;ⅵ.做空白实验,平均消耗标准液体积
 。
。回答下列问题:
(1)装置中A处应安装的仪器为
A.
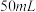 B.
B.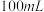 C.
C.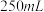 D.
D.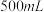
(2)滴加盐酸的仪器选用了恒压滴液漏斗,与分液漏斗相比该仪器的优点为
(3)步骤ⅰ中,生成
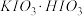 的化学方程式为
的化学方程式为(4)步骤ⅱ中,能够生成
 的原因为
的原因为(5)步骤ⅲ中,醇洗的目的是
(6)步骤ⅴ中,滴加的指示剂为
(7)
 产品纯度为
产品纯度为
您最近一年使用:0次
8 . 已知: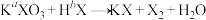 (未配平),下列说法不正确的是
(未配平),下列说法不正确的是
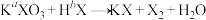 (未配平),下列说法不正确的是
(未配平),下列说法不正确的是A.基态X原子的价层电子排布式为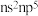 |
| B.HX的水溶液呈强酸性 |
| C.AgX一定是难溶于水的沉淀 |
D.若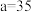 , ,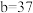 ,则 ,则 的相对分子质量为72 的相对分子质量为72 |
您最近一年使用:0次
解题方法
9 . 从某工厂铜电解车间产生的难溶副产物黑铜泥(主要成分为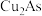 和
和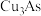 )和废水车间产生的含砷废渣(主要成分为
)和废水车间产生的含砷废渣(主要成分为 )中回收铜和砷的一种流程示意图如下。
)中回收铜和砷的一种流程示意图如下。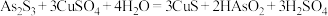 ;
;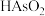 易分解生成微溶于水的
易分解生成微溶于水的 ;随着硫酸浓度的增大,
;随着硫酸浓度的增大, 在硫酸溶液中的溶解度变小。
在硫酸溶液中的溶解度变小。
(1)升温能加快氧化浸出的速率。温度过高时,浸出速率反而会下降,原因是___________ 。
(2)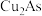 和
和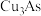 被氧化为
被氧化为 和
和 。
。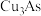 被氧化的离子方程式为
被氧化的离子方程式为___________ 。
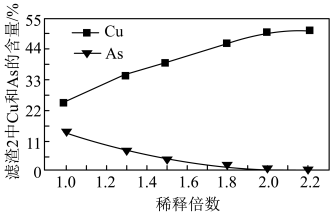
(3)沉铜前,需要对氧化浸出液进行稀释。稀释倍数对沉铜的影响如下图所示。___________ 。
(4)上述流程中可循环使用的物质是___________ 。
(5)粗三氧化二砷中砷含量的测定。
ⅰ.取0.1g样品于锥形瓶中,加入NaOH溶液,使样品完全溶解;
ⅱ.加入适量乙酸铅溶液,消除-2价硫的干扰;
ⅲ.用稀硫酸调pH=8,加入3g碳酸氢钠和少量淀粉溶液;
ⅳ.用 碘标准溶液(溶质按
碘标准溶液(溶质按 计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。
计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。
已知:样品中砷只以+3价的形式存在。
①若样品中有-2价硫,没有步骤ⅱ,测定结果将___________ (填“偏大”“偏小”或“不变”)。
②样品中砷的质量分数为___________ 。
③步骤ⅲ中加入碳酸氢钠,能保持滴定过程中溶液pH基本稳定,结合化学用语解释原因___________ 。
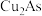 和
和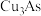 )和废水车间产生的含砷废渣(主要成分为
)和废水车间产生的含砷废渣(主要成分为 )中回收铜和砷的一种流程示意图如下。
)中回收铜和砷的一种流程示意图如下。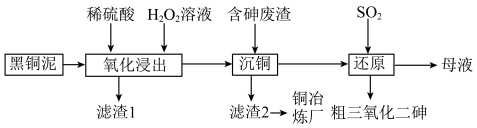
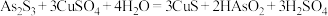 ;
;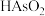 易分解生成微溶于水的
易分解生成微溶于水的 ;随着硫酸浓度的增大,
;随着硫酸浓度的增大, 在硫酸溶液中的溶解度变小。
在硫酸溶液中的溶解度变小。(1)升温能加快氧化浸出的速率。温度过高时,浸出速率反而会下降,原因是
(2)
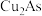 和
和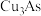 被氧化为
被氧化为 和
和 。
。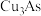 被氧化的离子方程式为
被氧化的离子方程式为(3)沉铜前,需要对氧化浸出液进行稀释。稀释倍数对沉铜的影响如下图所示。
(4)上述流程中可循环使用的物质是
(5)粗三氧化二砷中砷含量的测定。
ⅰ.取0.1g样品于锥形瓶中,加入NaOH溶液,使样品完全溶解;
ⅱ.加入适量乙酸铅溶液,消除-2价硫的干扰;
ⅲ.用稀硫酸调pH=8,加入3g碳酸氢钠和少量淀粉溶液;
ⅳ.用
 碘标准溶液(溶质按
碘标准溶液(溶质按 计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。
计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。已知:样品中砷只以+3价的形式存在。
①若样品中有-2价硫,没有步骤ⅱ,测定结果将
②样品中砷的质量分数为
③步骤ⅲ中加入碳酸氢钠,能保持滴定过程中溶液pH基本稳定,结合化学用语解释原因
您最近一年使用:0次
解题方法
10 . 某化学小组探究硫酸铁铵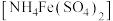 与
与 、
、 的反应。
的反应。
已知: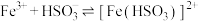 (棕红)
(棕红)
(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为___________ 。
②由实验Ⅰ可得出与 结合的能力:
结合的能力:
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(2)资料显示, 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
①实验Ⅲ中 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为___________ 。
②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因___________ 。
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。
①a、b分别是___________ 。
②结合电极反应解释步骤3中电压表示数减小的原因___________ 。
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因___________ 。
(4)综合以上实验,盐溶液间反应的多样性与___________ 有关。
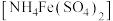 与
与 、
、 的反应。
的反应。| 实验 | 操作 | 现象 |
| Ⅰ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入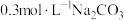 溶液 溶液 | 迅速产生大量红褐色沉淀和大量气泡;继续滴加,当气泡量明显减少时,试管口的湿润红色石蕊试纸开始逐渐变蓝 |
| Ⅱ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入 溶液 溶液 | 溶液立即变棕红(无丁达尔现象),继续滴加 溶液至过量,溶液依然为棕红色,放置两天无明显变化 溶液至过量,溶液依然为棕红色,放置两天无明显变化 |
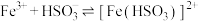 (棕红)
(棕红)(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为
②由实验Ⅰ可得出与
 结合的能力:
结合的能力:
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(2)资料显示,
 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。| 实验 | 操作 | 现象 |
| Ⅲ | 向2mL 溶液(pH=1.78)中加入0.5mL 溶液(pH=1.78)中加入0.5mL 溶液 溶液 | 溶液立即变棕红色,约2小时后,棕红色变为黄色,检测到 |
| Ⅳ | 向2mL 溶液(pH=2.03)中加入0.5mL 溶液(pH=2.03)中加入0.5mL 溶液 溶液 | 溶液立即变棕红色,约5小时后,棕红色变为黄色,检测到 |
 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了
 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。| 实验 | 实验装置 | 实验步骤及现象 |
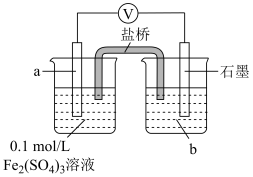
| Ⅴ |
| 1.按如图搭好装置,接通电路,电压表读数为0.6V; 2.向a电极附近滴加3滴10%稀硫酸,电压表读数不变; 3.向石墨电极附近滴加3滴10%稀硫酸,电压表读数变为0.5V。 |
②结合电极反应解释步骤3中电压表示数减小的原因
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到
 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因(4)综合以上实验,盐溶液间反应的多样性与
您最近一年使用:0次

 与玻璃中
与玻璃中 反应
反应 反应
反应