1 . 金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。
直接氯化:
反应Ⅰ:
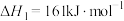
碳氯化:
反应Ⅱ: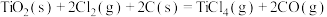
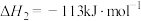
反应Ⅲ:

(1)直接氯化可以在___________ 下自发进行。
(2)反应Ⅳ 的
的 为
为___________ 
(3)科学家对以上反应做过热重分析,温度为1223K、氯气分压 的条件下,得到固体相对质量变化与时间的关系如下图所示:
的条件下,得到固体相对质量变化与时间的关系如下图所示:
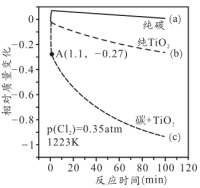
①用纯碳实验时,质量稍微有所增长,生成了含___________ 键的物质。
②用纯 实验时,所发生的化学方程式为
实验时,所发生的化学方程式为___________ ;该反应的活化能___________ (填“高”或“低”)。
③按照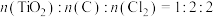 混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气(
混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气( )生成,固体中含有C和
)生成,固体中含有C和 ,则x=
,则x=___________ 。
④1.1min之后,光气( )继续反应,有理论认为机理如下:
)继续反应,有理论认为机理如下:

决速步骤的反应方程式为___________ ,1.1min之后发生的总反应方程式为___________ 。
(4)按照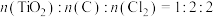 混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
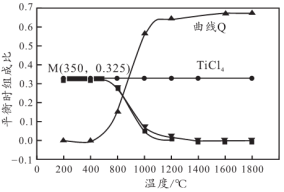
①曲线Q是___________ (填化学式)的变化图像。
②M点所发生的化学方程式是___________ 。
 )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。直接氯化:
反应Ⅰ:

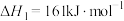
碳氯化:
反应Ⅱ:
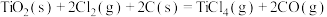
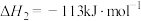
反应Ⅲ:


(1)直接氯化可以在
(2)反应Ⅳ
 的
的 为
为
(3)科学家对以上反应做过热重分析,温度为1223K、氯气分压
 的条件下,得到固体相对质量变化与时间的关系如下图所示:
的条件下,得到固体相对质量变化与时间的关系如下图所示:
①用纯碳实验时,质量稍微有所增长,生成了含
②用纯
 实验时,所发生的化学方程式为
实验时,所发生的化学方程式为③按照
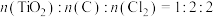 混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气(
混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气( )生成,固体中含有C和
)生成,固体中含有C和 ,则x=
,则x=④1.1min之后,光气(
 )继续反应,有理论认为机理如下:
)继续反应,有理论认为机理如下:
决速步骤的反应方程式为
(4)按照
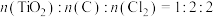 混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
①曲线Q是
②M点所发生的化学方程式是
您最近一年使用:0次
2 . 乳酸亚铁 常用作缺铁性贫血的补铁剂,能溶于水。
常用作缺铁性贫血的补铁剂,能溶于水。
(1)一般由乳酸钙与氯化亚铁两水溶液混合制得,通过重结晶提纯。
①写出制备乳酸亚铁的离子方程式___________ 。
②1mol乳酸亚铁受热至75℃和170℃时失水,失水质量分别为___________ g、___________ g。
③画出乳酸亚铁的空间立体结构___________ 。
(2)乳酸亚铁还原性的检验
①取乳酸亚铁溶于水,加入酸性高锰酸钾溶液,搅拌后紫色慢慢褪去,溶液变成棕黄色。1mol乳酸亚铁消耗了0.2mol ,化学方程式为
,化学方程式为___________ 。
②1mol乳酸亚铁溶液与5%的双氧水反应,反应剧烈且消耗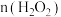 大于1.5mol。控制反应速率后,多次实验,发现消耗
大于1.5mol。控制反应速率后,多次实验,发现消耗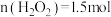 。消耗
。消耗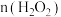 大于1.5mol的原因:
大于1.5mol的原因:___________ 、___________ 。
③双氧水与乳酸亚铁的反应速率远大于酸性高锰酸钾,为了进一步探寻原因,实验设计如下:___________ 。
 常用作缺铁性贫血的补铁剂,能溶于水。
常用作缺铁性贫血的补铁剂,能溶于水。(1)一般由乳酸钙与氯化亚铁两水溶液混合制得,通过重结晶提纯。
①写出制备乳酸亚铁的离子方程式
②1mol乳酸亚铁受热至75℃和170℃时失水,失水质量分别为
③画出乳酸亚铁的空间立体结构
(2)乳酸亚铁还原性的检验
①取乳酸亚铁溶于水,加入酸性高锰酸钾溶液,搅拌后紫色慢慢褪去,溶液变成棕黄色。1mol乳酸亚铁消耗了0.2mol
 ,化学方程式为
,化学方程式为②1mol乳酸亚铁溶液与5%的双氧水反应,反应剧烈且消耗
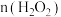 大于1.5mol。控制反应速率后,多次实验,发现消耗
大于1.5mol。控制反应速率后,多次实验,发现消耗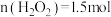 。消耗
。消耗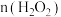 大于1.5mol的原因:
大于1.5mol的原因:③双氧水与乳酸亚铁的反应速率远大于酸性高锰酸钾,为了进一步探寻原因,实验设计如下:
您最近一年使用:0次
3 . 用碘酸制备五氧化二碘,然后检验乙醇。90~110℃(低温区)加热20min,再升温至220~240℃(高温区)恒温4h,具体流程如下图所示。下列说法正确的是
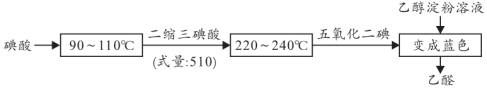

A.二缩三碘酸化学式为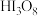 |
| B.低温区发生氧化还原反应 |
| C.反应速率:低温区<高温区 |
| D.生成1mol碘,消耗2.5mol乙醇 |
您最近一年使用:0次
解题方法
4 . “消洗灵”是具有消毒、杀菌、漂白和洗涤等综合功效的固体粉末,消毒原理与“84消毒液”相似,化学组成可以表示为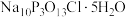 (磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
(磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
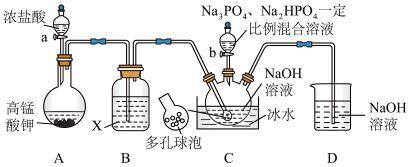
回答下列问题:
(1)①写出X试剂的名称______________ 。
②写出C中采用多孔球泡的目的______________ 。
③写出D装置的作用______________ 。
(2)打开仪器a的活塞及弹簧夹K,制备 碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
① “一系列操作”包括___________ 、___________ 、过滤、洗涤、低温干燥。
②若C中的 与
与 按物质的量之比
按物质的量之比 混合,写出C中制备“消洗灵”的总反应的化学方程式
混合,写出C中制备“消洗灵”的总反应的化学方程式______________ 。
③若生成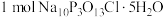 ,写出理论上至少消耗
,写出理论上至少消耗 的物质的量
的物质的量______________ 。
(3)“消洗灵”消毒时对金属腐蚀性小,原因是成分中的磷酸钠与空气共同作用,在金属表面形成不溶性磷酸盐膜,对金属具有良好的保护作用。写出用“消洗灵”对镁合金消毒,形成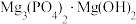 保护层的反应的化学方程式
保护层的反应的化学方程式______________ 。
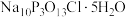 (磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
(磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
回答下列问题:
(1)①写出X试剂的名称
②写出C中采用多孔球泡的目的
③写出D装置的作用
(2)打开仪器a的活塞及弹簧夹K,制备
 碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。① “一系列操作”包括
②若C中的
 与
与 按物质的量之比
按物质的量之比 混合,写出C中制备“消洗灵”的总反应的化学方程式
混合,写出C中制备“消洗灵”的总反应的化学方程式③若生成
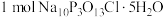 ,写出理论上至少消耗
,写出理论上至少消耗 的物质的量
的物质的量(3)“消洗灵”消毒时对金属腐蚀性小,原因是成分中的磷酸钠与空气共同作用,在金属表面形成不溶性磷酸盐膜,对金属具有良好的保护作用。写出用“消洗灵”对镁合金消毒,形成
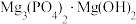 保护层的反应的化学方程式
保护层的反应的化学方程式
您最近一年使用:0次
解题方法
5 . 工业氯化钡为白色粉末状晶体,是一种重要的化工原料。盐酸-硫化钡法生产氯化钡的工艺成熟、适用性强,被我国大部分工厂采用。其工艺流程如下图所示:

(1)写出硫化氢的电子式_______ 。
(2)写出高温“煅烧”时重晶石发生的主要反应的化学方程式_______ 。
(3)“酸浸”时需要控制盐酸的加入速率。请分析若加酸过快会导致怎样的危害_______ ?
(4)“酸浸”得到的氯化钡溶液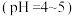 中有少量硫化物会影响产品质量,可以用双氧水进行脱硫除杂,写出反应的离子方程式
中有少量硫化物会影响产品质量,可以用双氧水进行脱硫除杂,写出反应的离子方程式_______ 。
(5)由原料重晶石带入的锶离子随着氯化钡溶液的浓缩会逐步富集。向滤液中加入铬酸,利用锶、钡的铬酸盐溶解度的差异分步沉淀出铬酸钡,进一步对钡盐和锶盐进行回收利用。若滤液中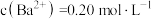 ,
,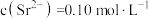 ,当
,当 沉淀完全时,则溶液中
沉淀完全时,则溶液中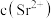 是多少
是多少_______ ?已知 时,
时,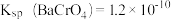 、
、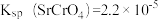 。
。

(1)写出硫化氢的电子式
(2)写出高温“煅烧”时重晶石发生的主要反应的化学方程式
(3)“酸浸”时需要控制盐酸的加入速率。请分析若加酸过快会导致怎样的危害
(4)“酸浸”得到的氯化钡溶液
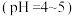 中有少量硫化物会影响产品质量,可以用双氧水进行脱硫除杂,写出反应的离子方程式
中有少量硫化物会影响产品质量,可以用双氧水进行脱硫除杂,写出反应的离子方程式(5)由原料重晶石带入的锶离子随着氯化钡溶液的浓缩会逐步富集。向滤液中加入铬酸,利用锶、钡的铬酸盐溶解度的差异分步沉淀出铬酸钡,进一步对钡盐和锶盐进行回收利用。若滤液中
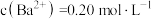 ,
,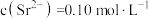 ,当
,当 沉淀完全时,则溶液中
沉淀完全时,则溶液中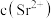 是多少
是多少 时,
时,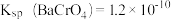 、
、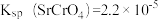 。
。
您最近一年使用:0次
6 . 亚硫酰氯( ,熔点
,熔点 ,沸点
,沸点 ,易水解生成
,易水解生成 和
和 )是一种重要的化学试剂,广泛用于有机合成。制备亚硫酰氯的两种方法:
)是一种重要的化学试剂,广泛用于有机合成。制备亚硫酰氯的两种方法:
方法1:以五氯化磷和二氧化硫为原料,发生反应:
方法2:以三氧化硫和二氯化硫为原料。
(1)方法1反应的过程中是否存在电子转移_______ ?
(2)写出方法2的化学方程式_______ 。
(3)某科研小组测定亚硫酰氯产品的纯度。步骤如下:
步骤一、用分析天平准确称取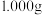 样品,小心地将样品溶于
样品,小心地将样品溶于 的氢氧化钠溶液中,充分反应后,配成
的氢氧化钠溶液中,充分反应后,配成 试样溶液。
试样溶液。
步骤二、用移液管吸取 试样溶液于
试样溶液于 碘量瓶中,加入两滴对硝基苯酚指示剂,滴加
碘量瓶中,加入两滴对硝基苯酚指示剂,滴加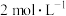 盐酸至黄色刚好消失,加入
盐酸至黄色刚好消失,加入 碘标准溶液,避光放置
碘标准溶液,避光放置 。
。
步骤三、用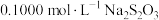 标准溶液返滴定过量的
标准溶液返滴定过量的 ,近终点时加入淀粉溶液,继续滴定至终点,消耗标准溶液
,近终点时加入淀粉溶液,继续滴定至终点,消耗标准溶液 。
。
①指出步骤一中“配成 试样溶液”所必需的定量玻璃仪器的名称
试样溶液”所必需的定量玻璃仪器的名称_______ 。
②指出步骤二中滴加盐酸的目的_______ 。
③叙述步骤三中滴定终点的现象_______ 。
④计算样品的纯度(用含有V的代数式表示)_______ 。
 ,熔点
,熔点 ,沸点
,沸点 ,易水解生成
,易水解生成 和
和 )是一种重要的化学试剂,广泛用于有机合成。制备亚硫酰氯的两种方法:
)是一种重要的化学试剂,广泛用于有机合成。制备亚硫酰氯的两种方法:方法1:以五氯化磷和二氧化硫为原料,发生反应:

方法2:以三氧化硫和二氯化硫为原料。
(1)方法1反应的过程中是否存在电子转移
(2)写出方法2的化学方程式
(3)某科研小组测定亚硫酰氯产品的纯度。步骤如下:
步骤一、用分析天平准确称取
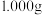 样品,小心地将样品溶于
样品,小心地将样品溶于 的氢氧化钠溶液中,充分反应后,配成
的氢氧化钠溶液中,充分反应后,配成 试样溶液。
试样溶液。步骤二、用移液管吸取
 试样溶液于
试样溶液于 碘量瓶中,加入两滴对硝基苯酚指示剂,滴加
碘量瓶中,加入两滴对硝基苯酚指示剂,滴加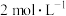 盐酸至黄色刚好消失,加入
盐酸至黄色刚好消失,加入 碘标准溶液,避光放置
碘标准溶液,避光放置 。
。步骤三、用
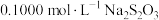 标准溶液返滴定过量的
标准溶液返滴定过量的 ,近终点时加入淀粉溶液,继续滴定至终点,消耗标准溶液
,近终点时加入淀粉溶液,继续滴定至终点,消耗标准溶液 。
。①指出步骤一中“配成
 试样溶液”所必需的定量玻璃仪器的名称
试样溶液”所必需的定量玻璃仪器的名称②指出步骤二中滴加盐酸的目的
③叙述步骤三中滴定终点的现象
④计算样品的纯度(用含有V的代数式表示)
您最近一年使用:0次
7 . 根据要求回答下列问题:
(1)说明氨气易液化的原因______________ 。
(2)写出灼烧镁粉与石英砂的混合物生成的两种含镁二元化合物的化学式分别为_______ ,_______ 。
(3)将 溶液滴入
溶液滴入 溶液中生成棕黑色沉淀,此反应中氧化剂与还原剂的物质的量之比为多少
溶液中生成棕黑色沉淀,此反应中氧化剂与还原剂的物质的量之比为多少______________ ?
(4)硫酸铜溶液与碳酸钠溶液反应生成碱式碳酸铜,过程中未见气体生成,写出这个反应的化学方程式_______ 。
(5)向明矾溶液中加入适量 溶液,既能提高净水效率又能杀菌消毒,用离子方程式解释其原因
溶液,既能提高净水效率又能杀菌消毒,用离子方程式解释其原因_______ 。
(1)说明氨气易液化的原因
(2)写出灼烧镁粉与石英砂的混合物生成的两种含镁二元化合物的化学式分别为
(3)将
 溶液滴入
溶液滴入 溶液中生成棕黑色沉淀,此反应中氧化剂与还原剂的物质的量之比为多少
溶液中生成棕黑色沉淀,此反应中氧化剂与还原剂的物质的量之比为多少(4)硫酸铜溶液与碳酸钠溶液反应生成碱式碳酸铜,过程中未见气体生成,写出这个反应的化学方程式
(5)向明矾溶液中加入适量
 溶液,既能提高净水效率又能杀菌消毒,用离子方程式解释其原因
溶液,既能提高净水效率又能杀菌消毒,用离子方程式解释其原因
您最近一年使用:0次
8 . 某小组同学探究溶液中的 能否被金属钠还原,进行实验:
能否被金属钠还原,进行实验:
①在干燥试管中加入绿豆大小的金属钠,逐滴滴加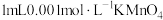 溶液,产生无色气体,溶液由紫红色变为浅绿色
溶液,产生无色气体,溶液由紫红色变为浅绿色 。
。
②向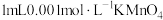 溶液中持续通入
溶液中持续通入 ,水浴加热,溶液颜色无明显变化。
,水浴加热,溶液颜色无明显变化。
③向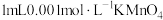 溶液中加入
溶液中加入 固体,溶液由紫红色变为浅绿色。
固体,溶液由紫红色变为浅绿色。
下列说法不正确 的是
 能否被金属钠还原,进行实验:
能否被金属钠还原,进行实验:①在干燥试管中加入绿豆大小的金属钠,逐滴滴加
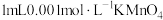 溶液,产生无色气体,溶液由紫红色变为浅绿色
溶液,产生无色气体,溶液由紫红色变为浅绿色 。
。②向
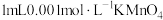 溶液中持续通入
溶液中持续通入 ,水浴加热,溶液颜色无明显变化。
,水浴加热,溶液颜色无明显变化。③向
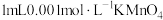 溶液中加入
溶液中加入 固体,溶液由紫红色变为浅绿色。
固体,溶液由紫红色变为浅绿色。下列说法
| A.实验①中还可能观察到钠块浮在溶液表面,剧烈燃烧,发出黄色火焰 |
| B.实验②中的现象说明实验①中溶液变色的原因与产生的气体无关 |
C.实验③中的现象说明实验①中可能发生的反应: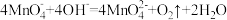 |
D.上述实验能证明溶液中的 可以被金属钠还原 可以被金属钠还原 |
您最近一年使用:0次
2023-05-07更新
|
1690次组卷
|
7卷引用:湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题
湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题北京市海淀区2022-2023学年高三第二次模拟(下学期期末)考试化学试题(已下线)T12-化学反应及限度(已下线)第4讲 钠及其重要化合物北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题(已下线)选择题11-14(已下线)选择题6-10
名校
解题方法
9 . 某实验小组利用微型实验装置进行氯气的制备和性质探究,装置如图所示,下列有关说法错误的是
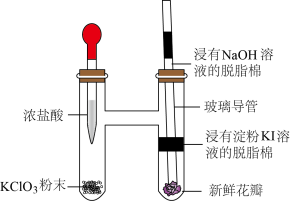
A. 与浓盐酸反应,HCl只体现还原性 与浓盐酸反应,HCl只体现还原性 |
B.浸有淀粉KI溶液的脱脂棉变蓝,说明氧化性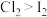 |
| C.新鲜花瓣褪色是因为氯气与水反应生成的HClO有漂白性 |
| D.浸有NaOH溶液的脱脂棉可吸收过量氯气 |
您最近一年使用:0次
2023-04-27更新
|
709次组卷
|
3卷引用:广东省揭阳市普宁市勤建学校2022-2023学年高一下学期学科竞赛化学试题
解题方法
10 . 碱式碳酸锌 可被用于皮肤保护剂、饲料添加剂等,以锌焙砂(主要成分为
可被用于皮肤保护剂、饲料添加剂等,以锌焙砂(主要成分为 及少量
及少量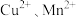 的化合物)为原料制备碱式碳酸锌的工艺流程如图所示,下列说法错误的是
的化合物)为原料制备碱式碳酸锌的工艺流程如图所示,下列说法错误的是

 可被用于皮肤保护剂、饲料添加剂等,以锌焙砂(主要成分为
可被用于皮肤保护剂、饲料添加剂等,以锌焙砂(主要成分为 及少量
及少量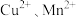 的化合物)为原料制备碱式碳酸锌的工艺流程如图所示,下列说法错误的是
的化合物)为原料制备碱式碳酸锌的工艺流程如图所示,下列说法错误的是
| A.“酸浸”前将锌焙砂粉碎可提高酸浸速率与原料的利用率 |
| B.“氧化”过程中,消耗的氧化剂与还原剂物质的量之比为2∶1 |
C.“沉铜”过程中反应的离子方程式为 |
D.碱式碳酸锌可与盐酸反应,其加热灼烧时可得到 |
您最近一年使用:0次
2022-11-26更新
|
231次组卷
|
3卷引用:福建省福州市福清市虞阳中学2023-2024学年高三上学期化学竞赛试卷



