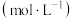1 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(1)过氧化钠可用作潜水艇和消防员呼吸面具中的供氧剂,其主要原理为: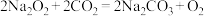 。其中Na2O2的阴、阳离子个数比为
。其中Na2O2的阴、阳离子个数比为________ 。每消耗2个CO2分子,转移电子的数目为________ 个。在下列选项中选择,上述反应中Na2O2是________ (填字母,下同),O2是________ .
A.氧化剂 B.还原剂 C.氧化产物 D.还原产物
若要反应产生64.0gO2,同时消耗Na2O2的质量约为________ g。
(2)汽车尾气系统中均安装了催化转化器。汽车尾气中有毒的CO和NO在催化剂高温条件下发生反应,生成两种无毒气体。上述反应的化学方程式为: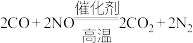 用单线桥标出反应中电子转移的方向和数目
用单线桥标出反应中电子转移的方向和数目________ 。
该反应中,氧化产物与还原产物的分子数之比为________ 。
(3)亚硝酸钠NaNO2像食盐一样有咸味,毒性很强,误食会导致血红蛋白中的Fe2+转化为Fe3+,可服用维生素C解毒。关于该过程的叙述,不正确的是________(填字母)。
(1)过氧化钠可用作潜水艇和消防员呼吸面具中的供氧剂,其主要原理为:
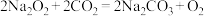 。其中Na2O2的阴、阳离子个数比为
。其中Na2O2的阴、阳离子个数比为A.氧化剂 B.还原剂 C.氧化产物 D.还原产物
若要反应产生64.0gO2,同时消耗Na2O2的质量约为
(2)汽车尾气系统中均安装了催化转化器。汽车尾气中有毒的CO和NO在催化剂高温条件下发生反应,生成两种无毒气体。上述反应的化学方程式为:
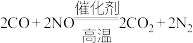 用单线桥标出反应中电子转移的方向和数目
用单线桥标出反应中电子转移的方向和数目该反应中,氧化产物与还原产物的分子数之比为
(3)亚硝酸钠NaNO2像食盐一样有咸味,毒性很强,误食会导致血红蛋白中的Fe2+转化为Fe3+,可服用维生素C解毒。关于该过程的叙述,不正确的是________(填字母)。
| A.亚硝酸钠的氧化性强于Fe3+ | B.维生素C是还原剂 |
| C.维生素C的还原性强于Fe2+ | D.亚硝酸钠是还原剂 |
您最近一年使用:0次
2 . 钠元素在自然界中以多种化合物的形式存在。Na2O2、Na2CO3、NaHCO3是重要的化工原料,具有多种用途。
(1) Na2O2可在呼吸面具和潜水艇中作为氧气的来源,请写出Na2O2与CO2反应的化学方程式___________ 。
(2)Na2O2和 NaH与水反应均产生气体,当二者与足量水反应产生等量气体时转移电子数之比为___________ 。
(3)查阅资料知:Na2O2在一定条件下可以转化为 NaNO2,亚硝酸钠外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 NaNO2会导致血红蛋白中的 Fe2+转化为 Fe3+而中毒,误食NaNO2后可服用维生素C解毒。下列分析错误的是___________(填字母)。
(1) Na2O2可在呼吸面具和潜水艇中作为氧气的来源,请写出Na2O2与CO2反应的化学方程式
(2)Na2O2和 NaH与水反应均产生气体,当二者与足量水反应产生等量气体时转移电子数之比为
(3)查阅资料知:Na2O2在一定条件下可以转化为 NaNO2,亚硝酸钠外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 NaNO2会导致血红蛋白中的 Fe2+转化为 Fe3+而中毒,误食NaNO2后可服用维生素C解毒。下列分析错误的是___________(填字母)。
| A.NaNO2被还原 | B.维生素 C具有还原性 |
| C.还原性:维生素 C>Fe2+ | D.NaNO2与Fe2+反应时作还原剂 |
您最近一年使用:0次
名校
3 . 高铁酸钾( )在能源、环保等方面有着广泛的用途。如图是实验室制备
)在能源、环保等方面有着广泛的用途。如图是实验室制备 的实验装置图,请回答下列问题:
的实验装置图,请回答下列问题:
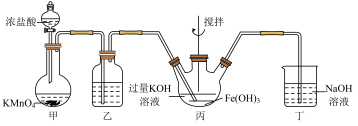
(1)图中装有浓盐酸的仪器名称为___________ 。
(2)浓盐酸与高锰酸钾发生反应: ,当消耗
,当消耗 时,理论上被氧化的HCl为
时,理论上被氧化的HCl为___________ mol。
(3)乙装置中的试剂为___________ ,作用是___________ 。
(4)写出丁装置中发生反应的离子方程式:___________ 。
(5)请完成并配平丙装置中的离子方程式:_______
___________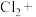 ___________ ___________+___________
___________ ___________+___________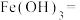 ___________
___________ ___________
___________ ___________ ___________
___________ ___________
(6)漂白液、漂白粉和漂粉精既可作棉、麻、纸张的漂白剂,又可用作环境消毒剂。工业生产漂白粉的化学方程式为___________ 。
 )在能源、环保等方面有着广泛的用途。如图是实验室制备
)在能源、环保等方面有着广泛的用途。如图是实验室制备 的实验装置图,请回答下列问题:
的实验装置图,请回答下列问题: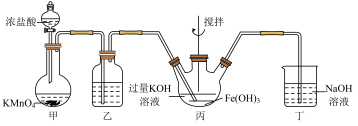
(1)图中装有浓盐酸的仪器名称为
(2)浓盐酸与高锰酸钾发生反应:
 ,当消耗
,当消耗 时,理论上被氧化的HCl为
时,理论上被氧化的HCl为(3)乙装置中的试剂为
(4)写出丁装置中发生反应的离子方程式:
(5)请完成并配平丙装置中的离子方程式:
___________
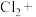 ___________ ___________+___________
___________ ___________+___________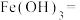 ___________
___________ ___________
___________ ___________ ___________
___________ ___________(6)漂白液、漂白粉和漂粉精既可作棉、麻、纸张的漂白剂,又可用作环境消毒剂。工业生产漂白粉的化学方程式为
您最近一年使用:0次
名校
解题方法
4 . 铁的化合物有广泛用途,如碳酸亚铁( )可作补血剂。利用某硫酸厂产生的烧渣(主要含
)可作补血剂。利用某硫酸厂产生的烧渣(主要含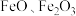 ,还有一定量的
,还有一定量的 )制备碳酸亚铁的流程如图所示:
)制备碳酸亚铁的流程如图所示:
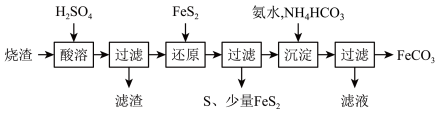
已知:① 不溶于稀硫酸;
不溶于稀硫酸;
②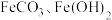 都难溶于水。
都难溶于水。
(1)加入稀硫酸溶解后得到的滤渣是_______________ (写化学式)。
(2)过滤操作需要用到的玻璃仪器有:烧杯、____________ 和____________ 。判断还原时溶液中是否含有 的试剂是
的试剂是______________ 。
(3)“还原”时,加入的 与
与 发生反应Ⅰ、Ⅱ两个氧化还原反应:
发生反应Ⅰ、Ⅱ两个氧化还原反应:
①配平反应Ⅰ的离子方程式:__________
反应Ⅰ:________ ________
________ ________
________ ________
________ ________
________ ________
________
②请写出反应Ⅱ的离子反应方程式:__________ 。
③还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
则反应Ⅰ、Ⅱ中生成 的物质的量之比为
的物质的量之比为________________ 。
(4)“沉淀”时加入的氨水不宜过量,否则生成的 中可能混有
中可能混有____________ 杂质(写出一种即可)。
 )可作补血剂。利用某硫酸厂产生的烧渣(主要含
)可作补血剂。利用某硫酸厂产生的烧渣(主要含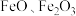 ,还有一定量的
,还有一定量的 )制备碳酸亚铁的流程如图所示:
)制备碳酸亚铁的流程如图所示:
已知:①
 不溶于稀硫酸;
不溶于稀硫酸;②
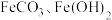 都难溶于水。
都难溶于水。(1)加入稀硫酸溶解后得到的滤渣是
(2)过滤操作需要用到的玻璃仪器有:烧杯、
 的试剂是
的试剂是(3)“还原”时,加入的
 与
与 发生反应Ⅰ、Ⅱ两个氧化还原反应:
发生反应Ⅰ、Ⅱ两个氧化还原反应:①配平反应Ⅰ的离子方程式:
反应Ⅰ:________
 ________
________ ________
________ ________
________ ________
________ ________
________②请写出反应Ⅱ的离子反应方程式:
③还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度 | |
还原前 | 还原后 | |
| 0.10 | 2.50 |
| 3.50 | 3.70 |
 的物质的量之比为
的物质的量之比为(4)“沉淀”时加入的氨水不宜过量,否则生成的
 中可能混有
中可能混有
您最近一年使用:0次
名校
5 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
(2)我国用 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,用单线桥法表示反应中电子得失的方向和数目:
,用单线桥法表示反应中电子得失的方向和数目:___________ 。将该反应化学方程式改写为离子方程式:___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列6种物质:
),反应体系中涉及下列6种物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下降 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11:1,则
的个数之比为11:1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为___________ 。
(5)实验室用下列方法均可制取氯气
① ③
③
②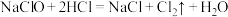 ②
②
③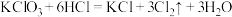 ④
④
若各反应转移的电子数相同,①②③生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,用单线桥法表示反应中电子得失的方向和数目:
,用单线桥法表示反应中电子得失的方向和数目:(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列6种物质:
),反应体系中涉及下列6种物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下降
 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11:1,则
的个数之比为11:1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为(5)实验室用下列方法均可制取氯气
①
 ③
③②
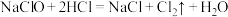 ②
②③
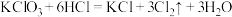 ④
④若各反应转移的电子数相同,①②③生成的氯气质量比为
您最近一年使用:0次
名校
6 . 氧化还原反应在生活、生产与科学实验中有重要作用。
回答下列问题:
(1)亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
①误食 会导致入体血红蛋白中的
会导致入体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 发生反应
发生反应_____ (填“氧化”或“还原”,下同),服用维生素 可将
可将 转化为
转化为 从而解毒,这说明维生素
从而解毒,这说明维生素 具有
具有________ 性。
②实验室可利用反应 制备少量
制备少量 ,若反应中有
,若反应中有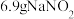 固体生成,则转移电子的物质的量为
固体生成,则转移电子的物质的量为________  。
。
(2) 、
、 是常用的氧化剂。
是常用的氧化剂。
①已知: 、
、 、
、 、
、 和一些未知物组成一个氧化还原反应,其中
和一些未知物组成一个氧化还原反应,其中 是氧化产物,则还原性:
是氧化产物,则还原性:
_________  (填“
(填“ ”或“
”或“ ”)。
”)。
②请结合①中反应,写出一个能证明氧化性 的离子方程式:
的离子方程式:___________________ 。
(3)高铁酸钾( )是一种高效多功能的新型非氯绿色消毒剂。
)是一种高效多功能的新型非氯绿色消毒剂。
①工业上可通过次氯酸盐氧化法制备 :
: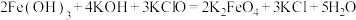 。请写出该反应的离子方程式并用双线桥法标出电子转移的方向与数目:
。请写出该反应的离子方程式并用双线桥法标出电子转移的方向与数目:___________________ 。
② 净水原理如图所示:
净水原理如图所示:

若过程 中转移
中转移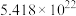 个电子,需
个电子,需____________ 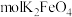 。
。
③向 溶液中加入适量的饱和
溶液中加入适量的饱和 溶液,有
溶液,有 析出,写出该反应的离子方程式:
析出,写出该反应的离子方程式:____________ 。
回答下列问题:
(1)亚硝酸钠(
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。①误食
 会导致入体血红蛋白中的
会导致入体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 发生反应
发生反应 可将
可将 转化为
转化为 从而解毒,这说明维生素
从而解毒,这说明维生素 具有
具有②实验室可利用反应
 制备少量
制备少量 ,若反应中有
,若反应中有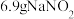 固体生成,则转移电子的物质的量为
固体生成,则转移电子的物质的量为 。
。(2)
 、
、 是常用的氧化剂。
是常用的氧化剂。①已知:
 、
、 、
、 、
、 和一些未知物组成一个氧化还原反应,其中
和一些未知物组成一个氧化还原反应,其中 是氧化产物,则还原性:
是氧化产物,则还原性:
 (填“
(填“ ”或“
”或“ ”)。
”)。②请结合①中反应,写出一个能证明氧化性
 的离子方程式:
的离子方程式:(3)高铁酸钾(
 )是一种高效多功能的新型非氯绿色消毒剂。
)是一种高效多功能的新型非氯绿色消毒剂。①工业上可通过次氯酸盐氧化法制备
 :
: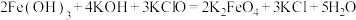 。请写出该反应的离子方程式并用双线桥法标出电子转移的方向与数目:
。请写出该反应的离子方程式并用双线桥法标出电子转移的方向与数目:②
 净水原理如图所示:
净水原理如图所示:
若过程
 中转移
中转移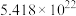 个电子,需
个电子,需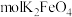 。
。③向
 溶液中加入适量的饱和
溶液中加入适量的饱和 溶液,有
溶液,有 析出,写出该反应的离子方程式:
析出,写出该反应的离子方程式:
您最近一年使用:0次
名校
解题方法
7 .  具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入
具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: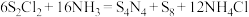 (已知
(已知 分子结构为
分子结构为 。下列说法错误的是
。下列说法错误的是

 具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入
具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: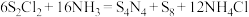 (已知
(已知 分子结构为
分子结构为 。下列说法错误的是
。下列说法错误的是
A. 属于分子晶体, 属于分子晶体,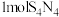 中含有8mol极性键 中含有8mol极性键 |
B. 中S采取 中S采取 杂化 杂化 |
C.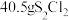 参与上述制备反应,转移0.3mol电子 参与上述制备反应,转移0.3mol电子 |
D. 在上述反应中体现了还原性和碱性 在上述反应中体现了还原性和碱性 |
您最近一年使用:0次
名校
8 . 氯及其化合物有重要用途,氯气和 气体均常用于自来水消毒。以下是氯元素的“价类二维图”的部分信息。请回答下列问题:
气体均常用于自来水消毒。以下是氯元素的“价类二维图”的部分信息。请回答下列问题:
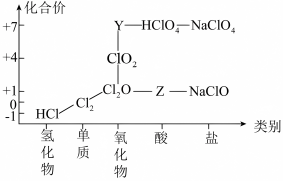
(1)根据图中信息写出Y、Z的化学式:______ 、______ 。
(2)已知高氯酸( )是强酸,写出高氯酸与氢氧化钠反应的离子方程式:
)是强酸,写出高氯酸与氢氧化钠反应的离子方程式:______ 。
(3)已知:消毒效率可用单位质量消毒剂得到的电子数的相对大小来表示。 是最早用于饮用水消毒的物质,
是最早用于饮用水消毒的物质, 是一种新的广谱消毒剂。等质量的
是一种新的广谱消毒剂。等质量的 和
和 消毒效率较高的是
消毒效率较高的是______ (填化学式);
(4)工业常用 和
和 溶液混合酸化后反应制得
溶液混合酸化后反应制得 气体,该反应的离子方程式为:
气体,该反应的离子方程式为:______ 。
(5)84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。其原理为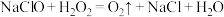 ,反应产生的
,反应产生的 促进藻类快速生长。
促进藻类快速生长。
①该反应说明氧化性:NaClO______  (填“>”或“<”)。
(填“>”或“<”)。
②当标准状况下有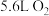 生成时,转移电子
生成时,转移电子______ mol。
高铁酸钠( )是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为
)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为 离子,制取高铁酸钠的化学方程式如下:
离子,制取高铁酸钠的化学方程式如下:
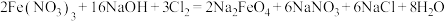
(6)在上述反应中______ (元素名称)元素被氧化,氧化剂是______ (化学式)。
(7)高铁酸钠( )是一种新型净水剂。在水处理过程中,
)是一种新型净水剂。在水处理过程中, 中的铁元素转化为
中的铁元素转化为 胶体,使水中悬浮物聚沉。向
胶体,使水中悬浮物聚沉。向 胶体中逐滴加入HCl稀溶液至过量,会出现的现象是:
胶体中逐滴加入HCl稀溶液至过量,会出现的现象是:______ 。
(8)实验室制备 胶体的离子方程式:
胶体的离子方程式:______ 。
 气体均常用于自来水消毒。以下是氯元素的“价类二维图”的部分信息。请回答下列问题:
气体均常用于自来水消毒。以下是氯元素的“价类二维图”的部分信息。请回答下列问题:
(1)根据图中信息写出Y、Z的化学式:
(2)已知高氯酸(
 )是强酸,写出高氯酸与氢氧化钠反应的离子方程式:
)是强酸,写出高氯酸与氢氧化钠反应的离子方程式:(3)已知:消毒效率可用单位质量消毒剂得到的电子数的相对大小来表示。
 是最早用于饮用水消毒的物质,
是最早用于饮用水消毒的物质, 是一种新的广谱消毒剂。等质量的
是一种新的广谱消毒剂。等质量的 和
和 消毒效率较高的是
消毒效率较高的是(4)工业常用
 和
和 溶液混合酸化后反应制得
溶液混合酸化后反应制得 气体,该反应的离子方程式为:
气体,该反应的离子方程式为:(5)84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。其原理为
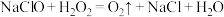 ,反应产生的
,反应产生的 促进藻类快速生长。
促进藻类快速生长。①该反应说明氧化性:NaClO
 (填“>”或“<”)。
(填“>”或“<”)。②当标准状况下有
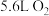 生成时,转移电子
生成时,转移电子高铁酸钠(
 )是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为
)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为 离子,制取高铁酸钠的化学方程式如下:
离子,制取高铁酸钠的化学方程式如下: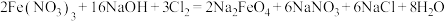
(6)在上述反应中
(7)高铁酸钠(
 )是一种新型净水剂。在水处理过程中,
)是一种新型净水剂。在水处理过程中, 中的铁元素转化为
中的铁元素转化为 胶体,使水中悬浮物聚沉。向
胶体,使水中悬浮物聚沉。向 胶体中逐滴加入HCl稀溶液至过量,会出现的现象是:
胶体中逐滴加入HCl稀溶液至过量,会出现的现象是:(8)实验室制备
 胶体的离子方程式:
胶体的离子方程式:
您最近一年使用:0次
名校
解题方法
9 . 金属镁及其化合物在科学研究及生产中具有广泛的用途。
(1)在干冰中央挖一个小穴,撒一些镁粉,用红热的铁棒把镁引燃,盖上另一块干冰,镁粉在干冰中继续燃烧,发出耀眼的白光,写出反应的化学方程式为_______ 。
(2)镁—过氧化氢电池具有能量高、安全方便等优点,可用于驱动无人驾驶的潜航器。某种镁—过氧化氢电池以海水为电解质溶液,其工作原理如图所示(已知:氢氧化镁难溶于水)。

正极的电极反应式为_______ ,隔膜应选择_______ (填“阳”或“阴”)离子膜。
(3)轻质碳酸镁[MgCO3·Mg(OH)2·3H2O]在化工生产上有广泛的用途。以卤块(主要成分为MgCl2,含Fe2+、Fe3+等杂质离子)为原料制备它的工艺流程如下:

常温下,Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH:
[注:Fe(OH)2沉淀呈絮状,不易从溶液中除去]。
①“氧化”过程中,参加反应的氧化剂与还原剂的物质的量之比为_______ 。
②加入NaOH溶液调节pH,通常控制pH在9.0左右,其目的是_______ 。
③热解时,反应的离子方程式为_______ 。
④操作I、Ⅱ均是将固体与液体分离,但在对分离后所得固体的操作上有明显差异,差异是_______ 。
(1)在干冰中央挖一个小穴,撒一些镁粉,用红热的铁棒把镁引燃,盖上另一块干冰,镁粉在干冰中继续燃烧,发出耀眼的白光,写出反应的化学方程式为
(2)镁—过氧化氢电池具有能量高、安全方便等优点,可用于驱动无人驾驶的潜航器。某种镁—过氧化氢电池以海水为电解质溶液,其工作原理如图所示(已知:氢氧化镁难溶于水)。

正极的电极反应式为
(3)轻质碳酸镁[MgCO3·Mg(OH)2·3H2O]在化工生产上有广泛的用途。以卤块(主要成分为MgCl2,含Fe2+、Fe3+等杂质离子)为原料制备它的工艺流程如下:

常温下,Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH:
| Fe3+ | Fe2+ | Mg2+ | |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.9 |
| 完全沉淀时的pH | 3.7 | 9.6 | 11 |
①“氧化”过程中,参加反应的氧化剂与还原剂的物质的量之比为
②加入NaOH溶液调节pH,通常控制pH在9.0左右,其目的是
③热解时,反应的离子方程式为
④操作I、Ⅱ均是将固体与液体分离,但在对分离后所得固体的操作上有明显差异,差异是
您最近一年使用:0次
名校
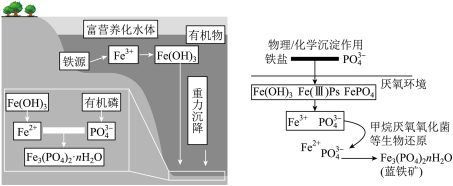
10 . 一方面,磷矿藏在地球上分布不均匀且储量有限;另一方面,污水中含有较多的磷元素。因此在污水处理生物污泥中的蓝铁矿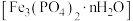 因其潜在的特殊用途以及经济价值而备受关注。蓝铁矿在自然水体中形成的过程如图。
因其潜在的特殊用途以及经济价值而备受关注。蓝铁矿在自然水体中形成的过程如图。
(1)水处理时,加入的高铁酸钾( )作为净水消毒剂,发生反应的化学方程式为
)作为净水消毒剂,发生反应的化学方程式为 。
。
① 中Fe的化合价为
中Fe的化合价为_______ 价,上述反应涉及的物质中属于盐的是_______ 。
②高铁酸钾可用于净水消毒的原因是_______
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式:_______ 。
_______ _______
_______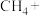 _______
_______ _______
_______ _______
_______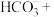 _______
_______
该反应中的氧化产物为_______ (填离子符号),被氧化的原子与被还原的原子的数目之比为_______ 。
(3)无氧条件下加热,蓝铁矿(无杂质)发生分解: ,蓝铁矿的质量由5.02g减小为3.58g,则n=
,蓝铁矿的质量由5.02g减小为3.58g,则n=_______ 。
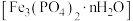 因其潜在的特殊用途以及经济价值而备受关注。蓝铁矿在自然水体中形成的过程如图。
因其潜在的特殊用途以及经济价值而备受关注。蓝铁矿在自然水体中形成的过程如图。
(1)水处理时,加入的高铁酸钾(
 )作为净水消毒剂,发生反应的化学方程式为
)作为净水消毒剂,发生反应的化学方程式为 。
。①
 中Fe的化合价为
中Fe的化合价为②高铁酸钾可用于净水消毒的原因是
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式:
_______
 _______
_______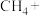 _______
_______ _______
_______ _______
_______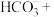 _______
_______
该反应中的氧化产物为
(3)无氧条件下加热,蓝铁矿(无杂质)发生分解:
 ,蓝铁矿的质量由5.02g减小为3.58g,则n=
,蓝铁矿的质量由5.02g减小为3.58g,则n=
您最近一年使用:0次