1 . 根据反应NH3+Cl2=NH4Cl+N2回答下列问题。
(1)配平系数为___________ ,
(2)氧化剂___________ ,还原剂___________ ;
(3)1molNH3参与反应转移电子数是___________ (用 表示);
表示);
(4)当生成28gN2时,被氧化的物质的物质的量是___________ mol。
(1)配平系数为
(2)氧化剂
(3)1molNH3参与反应转移电子数是
 表示);
表示);氧化剂与氧化产物的质量比
(4)当生成28gN2时,被氧化的物质的物质的量是
您最近一年使用:0次
名校
解题方法
2 . 现有下列物质:①Na2O2 ②NH4Cl ③HNO3 ④CO2 ⑤铜 ⑥FeCl3溶液 ⑦蔗糖
(1)上述状态的物质中,能导电有_______ (填序号)。
(2)③在水溶液中的电离方程式为_______ 。
(3)制作印刷电路板时⑥腐蚀铜的离子方程式为_______ ,反应中Fe3+被_______ (填“氧化”或“还原”)。
(4)标准状况下,由CO和CO2组成的混合气体33.6L,质量为56.4g,则该混合气体中,CO与CO2的物质的量之比为_______ 。
(5)⑤和③可发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应中若消耗8mol/L的硝酸 100 mL,则转移电子的数目为_______ 。
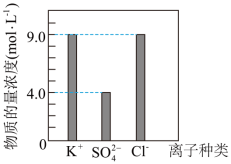
(6)某学习兴趣小组用KCl、K2SO4、NH4Cl固体配制了500mL无土栽培用的营养液。测得该营养液中部分离子的浓度柱状图如图所示,则该营养液中NH4Cl的物质的量为_______ 。
(1)上述状态的物质中,能导电有
(2)③在水溶液中的电离方程式为
(3)制作印刷电路板时⑥腐蚀铜的离子方程式为
(4)标准状况下,由CO和CO2组成的混合气体33.6L,质量为56.4g,则该混合气体中,CO与CO2的物质的量之比为
(5)⑤和③可发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应中若消耗8mol/L的硝酸 100 mL,则转移电子的数目为
(6)某学习兴趣小组用KCl、K2SO4、NH4Cl固体配制了500mL无土栽培用的营养液。测得该营养液中部分离子的浓度柱状图如图所示,则该营养液中NH4Cl的物质的量为

您最近一年使用:0次
名校
3 . ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列叙述中不正确的是
| A.碳元素被氧化,氯元素被还原 | B.ClO2是还原产物 |
| C.氧化性:KClO3>CO2 | D.1molKClO3参加反应有2mol 电子转移 |
您最近一年使用:0次
4 . 化工生产中用次磷酸钠(NaH2PO2 )进行化学镀铜,具有体系稳定性好、无毒性等优点,反应原理为 下列说法正确的是
下列说法正确的是
 下列说法正确的是
下列说法正确的是 | A.NaH2PO3中P 元素的化合价为+1 价 |
| B.反应中氧化剂只有CuSO4 |
| C.上述化学反应中每转移1mole⁻, 生成H211.2L(标准状况) |
| D.已知 H3PO2与足量NaOH反应生成NaH2PO2,则 NaH2PO2为正盐 |
您最近一年使用:0次
名校
5 . 高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、_________ 、_________ 。
②下列关于“容量瓶及其使用”的叙述中正确的是_________ (填序号)。
A.使用前必须检查是否漏水 B.能配制一定体积准确浓度的标准溶液
C.可用来长期贮存溶液 D.能用作溶解固体、稀释浓溶液的容器
③下列操作对实验结果的影响偏高的是_________ 。
A.加水定容时俯视刻度线
B.未洗涤溶解后的烧杯和玻璃棒
C.颠倒摇匀后发现凹液面低于刻度线,没有加水补到刻度线
D.未经冷却趁热将溶液注入容量瓶中并进行定容
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。原理如下:FeSO4 + KMnO4 + H2SO4 — K2SO4 + MnSO4 + Fe2(SO4)3 + H2O (未配平),实验时应测定的数据有:量取FeSO4溶液的体积和__________________ 。该反应中还原剂与氧化剂的物质的量之比为_________ 。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、
②下列关于“容量瓶及其使用”的叙述中正确的是
A.使用前必须检查是否漏水 B.能配制一定体积准确浓度的标准溶液
C.可用来长期贮存溶液 D.能用作溶解固体、稀释浓溶液的容器
③下列操作对实验结果的影响偏高的是
A.加水定容时俯视刻度线
B.未洗涤溶解后的烧杯和玻璃棒
C.颠倒摇匀后发现凹液面低于刻度线,没有加水补到刻度线
D.未经冷却趁热将溶液注入容量瓶中并进行定容
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。原理如下:FeSO4 + KMnO4 + H2SO4 — K2SO4 + MnSO4 + Fe2(SO4)3 + H2O (未配平),实验时应测定的数据有:量取FeSO4溶液的体积和
您最近一年使用:0次
名校
6 . 联氨(N2H4)可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述正确的是
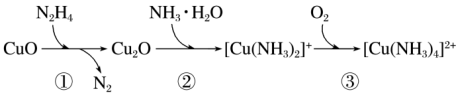

A.含铜的氧化物中, 比 比 稳定 稳定 |
| B.1 mol N2H4可处理水中1.5 mol O2 |
| C.[Cu(NH3)4]2+中存在离子键、配位键和极性共价键 |
D.③中发生的反应为 |
您最近一年使用:0次
7 . 黄铁矿(主要含 ,其中Fe的化合价为+2)是一种常见的含硫矿物,酸性条件下,黄铁矿中的
,其中Fe的化合价为+2)是一种常见的含硫矿物,酸性条件下,黄铁矿中的 可与空气中的
可与空气中的 发生反应。已知
发生反应。已知 与
与 反应的化学计量数之比为2∶7,且化合价发生变化的元素只有S和O,则
反应的化学计量数之比为2∶7,且化合价发生变化的元素只有S和O,则 中的S元素可能完全转化为
中的S元素可能完全转化为
 ,其中Fe的化合价为+2)是一种常见的含硫矿物,酸性条件下,黄铁矿中的
,其中Fe的化合价为+2)是一种常见的含硫矿物,酸性条件下,黄铁矿中的 可与空气中的
可与空气中的 发生反应。已知
发生反应。已知 与
与 反应的化学计量数之比为2∶7,且化合价发生变化的元素只有S和O,则
反应的化学计量数之比为2∶7,且化合价发生变化的元素只有S和O,则 中的S元素可能完全转化为
中的S元素可能完全转化为A. | B.S | C. | D. |
您最近一年使用:0次
名校
8 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.标准状况下, 中电子的数目为 中电子的数目为 |
B. 浓盐酸与足量的 浓盐酸与足量的 反应,转移电子的数目为 反应,转移电子的数目为 |
C.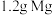 在空气中燃烧生成 在空气中燃烧生成 和 和 ,转移电子个数为 ,转移电子个数为 |
D.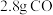 和 和 混合气体中含有的质子数为 混合气体中含有的质子数为 |
您最近一年使用:0次
2024-01-03更新
|
100次组卷
|
2卷引用:福建省厦门第六中学2023-2024学年高一上学期1月月考化学试题
名校
解题方法
9 . 向足量的浓盐酸中加入8.7g二氧化锰并加热,充分反应后,被氧化的HCl的物质的量为
| A.大于0.2mol | B.等于0.2mol | C.在0.2mol和0.4mol之间 | D.等于0.4mol |
您最近一年使用:0次
名校
10 . 下图是自然界中不同价态硫元素之间的转化关系图。回答下列问题:

(1)硫元素在自然界中的存在形态有___________ 和化合态,单质硫矿主要存在于___________ ; 硫单质有多种,正交硫和单斜硫,它们均为硫元素的___________ 。
(2)H2SO4 的电离方程式为___________ 。
(3)硫酸是重要的化工原料,接触法制硫酸主要分三步:
①煅烧黄铁矿(FeS2);_____FeS2 + _____O2 _____Fe2O3 + _____SO2
_____Fe2O3 + _____SO2 ___________ ;
②SO2 的接触氧化;___________ ;
③98.3% H2SO4 吸收:SO3 + H2O=H2SO4。
(4)Fe2O3 可用于焊接钢轨,写出反应的化学方程式___________ 。
(5)写出铜与浓硫酸反应的的化学方程式为___________ ,若反应产生672mL(标准状况)还原性气体,转移电子的数目为___________ 。

(1)硫元素在自然界中的存在形态有
(2)H2SO4 的电离方程式为
(3)硫酸是重要的化工原料,接触法制硫酸主要分三步:
①煅烧黄铁矿(FeS2);_____FeS2 + _____O2
 _____Fe2O3 + _____SO2
_____Fe2O3 + _____SO2 ②SO2 的接触氧化;
③98.3% H2SO4 吸收:SO3 + H2O=H2SO4。
(4)Fe2O3 可用于焊接钢轨,写出反应的化学方程式
(5)写出铜与浓硫酸反应的的化学方程式为
您最近一年使用:0次



