名校
1 . Ⅰ.元素的“价—类”二维图体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如下图所示。

回答下列问题:
(1)写出实验室利用两种固体物质加热制备物质R的化学方程式_______ 。
(2)下列有关图中所示含N、S物质的叙述,正确的是_______ (填标号)。
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与NaOH溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
Ⅱ.已知:①联氨(N2H4)在水中电离方式与NH3相似,若将NH3视为一元弱碱,则N2H4是一种二元弱碱。
②N2H4中N显-2价,既有氧化性又有还原性。在酸性溶液中以氧化性为主,还原产物是NH ,但大多数氧化还原反应的速率都很慢,在碱性溶液中以还原性为主,氧化产物一般是N2,通常总是把联氨用作强还原剂。
,但大多数氧化还原反应的速率都很慢,在碱性溶液中以还原性为主,氧化产物一般是N2,通常总是把联氨用作强还原剂。
(3)在实验室中可以用次氯酸钠和氨气常温制备联氨,反应的化学方程式为:_______ 。
(4)根据以上信息,推断下列关于N2H4的说法不正确的是________
(5)在标准状况下将1.92g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到只由NO2和NO组成的混合气体1.12L,则混合气体中NO的体积为________

回答下列问题:
(1)写出实验室利用两种固体物质加热制备物质R的化学方程式
(2)下列有关图中所示含N、S物质的叙述,正确的是
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与NaOH溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
Ⅱ.已知:①联氨(N2H4)在水中电离方式与NH3相似,若将NH3视为一元弱碱,则N2H4是一种二元弱碱。
②N2H4中N显-2价,既有氧化性又有还原性。在酸性溶液中以氧化性为主,还原产物是NH
 ,但大多数氧化还原反应的速率都很慢,在碱性溶液中以还原性为主,氧化产物一般是N2,通常总是把联氨用作强还原剂。
,但大多数氧化还原反应的速率都很慢,在碱性溶液中以还原性为主,氧化产物一般是N2,通常总是把联氨用作强还原剂。(3)在实验室中可以用次氯酸钠和氨气常温制备联氨,反应的化学方程式为:
(4)根据以上信息,推断下列关于N2H4的说法不正确的是________
| A.它与E形成的酸式盐可以表示为N2H5HSO4 |
| B.它溶于水所得的溶液中共有4种离子 |
C.它溶于水发生电离的第一步可表示为:N2H4+H2O N2H N2H +OH- +OH- |
| D.若已知联氨和四氧化二氮可以做火箭推进剂,两者反应产物可以是氮气和水 |
| A.56mL | B.112mL | C.224mL | D.448mL |
您最近一年使用:0次
名校
解题方法
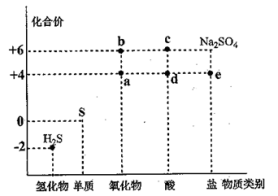
2 . 利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:

(1)质量相同的a和b,物质的量之比为_______ 。将H2S与a混合,发生反应的氧化剂与还原剂的物质的量之比为_______ 。
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为_______ 。
(3)将足量的a通入BaCl2溶液中,下列说法正确的是_______ (填标号)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入Cl2或NH3,则溶液中均会出现白色沉淀
(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:4Ag+2H2S+O2=2Ag2S + 2H2O。H2S在该反应中_______(填标号)。
(5)已知e为正盐,且能被酸性K2Cr2O7氧化为Na2SO4,Cr2O 被还原为Cr3+,写出此反应的离子方程式:
被还原为Cr3+,写出此反应的离子方程式:_______ 。

(1)质量相同的a和b,物质的量之比为
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为
(3)将足量的a通入BaCl2溶液中,下列说法正确的是
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入Cl2或NH3,则溶液中均会出现白色沉淀
(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:4Ag+2H2S+O2=2Ag2S + 2H2O。H2S在该反应中_______(填标号)。
| A.是氧化剂 | B.是还原剂 |
| C.既是氧化剂也是还原剂 | D.既不是氧化剂也不是还原剂 |
 被还原为Cr3+,写出此反应的离子方程式:
被还原为Cr3+,写出此反应的离子方程式:
您最近一年使用:0次
2022-02-22更新
|
930次组卷
|
3卷引用:山东省济南外国语学校2022-2023学年高一上学期12月月考化学试题
山东省济南外国语学校2022-2023学年高一上学期12月月考化学试题(已下线)第03讲 硫酸根离子的检验 含硫物质的转化(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册) 辽宁省朝阳市建平县实验中学2021-2022学年高一下学期期中考试化学试题
解题方法
3 . 利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:
(1)质量相同的 和
和 ,物质的量之比为
,物质的量之比为___________ 。
(2) 的浓溶液能与
的浓溶液能与 反应产生一种气体,该气体的化学式为
反应产生一种气体,该气体的化学式为___________ 。
(3)将足量的 通入
通入 溶液中,下列说法正确的是
溶液中,下列说法正确的是___________ (填标号)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入 或
或 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀
(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理: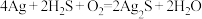 。
。 在该反应中
在该反应中___________ (填标号)。
A.是氧化剂 B.是还原剂 C.既是氧化剂也是还原剂 D.既不是氧化剂也不是还原剂
(5)已知 为正盐,且能被酸性
为正盐,且能被酸性 氧化为
氧化为 ,
, 被还原为
被还原为 ,写出此反应的离子方程式:
,写出此反应的离子方程式:___________ 。

(1)质量相同的
 和
和 ,物质的量之比为
,物质的量之比为(2)
 的浓溶液能与
的浓溶液能与 反应产生一种气体,该气体的化学式为
反应产生一种气体,该气体的化学式为(3)将足量的
 通入
通入 溶液中,下列说法正确的是
溶液中,下列说法正确的是A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入
 或
或 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:
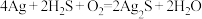 。
。 在该反应中
在该反应中A.是氧化剂 B.是还原剂 C.既是氧化剂也是还原剂 D.既不是氧化剂也不是还原剂
(5)已知
 为正盐,且能被酸性
为正盐,且能被酸性 氧化为
氧化为 ,
, 被还原为
被还原为 ,写出此反应的离子方程式:
,写出此反应的离子方程式:
您最近一年使用:0次
2021-02-05更新
|
578次组卷
|
3卷引用:山东省济南市2020-2021学年高一上学期学情诊断考试化学试题
山东省济南市2020-2021学年高一上学期学情诊断考试化学试题(已下线)5.1.3 不同价态含硫物质的转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)山东省高密市第三中学(创新学院)2022-2023学年高一上学期开学检测化学试题
名校
4 . Na2O2用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备Na2O2并检验其纯度的实验流程如图所示。

回答下列问题:
(1)生成Na2O2的化学方程式为___________ 。
(2)样液中加入MnO2后产生一种无色无味的气体单质,该气体的名称为___________ 。
(3)已知白色沉淀为BaCO3,生成该沉淀的化学方程式是___________ ,为防止Na2O2样品中含有的杂质生成需对空气进行预处理,预处理的措施是___________ 。
(4)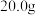 Na2O2样品可消耗
Na2O2样品可消耗 的BaCl2溶液
的BaCl2溶液 ,该样品的纯度为
,该样品的纯度为________ 。

回答下列问题:
(1)生成Na2O2的化学方程式为
(2)样液中加入MnO2后产生一种无色无味的气体单质,该气体的名称为
(3)已知白色沉淀为BaCO3,生成该沉淀的化学方程式是
(4)
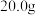 Na2O2样品可消耗
Na2O2样品可消耗 的BaCl2溶液
的BaCl2溶液 ,该样品的纯度为
,该样品的纯度为
您最近一年使用:0次
2023-08-10更新
|
236次组卷
|
6卷引用:山东省实验中学2022-2023学年高一上学期10月月考化学试题
名校
5 . 钴的化合物种类较多,其中三氯化六氨合(III){[Co(NH3)6]C13}(M=267.5g/mol),在工业上用途广泛。实验室以活性炭作为催化剂,以H2O2作氧化剂氧化CoC12的方法制备三氯化六氨合钴。
已知:①钴单质在300℃以上易被氧气氧化,CoC12易潮解。②Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强的还原性,[Co(NH3)6]3+性质稳定。
I.CoC12的制备。

(1)B装置中盛放浓盐酸的仪器名称是_______ 。
(2)按照气体流向从左到右连接仪器的顺序为_______ →_______ →_______ 。
(3)B装置的烧瓶中发生反应的离子方程式为_______ 。
(4)实验时,要先加入浓盐酸,使B装置中开始生成氯气,待_______ (填现象)时,再加热A装置,目的是_______ 。
II.三氯化六氨合钴(III)的制备。

①先向三颈烧瓶中加入活性炭、CoCl2和NH4Cl溶液,然后滴加稍过量的浓氨水;
②冷水浴冷却至10℃以下,缓慢滴加H2O2溶液并不断搅拌;
③转移至60℃水浴中,恒温加热同时缓慢搅拌;
④冷却结晶,过滤洗涤可得三氯化六氨合钴(III){[Co(NH3)6]Cl3)粗产品。
(5)D装置中制备三氯化六氨合钴(III)的总反应化学方程式为_______ 。
III.纯度测定。
(6)称取mg粗产品与氢氧化钠在空气中混合煅烧得氧化钴→将氧化钴用稀硫酸溶解→配成250mL溶液→_______ (按顺序填序号),纯度为_______ (写出表达式)。
a.向锥形瓶中加入稍过量的KI溶液(Co3+被还原后的产物为Co2+),充分反应
b.平行滴定三次,消耗标准溶液的体积平均值为VmL
c.取25.00mL待测液于锥形瓶中
d.用淀粉溶液作指示剂,用cmol·L-1Na2S2O3标准溶液滴定(产物为 )
)
已知:①钴单质在300℃以上易被氧气氧化,CoC12易潮解。②Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强的还原性,[Co(NH3)6]3+性质稳定。
I.CoC12的制备。

(1)B装置中盛放浓盐酸的仪器名称是
(2)按照气体流向从左到右连接仪器的顺序为
(3)B装置的烧瓶中发生反应的离子方程式为
(4)实验时,要先加入浓盐酸,使B装置中开始生成氯气,待
II.三氯化六氨合钴(III)的制备。

①先向三颈烧瓶中加入活性炭、CoCl2和NH4Cl溶液,然后滴加稍过量的浓氨水;
②冷水浴冷却至10℃以下,缓慢滴加H2O2溶液并不断搅拌;
③转移至60℃水浴中,恒温加热同时缓慢搅拌;
④冷却结晶,过滤洗涤可得三氯化六氨合钴(III){[Co(NH3)6]Cl3)粗产品。
(5)D装置中制备三氯化六氨合钴(III)的总反应化学方程式为
III.纯度测定。
(6)称取mg粗产品与氢氧化钠在空气中混合煅烧得氧化钴→将氧化钴用稀硫酸溶解→配成250mL溶液→
a.向锥形瓶中加入稍过量的KI溶液(Co3+被还原后的产物为Co2+),充分反应
b.平行滴定三次,消耗标准溶液的体积平均值为VmL
c.取25.00mL待测液于锥形瓶中
d.用淀粉溶液作指示剂,用cmol·L-1Na2S2O3标准溶液滴定(产物为
 )
)
您最近一年使用:0次
2022-06-02更新
|
985次组卷
|
4卷引用:山东师范大学附属中学2022届高三考前预测化学试题
名校
解题方法
6 . 氮化硅是一种性能优异的无机非金属材料,它的熔点高,硬度大,电绝缘性好,化学性质稳定,但生产成本较高。不溶于酸(氢氟酸除外)。高温下氧气及水蒸气能明显腐蚀氮化硅。一种用工业硅(含少量铁、铜的单质及氧化物)和 (含少量
(含少量 )合成氮化硅的工艺流程如下:
)合成氮化硅的工艺流程如下: 净化时,铜屑的作用是
净化时,铜屑的作用是_______ ;硅胶的作用是_______ 。
(2) 可能是
可能是_______ (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(3)如何说明氮化硅产品已用水洗干净?_______ 。
(4)推测氮化硅可能有哪些用途:_______ (填字母)。
a. 制作切削刀具 b. 制作坩埚 c. 制作耐高温轴承
(5)工业上还可以采用化学气相沉积法,在 的环境中,使
的环境中,使 与
与 在高温下反应生成
在高温下反应生成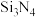 沉积在石墨表面,该反应的化学方程式为
沉积在石墨表面,该反应的化学方程式为_______ 。
 (含少量
(含少量 )合成氮化硅的工艺流程如下:
)合成氮化硅的工艺流程如下:
 净化时,铜屑的作用是
净化时,铜屑的作用是(2)
 可能是
可能是(3)如何说明氮化硅产品已用水洗干净?
(4)推测氮化硅可能有哪些用途:
a. 制作切削刀具 b. 制作坩埚 c. 制作耐高温轴承
(5)工业上还可以采用化学气相沉积法,在
 的环境中,使
的环境中,使 与
与 在高温下反应生成
在高温下反应生成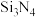 沉积在石墨表面,该反应的化学方程式为
沉积在石墨表面,该反应的化学方程式为
您最近一年使用:0次
2022-03-18更新
|
299次组卷
|
3卷引用:山东省济南市章丘区第四中学2021-2022学年高一下学期第一次质量检测化学试题
解题方法
7 . 水合肼(N2H4•H2O)是一种在生产生活中有着广泛用途的精细化工原料,具有强碱性和强还原性。实验室一般采用次氯酸钠(受热易分解)氧化尿素( )制备水合肼,制备过程可分为两个阶段:
)制备水合肼,制备过程可分为两个阶段:
(第一阶段)制备次氯酸钠。
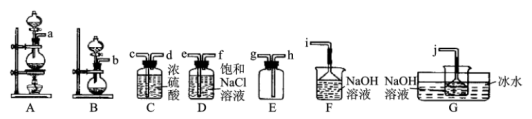
(1)某同学欲从图中选择部分装置,收集一瓶干燥的氯气,其连接次序为:a→__ (按气流方向,用小写字母表示)。
(2)实验中选用G装置作为次氯酸钠的合成装置,并采用冰水浴的原因是__ 。
(第二阶段)制备水合肼。
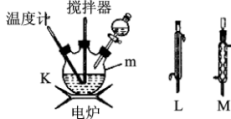
将第一阶段制备的次氯酸钠碱性溶液转移至分液漏斗中,慢慢滴加到盛有尿素的仪器m中,并不断搅拌;然后取下分液漏斗换上X装置,快速升温,在108℃的条件下回流5min;将混合物转移到蒸馏装置中进行蒸馏,收集108~114℃馏分,得水合肼产品。
(3)请写出此阶段制备水合肼的离子反应方程式___ 。
(4)X装置最好选用图中的___ (填“L”或“M”)。
(5)用分液漏斗加入次氯酸钠碱性溶液时,慢慢滴加的目的是__ 。
(6)水合肼还原法制取碘化钠固体,其制备流程如图所示:
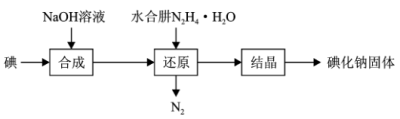
在“还原”过程中,主要消耗“合成”过程中生成的副产物IO ,该过程的化学方程式为
,该过程的化学方程式为__ 。工业上也可用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是__ 。
 )制备水合肼,制备过程可分为两个阶段:
)制备水合肼,制备过程可分为两个阶段:(第一阶段)制备次氯酸钠。

(1)某同学欲从图中选择部分装置,收集一瓶干燥的氯气,其连接次序为:a→
(2)实验中选用G装置作为次氯酸钠的合成装置,并采用冰水浴的原因是
(第二阶段)制备水合肼。

将第一阶段制备的次氯酸钠碱性溶液转移至分液漏斗中,慢慢滴加到盛有尿素的仪器m中,并不断搅拌;然后取下分液漏斗换上X装置,快速升温,在108℃的条件下回流5min;将混合物转移到蒸馏装置中进行蒸馏,收集108~114℃馏分,得水合肼产品。
(3)请写出此阶段制备水合肼的离子反应方程式
(4)X装置最好选用图中的
(5)用分液漏斗加入次氯酸钠碱性溶液时,慢慢滴加的目的是
(6)水合肼还原法制取碘化钠固体,其制备流程如图所示:

在“还原”过程中,主要消耗“合成”过程中生成的副产物IO
 ,该过程的化学方程式为
,该过程的化学方程式为
您最近一年使用:0次
2021-03-17更新
|
320次组卷
|
2卷引用:山东省济南市商河县第一中学2021-2022学年高三上学期11月期中考试化学试题
名校
解题方法
8 . 氯、铁的某些化合物在工业生产和生活中有着重要的作用。
(1)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。主要有两种制备方法:
方法一:工业上常常用 KClO3和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式___________ ,生成5molClO2转移电子__________ mol。
方法二:实验室用NCl3、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2,NCl3溶液和NaClO2溶液发生反应的离子方程式_______________ 。X中大量存在的阴离子有________________ 。

(2)铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
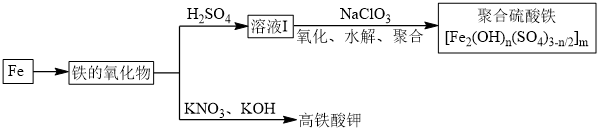
①检验固体铁的氧化物中铁的化合价,应使用的试剂是________ (填标号)。
a.稀硫酸 b.稀硝酸 c.KSCN溶液 d.酸性高锰酸钾溶液
②在溶液Ⅰ中加入NaClO3写出其氧化Fe2+的离子方程式:______________ 。
③Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸钾。完成并配平化学方程式:
_____ Fe2O3+_____ KNO3+_____ KOH—______ ______ +_____ KNO2+______ _______ 。
(1)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。主要有两种制备方法:
方法一:工业上常常用 KClO3和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式
方法二:实验室用NCl3、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2,NCl3溶液和NaClO2溶液发生反应的离子方程式

(2)铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:

①检验固体铁的氧化物中铁的化合价,应使用的试剂是
a.稀硫酸 b.稀硝酸 c.KSCN溶液 d.酸性高锰酸钾溶液
②在溶液Ⅰ中加入NaClO3写出其氧化Fe2+的离子方程式:
③Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸钾。完成并配平化学方程式:
您最近一年使用:0次
2020-08-22更新
|
280次组卷
|
3卷引用:2017届山东省济南一中高三上学期期中化学试卷
9 . 磷及其化合物在工农业生产中具有重要用途。回答下列问题:
(1)下图所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,被还原的元素是________ (填元素符号),过程III的化学方程式为__________ 。

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是常用的电极材料,其制备流程如下:

①复合材料中V的化合价为________ ,C的作用是____________ 。
②V2O5与H2C2O4反应生成V2(C2O4)3的化学方程式为____________ ;“洗涤”时用乙醇而不用水的目的是________________ 。
③锂离子电池是一种二次电池,又称“摇椅”电池。若用和LixC6和Li3V2(PO4)3/C做电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3= Li3V2(PO4)3+C6,则电池充电时阳极的电极反应式为___________ 。
(1)下图所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,被还原的元素是

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是常用的电极材料,其制备流程如下:

①复合材料中V的化合价为
②V2O5与H2C2O4反应生成V2(C2O4)3的化学方程式为
③锂离子电池是一种二次电池,又称“摇椅”电池。若用和LixC6和Li3V2(PO4)3/C做电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3= Li3V2(PO4)3+C6,则电池充电时阳极的电极反应式为
您最近一年使用:0次
2019-05-28更新
|
495次组卷
|
3卷引用:【市级联考】山东省济南市2019届高三下学期5月模拟考试理科综合化学试题
【市级联考】山东省济南市2019届高三下学期5月模拟考试理科综合化学试题安徽省宿州市2020年高三理综模拟卷(一)化学试题(已下线)专题二 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)
名校
10 . 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为___ 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___ (填下列字母序号)。
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式:_ NaCl+________ H2O=________ NaClO3+________ __ 。
②Ⅱ中转化的基本反应类型是___ 。
(1)与氯元素同族的短周期元素的原子结构示意图为
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液
 NaClO3溶液
NaClO3溶液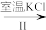 KClO3晶体
KClO3晶体①完成Ⅰ中反应的总化学方程式:
②Ⅱ中转化的基本反应类型是
您最近一年使用:0次



