名校
解题方法
1 . 研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。
I.以下是硫元素形成物质的“价—类”二维图及含硫物质相互转化的部分信息。
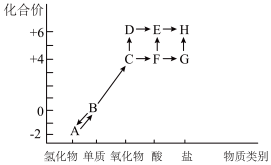
(1)G是一种由四种元素组成的钠盐,它的电离方程式是___________ 。
(2)C有毒,实验室可以用过量的NaOH溶液吸收,反应的离子方程式是___________ 。
(3)检验H中阴离子的实验操作及现象是_____________ 。
(4)C→F→E是造成酸雨的可能途径,请写出其中的化学方程式___________ 。
II.某小组同学设计实验实现几种价态硫元素的转化。可选用的实验药品如下:①Na2SO3溶液②浓硫酸③Na2S溶液④稀硫酸⑤酸性KMnO4溶液⑥品红溶液⑦铜片
(5)实验i选择的试剂是①和___________ (填序号),证明实现转化的现象是___________ ,该转化利用了Na2SO3的___________ 性。
(6)实验ii实现了-2价S向0价S的转化,相应的离子方程式为_____________ 。
I.以下是硫元素形成物质的“价—类”二维图及含硫物质相互转化的部分信息。

(1)G是一种由四种元素组成的钠盐,它的电离方程式是
(2)C有毒,实验室可以用过量的NaOH溶液吸收,反应的离子方程式是
(3)检验H中阴离子的实验操作及现象是
(4)C→F→E是造成酸雨的可能途径,请写出其中的化学方程式
II.某小组同学设计实验实现几种价态硫元素的转化。可选用的实验药品如下:①Na2SO3溶液②浓硫酸③Na2S溶液④稀硫酸⑤酸性KMnO4溶液⑥品红溶液⑦铜片
| 实验序号 | 预期转化 | 选择试剂(填序号) | 证明实现转化的现象 |
| i |  → → | ||
| ii | ①、③、④ | 淡黄色沉淀 | |
| iii |  → → | ②、⑦、⑥ |
(5)实验i选择的试剂是①和
(6)实验ii实现了-2价S向0价S的转化,相应的离子方程式为
您最近一年使用:0次
2023-12-19更新
|
300次组卷
|
3卷引用:第3课时 不同价态含硫物质的转化
2 . 某同学研究浓硝酸的氧化性,做了如下实验:
资料:
i. 中
中 、
、 、
、 元素的化合价依次为:
元素的化合价依次为: 价、
价、 价、
价、 价。
价。
ii. 的性质类似卤素离子,能被氧化为黄色的
的性质类似卤素离子,能被氧化为黄色的 ,
, 可聚合为红色的
可聚合为红色的 。
。
(1)写出实验Ⅰ中铜和浓硝酸反应的离子方程式______ 。
(2)甲同学对实验Ⅱ中红色褪去的原因提出猜想,浓硝酸氧化了 ,其理论依据是
,其理论依据是______ 。
甲同学为证明猜想,做了如下实验Ⅲ
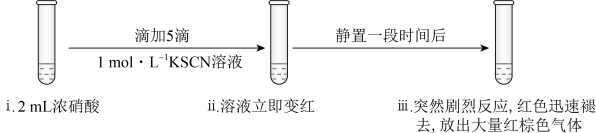
实验Ⅲ: 溶液,溶液立即变红是因为生成了
溶液,溶液立即变红是因为生成了______ (填化学式)。推测红棕色气体是______ (填化学式)。
(4)研究 的转化产物:
的转化产物:
实验Ⅳ:
a.将实验Ⅲ 中的气体通入
中的气体通入 和
和 的混合溶液中,有白色沉淀生成。
的混合溶液中,有白色沉淀生成。
b.过滤、洗涤白色沉淀,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少量 溶液,不褪色。
溶液,不褪色。
c.另取少量实验Ⅲ中反应后的溶液,加入 溶液,产生大量白色沉淀。
溶液,产生大量白色沉淀。
①通过 证实了红棕色气体中不含
证实了红棕色气体中不含 ,证据是
,证据是______ 。
② 中,
中, 溶液中加入
溶液中加入 溶液以增大
溶液以增大 浓度的目的是
浓度的目的是______ 。
③由上述实验现象可知: 转化的最终产物中一定有
转化的最终产物中一定有______ 。
序号 | 实验Ⅰ | 实验Ⅱ |
操作 | 1:2 | 1:2 |
实验现象 | 铜片迅速溶解,产生大量红棕色气体,溶液变成绿色 | 滴入硝酸后,溶液变为红色,一段时间后,溶液褪为无色。 |
i.
 中
中 、
、 、
、 元素的化合价依次为:
元素的化合价依次为: 价、
价、 价、
价、 价。
价。ii.
 的性质类似卤素离子,能被氧化为黄色的
的性质类似卤素离子,能被氧化为黄色的 ,
, 可聚合为红色的
可聚合为红色的 。
。(1)写出实验Ⅰ中铜和浓硝酸反应的离子方程式
(2)甲同学对实验Ⅱ中红色褪去的原因提出猜想,浓硝酸氧化了
 ,其理论依据是
,其理论依据是甲同学为证明猜想,做了如下实验Ⅲ
实验Ⅲ:
 溶液,溶液立即变红是因为生成了
溶液,溶液立即变红是因为生成了(4)研究
 的转化产物:
的转化产物:实验Ⅳ:
a.将实验Ⅲ
 中的气体通入
中的气体通入 和
和 的混合溶液中,有白色沉淀生成。
的混合溶液中,有白色沉淀生成。b.过滤、洗涤白色沉淀,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少量
 溶液,不褪色。
溶液,不褪色。c.另取少量实验Ⅲ中反应后的溶液,加入
 溶液,产生大量白色沉淀。
溶液,产生大量白色沉淀。①通过
 证实了红棕色气体中不含
证实了红棕色气体中不含 ,证据是
,证据是②
 中,
中, 溶液中加入
溶液中加入 溶液以增大
溶液以增大 浓度的目的是
浓度的目的是③由上述实验现象可知:
 转化的最终产物中一定有
转化的最终产物中一定有
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题
(1)呼吸面具中的供氧剂与二氧化碳反应的化学方程式_______ ,该反应与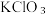 分解反应相比较,产生等分子数的气体,转移电子数目之比为
分解反应相比较,产生等分子数的气体,转移电子数目之比为_______ 。
(2) 溶于水,书写电离方程式
溶于水,书写电离方程式_______ ;检验该溶液中是否含有  ,所需试剂
,所需试剂_______ (填化学式),离子方程式_______ ;除去该溶液中的 杂质,涉及的离子方程式
杂质,涉及的离子方程式_______ ;检验 溶液中是否含有
溶液中是否含有 ,实验操作名称为
,实验操作名称为_______ 。
(3)分别取含等质量溶质的氢氧化钠溶液各 100mL,再分别通入一定量的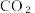 ,随后分别各取 20mL 溶液,向其中逐滴滴入稀盐酸,在标准状况下产生(CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B 两种情况):
,随后分别各取 20mL 溶液,向其中逐滴滴入稀盐酸,在标准状况下产生(CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B 两种情况):
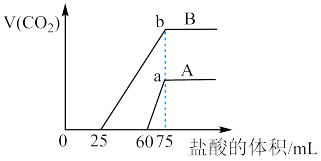
①在A情况下,加入盐酸0-60mL过程中,发生反应的离子方程式依次为_______ 、_______ 。
②图中a、b两点所示的溶液(加入盐酸均为75mL时)溶质分别为_______ 、_______ (生成的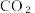 全部逸出),所含溶质的质量大小关系
全部逸出),所含溶质的质量大小关系_______
A. 相等 B. b点质量大 C. a 点质量大
(4) (O为-l价)性质与
(O为-l价)性质与 类似,既具有氧化性,也具有还原性。某小组同学分别选用酸性
类似,既具有氧化性,也具有还原性。某小组同学分别选用酸性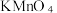 溶液、酸化的KI溶液与
溶液、酸化的KI溶液与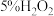 溶液反应验证其性质。(已知:淀粉遇
溶液反应验证其性质。(已知:淀粉遇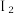 变蓝)
变蓝)

实验①利用了酸性高锰酸钾的_______ 性质,该实验中,证明 溶液与
溶液与 反应的现象除了溶液颜色变浅或褪色外,还有
反应的现象除了溶液颜色变浅或褪色外,还有_______ 。
实验②是为了验证 的
的_______ 性质,在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式_______ 。
(1)呼吸面具中的供氧剂与二氧化碳反应的化学方程式
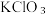 分解反应相比较,产生等分子数的气体,转移电子数目之比为
分解反应相比较,产生等分子数的气体,转移电子数目之比为(2)
 溶于水,书写电离方程式
溶于水,书写电离方程式 ,所需试剂
,所需试剂 杂质,涉及的离子方程式
杂质,涉及的离子方程式 溶液中是否含有
溶液中是否含有 ,实验操作名称为
,实验操作名称为(3)分别取含等质量溶质的氢氧化钠溶液各 100mL,再分别通入一定量的
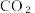 ,随后分别各取 20mL 溶液,向其中逐滴滴入稀盐酸,在标准状况下产生(CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B 两种情况):
,随后分别各取 20mL 溶液,向其中逐滴滴入稀盐酸,在标准状况下产生(CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B 两种情况):
①在A情况下,加入盐酸0-60mL过程中,发生反应的离子方程式依次为
②图中a、b两点所示的溶液(加入盐酸均为75mL时)溶质分别为
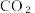 全部逸出),所含溶质的质量大小关系
全部逸出),所含溶质的质量大小关系A. 相等 B. b点质量大 C. a 点质量大
(4)
 (O为-l价)性质与
(O为-l价)性质与 类似,既具有氧化性,也具有还原性。某小组同学分别选用酸性
类似,既具有氧化性,也具有还原性。某小组同学分别选用酸性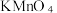 溶液、酸化的KI溶液与
溶液、酸化的KI溶液与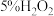 溶液反应验证其性质。(已知:淀粉遇
溶液反应验证其性质。(已知:淀粉遇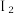 变蓝)
变蓝)
实验①利用了酸性高锰酸钾的
 溶液与
溶液与 反应的现象除了溶液颜色变浅或褪色外,还有
反应的现象除了溶液颜色变浅或褪色外,还有实验②是为了验证
 的
的
您最近一年使用:0次
4 . 在处理NO废气的过程中,催化剂 会逐渐失活变为
会逐渐失活变为 。
。
某小组为解决这一问题,实验研究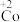 和
和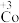 之间的相互转化。
之间的相互转化。
资料:i.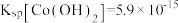 ;
;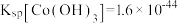 。
。
ii.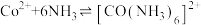
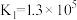 ;
;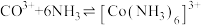
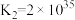 。
。
iii. 和
和 在酸性条件下均能生成
在酸性条件下均能生成 。
。
(1)探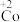 的还原性
的还原性
实验I 粉红色的 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。
实验Ⅱ 向 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ 按如图装置进行实验,观察到电压表指针偏转。 可以被酸性
可以被酸性 溶液氧化。乙同学补充实验IV,
溶液氧化。乙同学补充实验IV,_______ (补全实验操作及现象),否定了该观点。
②探究碱性条件下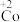 的还原性,进行实验。
的还原性,进行实验。_______ 。
③根据氧化还原反应规律解释还原性 :
: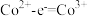 在碱性条件下,
在碱性条件下, 与
与 、
、 反应,使
反应,使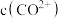 和
和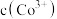 均降低,但
均降低,但_______ 降低的程度更大,还原剂的还原性增强。
(2)探究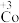 的氧化性
的氧化性
①根据实验Ⅲ和IV推测氧化性: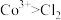 ,设计实验证明:向V中得到的棕褐色沉淀中,
,设计实验证明:向V中得到的棕褐色沉淀中,_______ (补全实验操作及现象),反应方程式为_______ 。
②向V中得到的棕褐色沉淀中,滴加 溶液,加入催化剂,产生无色气泡,该气体是
溶液,加入催化剂,产生无色气泡,该气体是_______ 。
(3)催化剂 的失活与再生
的失活与再生
①结合数据解释 能被氧化为
能被氧化为 而失活的原因:
而失活的原因:_______ 。
②根据以上实验,设计物质转化流程图 实现 的再生:
的再生:_______ 。示例:
 会逐渐失活变为
会逐渐失活变为 。
。某小组为解决这一问题,实验研究
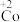 和
和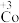 之间的相互转化。
之间的相互转化。资料:i.
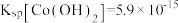 ;
;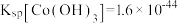 。
。ii.
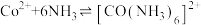
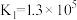 ;
;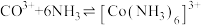
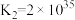 。
。iii.
 和
和 在酸性条件下均能生成
在酸性条件下均能生成 。
。(1)探
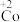 的还原性
的还原性实验I 粉红色的
 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。实验Ⅱ 向
 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ 按如图装置进行实验,观察到电压表指针偏转。
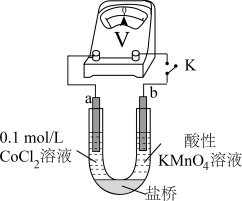
 可以被酸性
可以被酸性 溶液氧化。乙同学补充实验IV,
溶液氧化。乙同学补充实验IV,②探究碱性条件下
 的还原性,进行实验。
的还原性,进行实验。实验V: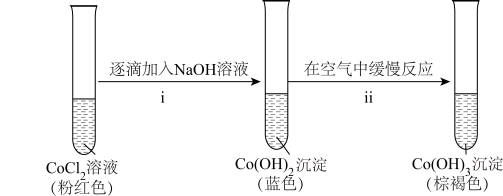
③根据氧化还原反应规律解释还原性
 :
: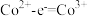 在碱性条件下,
在碱性条件下, 与
与 、
、 反应,使
反应,使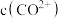 和
和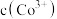 均降低,但
均降低,但(2)探究
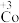 的氧化性
的氧化性①根据实验Ⅲ和IV推测氧化性:
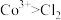 ,设计实验证明:向V中得到的棕褐色沉淀中,
,设计实验证明:向V中得到的棕褐色沉淀中,②向V中得到的棕褐色沉淀中,滴加
 溶液,加入催化剂,产生无色气泡,该气体是
溶液,加入催化剂,产生无色气泡,该气体是(3)催化剂
 的失活与再生
的失活与再生①结合数据解释
 能被氧化为
能被氧化为 而失活的原因:
而失活的原因:②根据以上实验,设计物质转化
 的再生:
的再生:
您最近一年使用:0次
名校
5 . 某实验小组欲通过加热蒸发硝酸钾( )溶液的方法获得
)溶液的方法获得 固体。已知
固体。已知 固体在一定温度下能发生反应:
固体在一定温度下能发生反应: 。为了探究加热蒸发所得固体X中是否含有亚硝酸钾(
。为了探究加热蒸发所得固体X中是否含有亚硝酸钾( ),小组同学设计并完成了以下实验。
),小组同学设计并完成了以下实验。
【查阅资料】
ⅰ. 是微溶于水的白色(略带黄色)固体
是微溶于水的白色(略带黄色)固体
ⅱ. 、
、 能在酸性条件下与
能在酸性条件下与 反应,生成
反应,生成
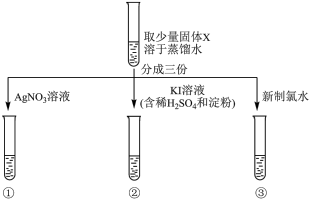
【实验过程】
【分析解释】
(1)在 反应中,
反应中, 和
和 属于
属于___________ (填“酸”或“碱”或“盐”)。
(2)N的原子结构示意图为___________ 。从化合价的角度预测, 具有的性质是
具有的性质是___________ (填“氧化性”或“还原性”或“既有氧化性,又有还原性”)。
(3)实验①中,观察到有少量白色沉淀生成,该白色沉淀是___________
(4)实验②中,观察到的现象是___________
(5)实验③中,观察到新制氯水褪色,利用对比实验排除了稀释对溶液颜色变化的影响。补齐该反应的离子方程式。__________
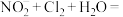 □___________
□___________ □___________。
□___________。
【反思评价】
(6)综合上述实验,甲同学得出以下结论。你认为甲同学所得结论正确的是___________
a.从试管②中的现象可得出酸性条件下,氧化性: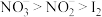
b.试管①、③中的实验现象均可以证明固体X中含有
 )溶液的方法获得
)溶液的方法获得 固体。已知
固体。已知 固体在一定温度下能发生反应:
固体在一定温度下能发生反应: 。为了探究加热蒸发所得固体X中是否含有亚硝酸钾(
。为了探究加热蒸发所得固体X中是否含有亚硝酸钾( ),小组同学设计并完成了以下实验。
),小组同学设计并完成了以下实验。【查阅资料】
ⅰ.
 是微溶于水的白色(略带黄色)固体
是微溶于水的白色(略带黄色)固体ⅱ.
 、
、 能在酸性条件下与
能在酸性条件下与 反应,生成
反应,生成
【实验过程】

【分析解释】
(1)在
 反应中,
反应中, 和
和 属于
属于(2)N的原子结构示意图为
 具有的性质是
具有的性质是(3)实验①中,观察到有少量白色沉淀生成,该白色沉淀是
(4)实验②中,观察到的现象是
(5)实验③中,观察到新制氯水褪色,利用对比实验排除了稀释对溶液颜色变化的影响。补齐该反应的离子方程式。
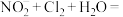 □___________
□___________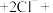 □___________。
□___________。【反思评价】
(6)综合上述实验,甲同学得出以下结论。你认为甲同学所得结论正确的是
a.从试管②中的现象可得出酸性条件下,氧化性:
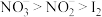
b.试管①、③中的实验现象均可以证明固体X中含有

您最近一年使用:0次
名校
6 . 已知下列实验事实:
①Cr2O3固体既能溶于 KOH 溶液得到 KCrO2溶液,又能溶于硫酸得到 Cr2(SO4)3溶液;
②将K2Cr2O7溶液滴加到淀粉和 KI 的混合溶液中,溶液变蓝;
③向KCrO2溶液中滴加 H2O2溶液,再酸化可得K2Cr2O7溶液。下列判断不 正确的是
①Cr2O3固体既能溶于 KOH 溶液得到 KCrO2溶液,又能溶于硫酸得到 Cr2(SO4)3溶液;
②将K2Cr2O7溶液滴加到淀粉和 KI 的混合溶液中,溶液变蓝;
③向KCrO2溶液中滴加 H2O2溶液,再酸化可得K2Cr2O7溶液。下列判断
| A.实验①证明Cr2O3是两性氧化物 |
| B.实验②证明氧化性:K2Cr2O7>I₂ |
| C.实验③中H2O2是氧化剂, K2Cr2O7是氧化产物 |
D.由上述实验不可能推出:  |
您最近一年使用:0次
名校
7 . “大象牙膏”是一种神奇的化学反应,它会喷出大量的泡沫,就像是普通牙膏一样,人们给它取了一个大象牙膏的名字,大象牙膏( )的原理是双氧水+催化剂+发泡剂,混合时催化剂加快双氧水分解速率,分解出大量氧气。某小组同学欲探究
)的原理是双氧水+催化剂+发泡剂,混合时催化剂加快双氧水分解速率,分解出大量氧气。某小组同学欲探究 的性质,过程如下:
的性质,过程如下:

【预测】聚焦 中的O作为核心元素,预测
中的O作为核心元素,预测 既具有氧化性,也具有还原性。
既具有氧化性,也具有还原性。
(1)预测其具有氧化性的思路是___________ 。
【实验和观察】小组同学分别选用酸性KMnO4溶液、酸性KI溶液与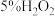 溶液反应以验证预测。已知:MnO
溶液反应以验证预测。已知:MnO 酸性条件下被还原成Mn2+,淀粉遇
酸性条件下被还原成Mn2+,淀粉遇 变蓝色。
变蓝色。
(2)实验①利用了酸性高锰酸钾的___________ (填“氧化性”或“还原性”),该实验中,证明酸性 溶液与
溶液与 溶液反应的现象除了溶液颜色变浅或褪色外还有
溶液反应的现象除了溶液颜色变浅或褪色外还有___________ 。请配平该反应的离子方程式:________
___________MnO +___________H2O2+___________H+=___________Mn2++___________O2↑+___________H2O。
+___________H2O2+___________H+=___________Mn2++___________O2↑+___________H2O。
(3)实验②是为了验证 的
的___________ (填“氧化性”或“还原性”),在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式___________ 。
解释和结论:以上实验可得出的结论是:H2O2既具有氧化性,也有还原性。
 )的原理是双氧水+催化剂+发泡剂,混合时催化剂加快双氧水分解速率,分解出大量氧气。某小组同学欲探究
)的原理是双氧水+催化剂+发泡剂,混合时催化剂加快双氧水分解速率,分解出大量氧气。某小组同学欲探究 的性质,过程如下:
的性质,过程如下:
【预测】聚焦
 中的O作为核心元素,预测
中的O作为核心元素,预测 既具有氧化性,也具有还原性。
既具有氧化性,也具有还原性。(1)预测其具有氧化性的思路是
【实验和观察】小组同学分别选用酸性KMnO4溶液、酸性KI溶液与
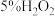 溶液反应以验证预测。已知:MnO
溶液反应以验证预测。已知:MnO 酸性条件下被还原成Mn2+,淀粉遇
酸性条件下被还原成Mn2+,淀粉遇 变蓝色。
变蓝色。(2)实验①利用了酸性高锰酸钾的
 溶液与
溶液与 溶液反应的现象除了溶液颜色变浅或褪色外还有
溶液反应的现象除了溶液颜色变浅或褪色外还有___________MnO
 +___________H2O2+___________H+=___________Mn2++___________O2↑+___________H2O。
+___________H2O2+___________H+=___________Mn2++___________O2↑+___________H2O。(3)实验②是为了验证
 的
的解释和结论:以上实验可得出的结论是:H2O2既具有氧化性,也有还原性。
您最近一年使用:0次
名校
解题方法
8 . 资料显示, 能还原
能还原 、
、 ,某小组对此进行探究。
,某小组对此进行探究。
实验:将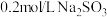 溶液滴入到物质a中,记录如下:
溶液滴入到物质a中,记录如下:
(1)用化学用语解释 溶液呈碱性的原因
溶液呈碱性的原因___________ 。
(2)经检验,I中白色沉淀是 。用酸性
。用酸性 溶液证实白色沉淀中含有
溶液证实白色沉淀中含有 ,现象是
,现象是___________ 。
(3)重新设计实验(III),证实了: 能还原
能还原 ,装置如下图所示。
,装置如下图所示。
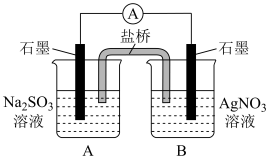
现象:i.电流表指针偏转。
ii.B中石墨电极上析出白色固体。
取出少量白色固体,洗涤后,___________ (填操作和现象),证明白色固体中含有Ag。
(4)经检验,II中的棕黄色沉淀不含 ,含有
,含有 、
、 和
和 。
。
资料: ,
, 。
。
①用稀 溶解沉淀,析出红色固体,说明棕黄色沉淀中含有
溶解沉淀,析出红色固体,说明棕黄色沉淀中含有___________ 。
②通过下列实验证实,沉淀中含有 和上层清液中仍检出了
和上层清液中仍检出了 (忽略空气的影响)。
(忽略空气的影响)。
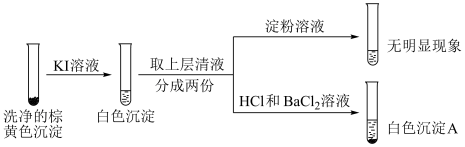
i.白色沉淀A是 。
。
ii.根据资料,上层清液加入淀粉后应该变蓝。分析现象与资料不符的原因:
原因一:KI未被氧化。则将 氧化的微粒是
氧化的微粒是___________ 。
原因二:KI被氧化,由于___________ (用离子方程式表示),所以无明显现象。
③当加入的KI过量且反应充分时,白色沉淀中不含Cu单质,上层清液中仍检出了 。结合物质组成、化学反应等解释上层清液中检出
。结合物质组成、化学反应等解释上层清液中检出 的原因
的原因___________ 。
小结:I中: 未能还原
未能还原 的原因与反应速率、离子浓度变化等因素有关。
的原因与反应速率、离子浓度变化等因素有关。
 能还原
能还原 、
、 ,某小组对此进行探究。
,某小组对此进行探究。实验:将
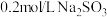 溶液滴入到物质a中,记录如下:
溶液滴入到物质a中,记录如下:| 序号 | 装置 | 物质a | 现象 |
| I |  2 mL 物质a | 饱和 溶液 溶液 | 产生白色沉淀 |
| II | 0.2 mol/L  溶液 溶液 | 溶液变绿,继续滴加产生棕黄色沉淀 |
(1)用化学用语解释
 溶液呈碱性的原因
溶液呈碱性的原因(2)经检验,I中白色沉淀是
 。用酸性
。用酸性 溶液证实白色沉淀中含有
溶液证实白色沉淀中含有 ,现象是
,现象是(3)重新设计实验(III),证实了:
 能还原
能还原 ,装置如下图所示。
,装置如下图所示。
现象:i.电流表指针偏转。
ii.B中石墨电极上析出白色固体。
取出少量白色固体,洗涤后,
(4)经检验,II中的棕黄色沉淀不含
 ,含有
,含有 、
、 和
和 。
。资料:
 ,
, 。
。①用稀
 溶解沉淀,析出红色固体,说明棕黄色沉淀中含有
溶解沉淀,析出红色固体,说明棕黄色沉淀中含有②通过下列实验证实,沉淀中含有
 和上层清液中仍检出了
和上层清液中仍检出了 (忽略空气的影响)。
(忽略空气的影响)。
i.白色沉淀A是
 。
。ii.根据资料,上层清液加入淀粉后应该变蓝。分析现象与资料不符的原因:
原因一:KI未被氧化。则将
 氧化的微粒是
氧化的微粒是原因二:KI被氧化,由于
③当加入的KI过量且反应充分时,白色沉淀中不含Cu单质,上层清液中仍检出了
 。结合物质组成、化学反应等解释上层清液中检出
。结合物质组成、化学反应等解释上层清液中检出 的原因
的原因小结:I中:
 未能还原
未能还原 的原因与反应速率、离子浓度变化等因素有关。
的原因与反应速率、离子浓度变化等因素有关。
您最近一年使用:0次
2024高三下·全国·专题练习
9 . 8月1日起,为了国家信息安全,我国禁止镓和锗的出口,锗是一种重要的半导体材料,工业上用精硫锗矿(主要成分为GeS2)制取高纯度锗的工艺流程如图所示:

(1)COCl2分子中各原子均达到8电子稳定结构,其结构式为___________ 。
(2)800℃升华时通入N2的目的是:___________ 、___________ 。
(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式:___________ ,酸浸时温度不能过高的原因是___________ 。
(4)GeCl4易水解生成GeCl4·n H2O,证明GeCl4·n H2O沉淀洗涤干净的方法是___________ 。

(1)COCl2分子中各原子均达到8电子稳定结构,其结构式为
(2)800℃升华时通入N2的目的是:
(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式:
(4)GeCl4易水解生成GeCl4·n H2O,证明GeCl4·n H2O沉淀洗涤干净的方法是
您最近一年使用:0次
10 . 已知下述三个实验均能发生化学反应:
下列判断正确的是
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴氯水 | 将铜丝放入氯化铁溶液中 |
| A.实验①中铁钉只作还原剂 | B.实验②中 既显氧化性又显还原性 既显氧化性又显还原性 |
| C.实验③中发生的是置换反应 | D.上述实验证明氧化性: |
您最近一年使用:0次



