1 . 某同学用下图所示装置测定 与
与 固体混合物中
固体混合物中 的质量分数。
的质量分数。

有如下实验步骤:
①称取m g混合物放入硬质玻璃管中;称量装有碱石灰的U形管D的质量(m1 g);
②按图组装好实验装置并检查气密性;
③关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体;
④打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟;
⑤打开活塞K1,缓缓鼓入空气数分钟后拆下装置,再次称量U形管D的质量(m2 g)。
回答下列问题:
(1)装置B中发生反应的化学方程式为___________ 。
(2)正确的操作顺序是___________ 。
(3)样品中 的质量分数为
的质量分数为___________ (用含m、m1、m2的式子表示)。
(4)若无E装置,则测得的 的质量分数将
的质量分数将___________ (填“偏大”“偏小”或“无影响”)。
(5)使用如图装置也可以测量反应产生气体的体积,则广口瓶中所用试剂最好选用___________(填标号)。

 与
与 固体混合物中
固体混合物中 的质量分数。
的质量分数。
有如下实验步骤:
①称取m g混合物放入硬质玻璃管中;称量装有碱石灰的U形管D的质量(m1 g);
②按图组装好实验装置并检查气密性;
③关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体;
④打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟;
⑤打开活塞K1,缓缓鼓入空气数分钟后拆下装置,再次称量U形管D的质量(m2 g)。
回答下列问题:
(1)装置B中发生反应的化学方程式为
(2)正确的操作顺序是
(3)样品中
 的质量分数为
的质量分数为(4)若无E装置,则测得的
 的质量分数将
的质量分数将(5)使用如图装置也可以测量反应产生气体的体积,则广口瓶中所用试剂最好选用___________(填标号)。

| A.饱和碳酸钠溶液 | B.饱和碳酸氢钠溶液 | C.饱和氢氧化钠溶液 | D.饱和氯化钠溶液 |
您最近一年使用:0次
2021-12-02更新
|
996次组卷
|
5卷引用:山东省日照市五莲县2021-2022学年高一上学期期中考试化学试题
山东省日照市五莲县2021-2022学年高一上学期期中考试化学试题山东省日照市莒县、五莲县、岚山区2021-2022学年高一11月联合考试化学试题(已下线)第十单元 化学实验基础(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)第08讲 碳酸钠和碳酸氢钠 焰色试验-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )(已下线)第08讲 碳酸钠和碳酸氢钠 焰色试验-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )
解题方法
2 . 我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,如图为联合制碱法的主要过程(部分物质已略去)。
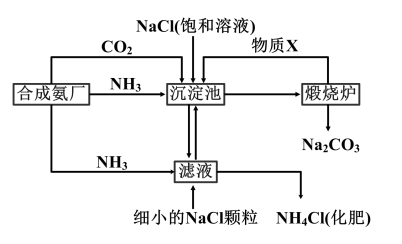
资料:i.沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。
ii溶解性:1体积水溶解700体积NH3,1体积水溶解1体积CO2。
(1)CO2和NH3通入沉淀池的顺序依次是___ 。
A.先通CO2后通NH3 B.先通NH3后通CO2 C.任何顺序都可以
(2)煅烧炉中反应的化学方程式是___ ,物质X是___ (填化学式)。
(3)下列说法正确的是___ (填字母)。
A.沉淀池中有NaHCO3析出,是因为一定条件下NaHCO3的溶解度最小
B.滤液中主要含有NaCl、Na2CO3和NH4Cl
C.设计循环的目的是提高原料的利用率
(4)某纯碱样品中含杂质NaCl,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中Na2CO3的质量分数为___ 。

资料:i.沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。
ii溶解性:1体积水溶解700体积NH3,1体积水溶解1体积CO2。
| 物质 | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
| 20℃溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
(1)CO2和NH3通入沉淀池的顺序依次是
A.先通CO2后通NH3 B.先通NH3后通CO2 C.任何顺序都可以
(2)煅烧炉中反应的化学方程式是
(3)下列说法正确的是
A.沉淀池中有NaHCO3析出,是因为一定条件下NaHCO3的溶解度最小
B.滤液中主要含有NaCl、Na2CO3和NH4Cl
C.设计循环的目的是提高原料的利用率
(4)某纯碱样品中含杂质NaCl,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中Na2CO3的质量分数为
您最近一年使用:0次
名校
解题方法
3 . 过碳酸钠(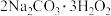 )是过氧化物类的消毒剂。可以利用侯氏制碱法得到的
)是过氧化物类的消毒剂。可以利用侯氏制碱法得到的 进行制备,流程图如图1所示:
进行制备,流程图如图1所示:

已知:①产物A中可能含有少量的 、
、 金属离子杂质,②硅酸钠可与
金属离子杂质,②硅酸钠可与 、
、 等金属离子形成沉淀,③异丙醇的作用为洗涤晶体。请回答下列问题:
等金属离子形成沉淀,③异丙醇的作用为洗涤晶体。请回答下列问题:
(1)虚线框中是侯氏制碱法的原理,某同学用图2所示装置在实验室模拟侯氏制碱法,实验中应先向___________ (填a或b)中,通入___________ 气体。有同学建议在图2甲装置的b导管下端连接c装置,理由是___________ 。
(2)反应Ⅰ的化学反应方程式为___________ 。
(3)“反应Ⅱ”需控制温度在20℃左右,其目的是:___________ ,写出“反应Ⅱ”中生成产品D的化学方程式___________ ,加 的作用是
的作用是___________ 。
(4)流程图中可循环使用的物质有___________ 。
(5)过碳酸钠是一种有多用途的新型氧系固态漂白剂,它具有 和
和 的双重性质,下列物质不会使过碳酸钠失效的是___________。
的双重性质,下列物质不会使过碳酸钠失效的是___________。
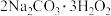 )是过氧化物类的消毒剂。可以利用侯氏制碱法得到的
)是过氧化物类的消毒剂。可以利用侯氏制碱法得到的 进行制备,流程图如图1所示:
进行制备,流程图如图1所示:
已知:①产物A中可能含有少量的
 、
、 金属离子杂质,②硅酸钠可与
金属离子杂质,②硅酸钠可与 、
、 等金属离子形成沉淀,③异丙醇的作用为洗涤晶体。请回答下列问题:
等金属离子形成沉淀,③异丙醇的作用为洗涤晶体。请回答下列问题:(1)虚线框中是侯氏制碱法的原理,某同学用图2所示装置在实验室模拟侯氏制碱法,实验中应先向
(2)反应Ⅰ的化学反应方程式为
(3)“反应Ⅱ”需控制温度在20℃左右,其目的是:
 的作用是
的作用是(4)流程图中可循环使用的物质有
(5)过碳酸钠是一种有多用途的新型氧系固态漂白剂,它具有
 和
和 的双重性质,下列物质不会使过碳酸钠失效的是___________。
的双重性质,下列物质不会使过碳酸钠失效的是___________。A. | B.稀盐酸 | C. 溶液 溶液 | D. 溶液 溶液 |
您最近一年使用:0次
4 . 向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示:

(1)原NaOH溶液的浓度为_______
(2)通入CO2在标准状况下的体积为_______ mL
(3)所得溶液的溶质成分及物质的量之比为_______
(4)在配制盐酸溶液时,将标况下VLHCl气体溶于100mL水中,所得溶液密度为d g·cm-3,则此溶液的物质的量浓度为_______ mol·L-1

(1)原NaOH溶液的浓度为
(2)通入CO2在标准状况下的体积为
(3)所得溶液的溶质成分及物质的量之比为
(4)在配制盐酸溶液时,将标况下VLHCl气体溶于100mL水中,所得溶液密度为d g·cm-3,则此溶液的物质的量浓度为
您最近一年使用:0次
2021-10-26更新
|
255次组卷
|
2卷引用:天津市静海区第一中学2021-2022学年高三上学期(9月)学生学业能力调研化学试题
名校
解题方法
5 . 某萃铜余液主要含有 、
、 、
、 、
、 ,
, 等离子,从萃铜余液中回收金属和制备
等离子,从萃铜余液中回收金属和制备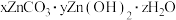 的工艺流程如图甲所示。
的工艺流程如图甲所示。

回答下列问题:
(1)过硫酸钠( )中
)中 的化合价为
的化合价为 ,
,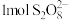 中过氧键的数目为
中过氧键的数目为___________ 。向 的萃铜余液中加入
的萃铜余液中加入 。进行“氧化除锰”,其反应的离子方程式为
。进行“氧化除锰”,其反应的离子方程式为___________ 。“氧化除锰”过程中,
___________ (填“能”或“不能”)用绿色氧化剂 来代替。
来代替。
(2)向“氧化除锰”后的余液中加入试剂 调节
调节 使铁元素完全沉淀,试剂
使铁元素完全沉淀,试剂 的化学式为
的化学式为___________ 。
(3)“沉锌”时,应保持溶液 在6.8~7.0之间,
在6.8~7.0之间, 不能过低的原因是
不能过低的原因是___________ 。
(4)“过滤”时,经常采用抽滤的方式加快过滤的速度。实验室用如图乙所示的装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→___________ →___________ →___________ →___________ →c→关抽气泵。
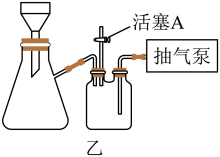
a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(5)高温煅烧碱式碳酸锌[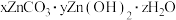 ]得到
]得到 ,取碱式碳酸锌
,取碱式碳酸锌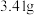 ,在高温下煅烧至恒重,得到固体
,在高温下煅烧至恒重,得到固体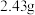 和标准状况下
和标准状况下 ,则该碱式碳酸锌的化学式为
,则该碱式碳酸锌的化学式为___________ 。
 、
、 、
、 、
、 ,
, 等离子,从萃铜余液中回收金属和制备
等离子,从萃铜余液中回收金属和制备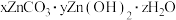 的工艺流程如图甲所示。
的工艺流程如图甲所示。
回答下列问题:
(1)过硫酸钠(
 )中
)中 的化合价为
的化合价为 ,
,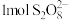 中过氧键的数目为
中过氧键的数目为 的萃铜余液中加入
的萃铜余液中加入 。进行“氧化除锰”,其反应的离子方程式为
。进行“氧化除锰”,其反应的离子方程式为
 来代替。
来代替。(2)向“氧化除锰”后的余液中加入试剂
 调节
调节 使铁元素完全沉淀,试剂
使铁元素完全沉淀,试剂 的化学式为
的化学式为(3)“沉锌”时,应保持溶液
 在6.8~7.0之间,
在6.8~7.0之间, 不能过低的原因是
不能过低的原因是(4)“过滤”时,经常采用抽滤的方式加快过滤的速度。实验室用如图乙所示的装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→

a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(5)高温煅烧碱式碳酸锌[
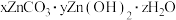 ]得到
]得到 ,取碱式碳酸锌
,取碱式碳酸锌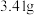 ,在高温下煅烧至恒重,得到固体
,在高温下煅烧至恒重,得到固体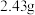 和标准状况下
和标准状况下 ,则该碱式碳酸锌的化学式为
,则该碱式碳酸锌的化学式为
您最近一年使用:0次
2021-09-09更新
|
1567次组卷
|
9卷引用:全国2022届高三上学期第一次学业质量联合检测化学试题
全国2022届高三上学期第一次学业质量联合检测化学试题广东省珠海市第二中学2022届高三十月月考化学试题山东省潍坊市第一中学2022届高三10月月考化学试题陕西省西安市长安区第一中学2022届高三第一次模拟考试化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】07(已下线)第19周 晚练题-备战2022年高考化学周测与晚练(新高考专用)(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题(已下线)2019年高考浙江卷化学试题变式题(实验题)
6 . 我国制碱专家侯德榜先生潜心研究制碱技术,发明了侯氏制碱法。工业上以侯氏制碱法为基础生产焦亚硫酸钠 的工艺流程如下:
的工艺流程如下:
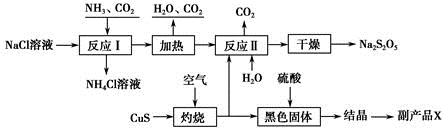
已知:反应Ⅱ包含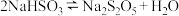 等多步反应。
等多步反应。
(1)反应Ⅰ的化学方程式为___________ ;在进行反应Ⅰ时,向NaCl溶液中先通入___________  填“
填“ ”或“
”或“ ”
” ;
;
(2)“灼烧”时发生反应的化学方程式为___________ ;
(3)已知 与稀硫酸反应放出
与稀硫酸反应放出 ,其离子方程式为
,其离子方程式为___________ ;
(4)副产品X化学式为___________ ;生产中可循环利用的物质为___________  化学式
化学式 ;
;
(5)为了减少产品 中的杂质含量,理论上需控制反应Ⅱ中气体与固体反应物的物质的量之比为
中的杂质含量,理论上需控制反应Ⅱ中气体与固体反应物的物质的量之比为___________ 。
 的工艺流程如下:
的工艺流程如下:
已知:反应Ⅱ包含
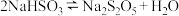 等多步反应。
等多步反应。(1)反应Ⅰ的化学方程式为
 填“
填“ ”或“
”或“ ”
” ;
;(2)“灼烧”时发生反应的化学方程式为
(3)已知
 与稀硫酸反应放出
与稀硫酸反应放出 ,其离子方程式为
,其离子方程式为(4)副产品X化学式为
 化学式
化学式 ;
;(5)为了减少产品
 中的杂质含量,理论上需控制反应Ⅱ中气体与固体反应物的物质的量之比为
中的杂质含量,理论上需控制反应Ⅱ中气体与固体反应物的物质的量之比为
您最近一年使用:0次
2021-08-25更新
|
612次组卷
|
2卷引用:湖北省公安县第三中学2020-2021学年高三上学期11月月考化学试题
14-15高三上·安徽·阶段练习
名校
解题方法
7 . 向体积均为10mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸。此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是
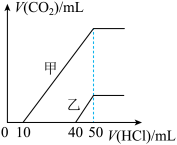

| A.乙溶液中含有的溶质是Na2CO3、NaHCO3 |
| B.当0<V(HCl)<10 mL时,甲溶液中发生反应的离子方程式为OH-+H+ =H2O |
| C.原NaOH溶液的物质的量浓度为0.5mol·L-1 |
| D.乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况) |
您最近一年使用:0次
2021-05-28更新
|
2600次组卷
|
25卷引用:2014届安徽省“江淮十校”协作体高三上学期第一次联考化学试卷
(已下线)2014届安徽省“江淮十校”协作体高三上学期第一次联考化学试卷2016届山东省威海市乳山市高三上学期期中测试化学试卷2015-2016学年辽宁沈阳市第二中学高二下期末考化学卷2017届河北省涞水县波峰中学高三8月月考化学试卷河南省豫南豫北名校2018届高三精英联赛化学试题1陕西省陕师大附中2018届高三第五次月考化学试题河南省豫南豫北名校2018届高三精英联赛化学试题2【全国百强校】天津市第一中学2019届高三上学期第一次月考化学试题【全国百强校】甘肃省天水市第一中学2019届高三上学期一轮复习第二次质量检测化学试题【全国百强校】辽宁省沈阳市东北育才学校2018-2019学年高一上学期第二次月考化学试题(已下线)2019年1月14日 《每日一题》高考二轮复习-钠及其化合物上海市十二校2015届高三12月联考化学试题天津一中2020届高三第二次月考化学试题福建省福州市第三中学2020-2021学年高三上学期第二次质量检测化学试题河北省石家庄市第二十四中学2020-2021学年高二第二学期期中考试化学试题黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)广东省广州市三校2021-202学年高一上学期期末联考化学试题(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点09 钠及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点13 钠及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省南充高级中学2021-2022学年高一下学期开学考试化学试题陕西师范大学附属中学2023-2024学年高一上学期期中考试化学试题湖北省荆州市荆州中学2023-2024学年高一上学期期末考试化学试题
名校
8 . 中国努力争取2060年前实现碳中和。利用NaOH溶液喷淋捕捉空气中的CO2,反应过程如图所示。下列说法错误的是


| A.捕捉室中NaOH溶液喷成雾状有利于吸收CO2 |
| B.环节a中物质分离的基本操作是过滤 |
| C.反应过程中CaO和NaOH是可循环的物质 |
| D.高温反应炉中的物质是Ca(HCO3)2 |
您最近一年使用:0次
2021-05-25更新
|
1630次组卷
|
7卷引用:广东省汕头市金山中学2021届高三下学期第三次模拟考试化学试题
广东省汕头市金山中学2021届高三下学期第三次模拟考试化学试题(已下线)社会热点专题之碳达峰、碳中和安徽省六安市第一中学2022届高三第二次月考化学试题(已下线)2022年新高考化学时事热点情境化考题---钠及其化合物安徽省合肥市(五中、七中、十中)2021-2022学年高三上学期联考化学试题(已下线)卷05 工艺流程型选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)考点09 钠及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
21-22高一上·浙江·阶段练习
名校
解题方法
9 . 化学膨松剂可以使食品变得松软或酥脆。某兴趣小组为测定潮湿环境中长期存放的碳酸氢钠膨松剂中 的含量,设计了以下实验,并按如图所示连接装置(气密性良好,各装置中的试剂皆为足量)。
的含量,设计了以下实验,并按如图所示连接装置(气密性良好,各装置中的试剂皆为足量)。

已知:在潮湿的环境中 会慢慢变为
会慢慢变为 。
。
(1)写出膨松剂中 受热分解的化学方程式
受热分解的化学方程式_______ ;停止加热后,应继续通入一段时间氮气的目的是_______ 。
(2)装置B、C中盛放的试剂分别为:B_______ ,C_______ 。
(3)若A装置中反应管右侧有水蒸气冷凝,则测得的 含量将
含量将_______ (填“偏高”、“偏低”或“无影响”);若撤去D装置,则测得的 含量将
含量将_______ (填“偏高”、“偏低”或“无影响”)。
(4)若膨松剂的质量为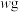 ,反应后C装置增加的质量为
,反应后C装置增加的质量为 ,则膨松剂中
,则膨松剂中 的质量分数为
的质量分数为_______ (用含w、m的代数式表示)。
(5)兴趣小组还设计了下列实验方案,其中能测定出膨松剂中 含量的是
含量的是_______ 。
A.取a克膨松剂充分加热,质量减少b克
B.取a克膨松剂与足量稀盐酸充分反应,加热、蒸干、灼烧,得到b克固体
C.取a克膨松剂与足量稀硫酸充分反应,逸出气体干燥后用碱石灰吸收,质量增加b克
D.取a克膨松剂与足量 溶液充分反应,得到b克溶液
溶液充分反应,得到b克溶液
 的含量,设计了以下实验,并按如图所示连接装置(气密性良好,各装置中的试剂皆为足量)。
的含量,设计了以下实验,并按如图所示连接装置(气密性良好,各装置中的试剂皆为足量)。
已知:在潮湿的环境中
 会慢慢变为
会慢慢变为 。
。(1)写出膨松剂中
 受热分解的化学方程式
受热分解的化学方程式(2)装置B、C中盛放的试剂分别为:B
(3)若A装置中反应管右侧有水蒸气冷凝,则测得的
 含量将
含量将 含量将
含量将(4)若膨松剂的质量为
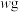 ,反应后C装置增加的质量为
,反应后C装置增加的质量为 ,则膨松剂中
,则膨松剂中 的质量分数为
的质量分数为(5)兴趣小组还设计了下列实验方案,其中能测定出膨松剂中
 含量的是
含量的是A.取a克膨松剂充分加热,质量减少b克
B.取a克膨松剂与足量稀盐酸充分反应,加热、蒸干、灼烧,得到b克固体
C.取a克膨松剂与足量稀硫酸充分反应,逸出气体干燥后用碱石灰吸收,质量增加b克
D.取a克膨松剂与足量
 溶液充分反应,得到b克溶液
溶液充分反应,得到b克溶液
您最近一年使用:0次
2021-04-12更新
|
686次组卷
|
4卷引用:【浙江新东方】在线化学55高一上
20-21高一下·江苏南通·阶段练习
10 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向 稀溶液中滴加少量澄清石灰水,产生白色沉淀 稀溶液中滴加少量澄清石灰水,产生白色沉淀 | 该沉淀是 |
| B | 将金属 投入乙醇中,钠的表面产生大量气泡 投入乙醇中,钠的表面产生大量气泡 | 乙醇中 键发生断裂 键发生断裂 |
| C | 将有机物M通入溴水,溴水褪色 | M是乙烯 |
| D | 卤代烃Y与NaOH水溶液共热后,加入足量稀硝酸,再滴入AgNO3溶液,产生白色沉淀 | Y中含有氯原子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



