名校
解题方法
1 . 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。

(1)① ~ ③所涉及的操作方法中,包含过滤的是______ (填序号)。
(2)根据图,将化学方程式补充完整:NH3+CO2+______ +______ = NaHCO3 ↓+ NH4Cl
(3)煅烧NaHCO3固体的化学方程式是______ 。
(4)下列说法中,正确的是______ (填字母)。
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH 、Cl-
、Cl-
(5)若检验溶液B中是否含有氯离子,可进行的操作方法是_____________________ 。
(6)在下列方程式上写出缺少的物质并配平方程式,用双线桥分析反应①的电子转移
①___ Na2Cr2O7 + _____ HCl — ___ NaCl + ___ CrCl3 + ___ Cl2 +______________
② ___ ClO + _____ CrO
+ _____ CrO + _______ — ___ Cl- + ___ CrO
+ _______ — ___ Cl- + ___ CrO + ___H2O
+ ___H2O___________

(1)① ~ ③所涉及的操作方法中,包含过滤的是
(2)根据图,将化学方程式补充完整:NH3+CO2+
(3)煅烧NaHCO3固体的化学方程式是
(4)下列说法中,正确的是
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH
 、Cl-
、Cl-(5)若检验溶液B中是否含有氯离子,可进行的操作方法是
(6)在下列方程式上写出缺少的物质并配平方程式,用双线桥分析反应①的电子转移
①___ Na2Cr2O7 + _____ HCl — ___ NaCl + ___ CrCl3 + ___ Cl2 +___
② ___ ClO
 + _____ CrO
+ _____ CrO + _______ — ___ Cl- + ___ CrO
+ _______ — ___ Cl- + ___ CrO + ___H2O
+ ___H2O
您最近一年使用:0次
2022-11-10更新
|
275次组卷
|
2卷引用:北京市西城外国语学校2022-2023学年高一上学期期中考试化学试题
解题方法
2 . 碳酸氢钠属于抗酸药,用于碱化尿液及酸血症,也可用于胃酸过多,在潮湿空气中缓缓分解。某化学小组用如下方法对某品牌碳酸氢钠片中的含量进行了探究(可能含有少量Na2CO3,药品中不含干扰测定的物质)。
【鉴别】
a.取铂丝,用盐酸湿润后,蘸取药品粉末,在无色火焰中燃烧,火焰显黄色。
b.向本品水溶液中加盐酸产生泡沸现象。
【检查】配置药品质量分数为0.8%的水溶液,测pH为8.3。
【含量测定】小组采用滴定法进行含量测定:
I.用已准确称量的药品固体ag配制一定体积的溶液VmL。(此时主要溶质为NaHCO3和少量Na2CO3)
II.取V1mL上述溶液于锥形瓶中,加入酚酞指示剂2—3滴。
III.用1mol/L盐酸标准溶液滴定II中溶液至第一终点时,消耗盐酸溶液V2mL。 (此时溶质为NaCl和NaHCO3)
IV.再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,又消耗盐酸溶液V3mL。
已知:H2CO3的电离平衡常数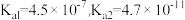 ;
;
常用的酸碱指示剂及其变色范围如下:
酚酞:pH<8.2无色、8.2<pH<10浅红色、pH>10红色
甲基橙:pH<3.1红色、3.1<pH<4.4橙色、pH>4.4黄色
(1)请写出“鉴别”中产生泡沸现象主要反应的离子反应方程式:_______ 。
(2)请结合化学用语解释“检查”中水溶液pH为8.3的主要原因(不考虑杂质影响):_______ 。
(3)“含量测定”的步骤I中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和_______ 。
(4)滴定过程中应选择如图所示滴定管_______ (填字母)。

(5)步骤V中第二步滴定用甲基橙滴定至终点的现象是由_______ 色变为橙色。
(6)药品中碳酸氢钠的质量分数为_______ 。(碳酸氢钠摩尔质量: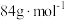 )
)
【鉴别】
a.取铂丝,用盐酸湿润后,蘸取药品粉末,在无色火焰中燃烧,火焰显黄色。
b.向本品水溶液中加盐酸产生泡沸现象。
【检查】配置药品质量分数为0.8%的水溶液,测pH为8.3。
【含量测定】小组采用滴定法进行含量测定:
I.用已准确称量的药品固体ag配制一定体积的溶液VmL。(此时主要溶质为NaHCO3和少量Na2CO3)
II.取V1mL上述溶液于锥形瓶中,加入酚酞指示剂2—3滴。
III.用1mol/L盐酸标准溶液滴定II中溶液至第一终点时,消耗盐酸溶液V2mL。 (此时溶质为NaCl和NaHCO3)
IV.再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,又消耗盐酸溶液V3mL。
已知:H2CO3的电离平衡常数
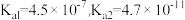 ;
;常用的酸碱指示剂及其变色范围如下:
酚酞:pH<8.2无色、8.2<pH<10浅红色、pH>10红色
甲基橙:pH<3.1红色、3.1<pH<4.4橙色、pH>4.4黄色
(1)请写出“鉴别”中产生泡沸现象主要反应的离子反应方程式:
(2)请结合化学用语解释“检查”中水溶液pH为8.3的主要原因(不考虑杂质影响):
(3)“含量测定”的步骤I中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和
(4)滴定过程中应选择如图所示滴定管

(5)步骤V中第二步滴定用甲基橙滴定至终点的现象是由
(6)药品中碳酸氢钠的质量分数为
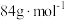 )
)
您最近一年使用:0次
名校
解题方法
3 . 取10.00 mL碳酸钠和碳酸氢钠的混合溶液,用0.1000 mol/L HCl溶液进行滴定,测得溶液的pH与加入盐酸的体积变化关系如图(假设过程中没有 逸出),则下列说法正确的是
逸出),则下列说法正确的是

 逸出),则下列说法正确的是
逸出),则下列说法正确的是
| A.原溶液可由碳酸钠、碳酸氢钠两种固体按53∶28(质量比)混合溶于适量水配制 |
B.c点时,溶液中 |
C.a~d点, |
| D.选用甲基橙作该实验的指示剂,终点时溶液由红色变成橙色,且半分钟内不复原 |
您最近一年使用:0次
名校
解题方法
4 . 现有NaHCO3和Na2CO3的混合物,为了测定二者的质量,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量 )。
已知:CaCl2是一种优良的吸水剂,不与CO2反应;碱石灰是NaOH固体和CaO固体的混合物,碱石灰既可以吸水又可以与CO2反应。
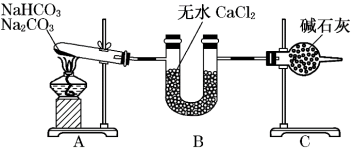
(1)B装置的作用是____ 。
(2)C装置的作用是____ 。
(3)若在装置A的试管中装入NaHCO3和Na2CO3的混合物3.80g,用酒精灯加热到反应完全,此时U型管B增重0.18g,干燥管C增重mg,则原固体混合物中Na2CO3的质量为____ g。
(4)A装置中发生反应的化学方程式为:____ 。
(5)请通过计算,判断m的取值范围____ 。
已知:CaCl2是一种优良的吸水剂,不与CO2反应;碱石灰是NaOH固体和CaO固体的混合物,碱石灰既可以吸水又可以与CO2反应。

(1)B装置的作用是
(2)C装置的作用是
(3)若在装置A的试管中装入NaHCO3和Na2CO3的混合物3.80g,用酒精灯加热到反应完全,此时U型管B增重0.18g,干燥管C增重mg,则原固体混合物中Na2CO3的质量为
(4)A装置中发生反应的化学方程式为:
(5)请通过计算,判断m的取值范围
您最近一年使用:0次
名校
解题方法
5 . 已知:2Na[Al(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O。向含2molNaOH,1molBa(OH)2,2molNa[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量关系正确的是
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 2 | 3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-22更新
|
469次组卷
|
2卷引用:浙江省温州市苍南县2022年第十六届“求知杯”高一化学竞赛试题
12-13高一上·黑龙江大庆·期末
名校
解题方法
6 . 将2molNaHCO3和一定量(不为0)的Na2O2固体混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,则反应后固体的物质的量n(mol)的取值范围是
| A.n=1 | B.1<n<2 | C.2≤n<4 | D.n≥4 |
您最近一年使用:0次
2022-09-22更新
|
1081次组卷
|
6卷引用:2011—2012学年度黑龙江大庆实验中学高一上学期期末考试化学试卷
解题方法
7 . 向500mL 和NaOH的混合溶液中持续通入
和NaOH的混合溶液中持续通入 。通入
。通入 的体积和溶液中沉淀的关系如图所示(气体体积均已换算为标准状况下的体积,忽略
的体积和溶液中沉淀的关系如图所示(气体体积均已换算为标准状况下的体积,忽略 与水的反应和溶液体积变化等)。请回答:
与水的反应和溶液体积变化等)。请回答:

(1)混合溶液中 的物质的量浓度为
的物质的量浓度为_______ mol/L。
(2)当通入的 总体积为2240mL时,溶液中
总体积为2240mL时,溶液中 与
与 的物质的量之比为
的物质的量之比为_______ 。
 和NaOH的混合溶液中持续通入
和NaOH的混合溶液中持续通入 。通入
。通入 的体积和溶液中沉淀的关系如图所示(气体体积均已换算为标准状况下的体积,忽略
的体积和溶液中沉淀的关系如图所示(气体体积均已换算为标准状况下的体积,忽略 与水的反应和溶液体积变化等)。请回答:
与水的反应和溶液体积变化等)。请回答:
(1)混合溶液中
 的物质的量浓度为
的物质的量浓度为(2)当通入的
 总体积为2240mL时,溶液中
总体积为2240mL时,溶液中 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
8 . I.A、B、C、D四种均为含有钠元素的化合物,A、B、C与盐酸反应均可生成D;加热固体C可生成A和一种无色无味的气体X;在A溶液中通入足量X,又可生成C;B溶液和C溶液混合可生成A,请回答:
(1)A是_______ ,B是_______ ,C_______ ,D是_______ ,(均用化学式表示)
Ⅱ.化合物甲仅含两种元素。B 为黄绿色气体,气体D能使湿润的红色石蕊试纸变蓝色,且标况下的密度为0.76 g/L。在一定条件下有如下转化关系:
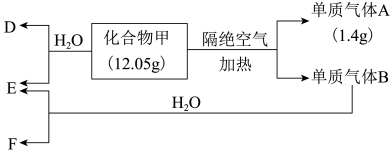
请回答
(2)化合物甲所含元素为_______ (请填写元素符号),甲的化学式为_______ 。
(3)写出E转化为F的离子方程式_______ 。
(4)甲与水反应的化学方程式为_______ 。
(1)A是
Ⅱ.化合物甲仅含两种元素。B 为黄绿色气体,气体D能使湿润的红色石蕊试纸变蓝色,且标况下的密度为0.76 g/L。在一定条件下有如下转化关系:

请回答
(2)化合物甲所含元素为
(3)写出E转化为F的离子方程式
(4)甲与水反应的化学方程式为
您最近一年使用:0次
解题方法
9 . 镁条投入盐酸时,快速溶解并产生大量气泡;投入热水时,其表面会附着微量气泡。受此启发,某兴趣小组对Mg与NaHCO3溶液的反应进行了如下探究:
I.探究反应产生的气体成分。
(1)经检验反应产生的气体有H2,实验室检验H2的方法为_______ 。
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
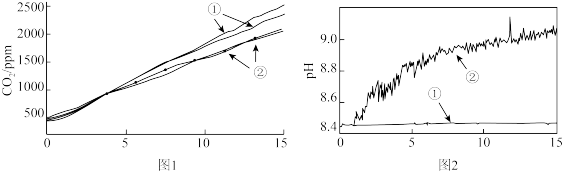
图1中曲线②对应的CO2含量逐渐增大的原因为_______ (用化学方程式表示);结合实验3解释,随着时间推移,图1中曲线②的数值低于曲线①的原因为_______ 。
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:
(3)结合实验1和4,可知溶液中的HCO 加快了反应的发生。
加快了反应的发生。
①实验4中横线处内容为_______ 。
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO 能加快该反应的原因为
能加快该反应的原因为_______ 。
III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为_______ (填字母编号)。

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=_______ 。
| 实验序号 | 实验操作 | 实验现象 |
| 1 | 向7.5 mL1mol·L-1NaHCO3溶液中加入长3cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
(1)经检验反应产生的气体有H2,实验室检验H2的方法为
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
| 实验序号 | 实验操作 |
| 2 | 分别称取两份6.0 mL 1 mol·L-1NaHCO3溶液于两个相同塑料瓶中(其中一个加入0.1g镁条),塞紧CO2气体传感器,采集数据,各重复实验1次,得到图1所示曲线 |
| 3 | 分别称取两份30.0 mL 1 mol·L-1NaHCO3溶液于两个相同烧杯中(其中一个加入1.1g镁条),插入pH传感器,搅拌并采集数据,得到图2所示曲线 |

图1中曲线②对应的CO2含量逐渐增大的原因为
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO
 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:| 实验序号 | 实验操作 | 实验现象 |
| 4 | 向_______溶液中加入长3 cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
 加快了反应的发生。
加快了反应的发生。①实验4中横线处内容为
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO
 能加快该反应的原因为
能加快该反应的原因为III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=
您最近一年使用:0次
2022-04-09更新
|
1137次组卷
|
7卷引用:河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题
河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)(已下线)化学-2022年高考押题预测卷01(福建卷)(已下线)化学-2022年高考押题预测卷03(山东卷)(已下线)押江苏卷第17题 化学实验综合题 -备战2022年高考化学临考题号押题(江苏卷)(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(实验探究题)
名校
解题方法
10 . 铁红(Fe2O3)常用于油漆、油墨及橡胶工业,常用FeCO3焙烧生成铁红。研究小组采用如下装置制取FeCO3(C后及夹持装置略),操作的关键是向Na2CO3溶液中通入一段时间CO2至溶液呈中性,再滴加一定量FeCl2溶液,产生白色沉淀。
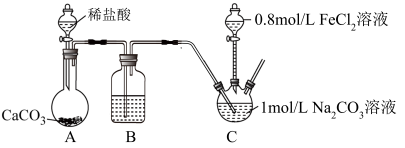
(1)A中反应的离子方程式_______ ;
(2)B中所用试剂为_______ ;
a.饱和食盐水b.浓硫酸c.饱和碳酸钠d.饱和碳酸氢钠e.氢氧化钠溶液
(3)先向1mol/LNa2CO3溶液中通入CO2的目的是_______ ;
(4)C装置中生成FeCO3的离子方程式为______ ;
(5)实验结束后,检验C中的溶液是否还存在亚铁离子,不能用酸性高锰酸钾溶液的原因是:________ 。

(1)A中反应的离子方程式
(2)B中所用试剂为
a.饱和食盐水b.浓硫酸c.饱和碳酸钠d.饱和碳酸氢钠e.氢氧化钠溶液
(3)先向1mol/LNa2CO3溶液中通入CO2的目的是
(4)C装置中生成FeCO3的离子方程式为
(5)实验结束后,检验C中的溶液是否还存在亚铁离子,不能用酸性高锰酸钾溶液的原因是:
您最近一年使用:0次



