20-21高三下·江苏苏州·开学考试
名校
1 . 侯氏制碱法原理为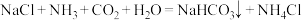 。下列有关模拟侯氏制碱法的实验原理和装置能达到实验目的的是
。下列有关模拟侯氏制碱法的实验原理和装置能达到实验目的的是
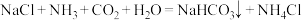 。下列有关模拟侯氏制碱法的实验原理和装置能达到实验目的的是
。下列有关模拟侯氏制碱法的实验原理和装置能达到实验目的的是A.制取氨气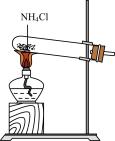 | B.制NaHCO3 |
C.分离NaHCO3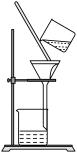 | D.制Na2CO3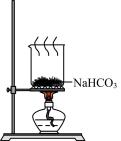 |
您最近一年使用:0次
2023-06-27更新
|
822次组卷
|
27卷引用:化学-2023年高考押题预测卷03(上海卷)(含考试版、全解全析、参考答案、答题卡)
(已下线)化学-2023年高考押题预测卷03(上海卷)(含考试版、全解全析、参考答案、答题卡)江苏省苏州市2022届高考考前模拟化学试卷题浙江省绍兴市第一中学2023-2024学年高三首考模拟考试化学试题江苏苏州市2021届高三下学期期初学业质量阳光指标调研化学试题江苏省苏州市2021届高三月考化学试卷江苏省连云港市赣榆智贤中学2020-2021学年高二3月月考化学试题江苏省邗江中学2020-2021学年高二(2019级新疆班)下学期期中化学试题广东省广州市真光中学2020-2021学年高一下学期3月月考化学试题(已下线)【镇江新东方】高二下期中21高二期中校级联考湖南省株洲市第二中学2021-2022学年高二下学期期末考试化学试题(已下线)第06讲 钠及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)江苏省苏州市2021-2022学年高一下学期期末学业质量阳光指标调研(延期到8月)化学试题江苏省盐城市三校2022-2023学年高三上学期第一次联考化学试题广东省汕尾市龙山中学 2021-2022学年高一下学期第一次月考化学试题河南省南阳市第一中学校2023届高三上学期第二次阶段考试化学试题(已下线)易错点05 钠及其化合物-备战2023年高考化学考试易错题山东省淄博实验中学2022-2023学年高一下学期3月月考化学试题江苏省南通市通州区2022-2023学年高一下学期第一次月考化学试题(已下线)【2023】【高一下】【其他】【余高1】【高中化学】【刘尼尼收集】江苏省宿迁地区2022-2023学年高一下学期期中考试化学试题江苏省苏州市2022-2023学年高一下学期期末应考化学试题(已下线)第二章 单元测试卷重庆市西南大学附属中学校2022-2023学年高三上学期11月期中考试化学试题江苏省泗阳县实验高级中学2023-2024学年高一上学期第二次调研测试化学试卷17 2024年苏州昆山周市高级中学高一3月月考新疆阿克苏市第四高级中学2023-2024学年高三上学期第二次月考化学试卷(已下线)压轴题03 物质的制备检验分离与提纯(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
2023·上海·模拟预测
2 . 为探究 与一元酸HA(
与一元酸HA( mol·L
mol·L )的化学反应热效应,进行了如下四组实验。已知
)的化学反应热效应,进行了如下四组实验。已知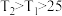 ℃。
℃。
下列说法错误的是
 与一元酸HA(
与一元酸HA( mol·L
mol·L )的化学反应热效应,进行了如下四组实验。已知
)的化学反应热效应,进行了如下四组实验。已知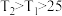 ℃。
℃。| 实验序号 | 试剂I | 试剂Ⅱ | 反应前温度 | 反应后温度 |
| ① | 40 mL  | 2.12 g  | 25℃ |  |
| ② | 20 mL HCl+20 mL  | 2.12 g  | 25℃ |  |
| ③ | 20 mL  +20 mL +20 mL  | 2.12 g  | 25℃ |  |
| ④ | 20 mL HCl | 2.12 g  与20 mL 与20 mL  形成的溶液 形成的溶液 | 25℃ |  |
A. 溶于水放热 溶于水放热 | B. 与HCl反应放热 与HCl反应放热 |
C.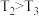 | D.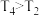 |
您最近一年使用:0次
解题方法
3 . 室温下,等体积 的
的 溶液和
溶液和 溶液,下列叙述正确的是
溶液,下列叙述正确的是
 的
的 溶液和
溶液和 溶液,下列叙述正确的是
溶液,下列叙述正确的是| A.钠离子浓度相同 | B.滴入几滴稀盐酸,均无明显现象 |
C.水电离的 总浓度均为 总浓度均为 | D.滴入少量 溶液,均得到沉淀 溶液,均得到沉淀 |
您最近一年使用:0次
解题方法
4 . Ⅰ.纯碱( )和小苏打(
)和小苏打( )都是白色晶体,在日常生活中都可以找到。
)都是白色晶体,在日常生活中都可以找到。
(1)若要在家中将它们区分开来,下列方法中可行的是___________ 。
a.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度
b.分别用干净铁丝蘸取样品在煤气灶的火焰上灼烧,观察火焰颜色
c.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
d.分别放在炒锅中加热,观察是否有残留物
(2) 溶液和
溶液和 溶液中都含有
溶液中都含有 、
、 、
、 、
、 、
、 、
、 、
、 ,写出一个用浓度表示这些微粒之间的电荷守恒的关系式。
,写出一个用浓度表示这些微粒之间的电荷守恒的关系式。___________
Ⅱ.某同学在两个相同的特制容器中分别加入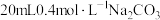 溶液和
溶液和 溶液,再分别用
溶液,再分别用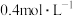 盐酸滴定,利用pH计和压力传感器检测,得到如下曲线:
盐酸滴定,利用pH计和压力传感器检测,得到如下曲线:

(3)甲、乙两条线中表示向 溶液中滴加盐酸的是
溶液中滴加盐酸的是___________ ,理由是___________ 。丙、丁两条线中表示向 溶液中滴加盐酸的是
溶液中滴加盐酸的是___________ ,理由是___________ 。
(4)当滴加盐酸的体积为 时(a点、b点),所发生的反应用化学方程式表示为
时(a点、b点),所发生的反应用化学方程式表示为___________ 。根据 图分析,滴定时c点可用
图分析,滴定时c点可用___________ 、d点可用___________ 作指示剂指示滴定终点(选填“甲基橙”“石蕊”或“酚酞”)。
(5)NaClO也是生活中常见的钠的化合物。废水脱氮工艺中有一种方法是在废水中加入过量NaClO使 完全转化为
完全转化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
 )和小苏打(
)和小苏打( )都是白色晶体,在日常生活中都可以找到。
)都是白色晶体,在日常生活中都可以找到。(1)若要在家中将它们区分开来,下列方法中可行的是
a.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度
b.分别用干净铁丝蘸取样品在煤气灶的火焰上灼烧,观察火焰颜色
c.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
d.分别放在炒锅中加热,观察是否有残留物
(2)
 溶液和
溶液和 溶液中都含有
溶液中都含有 、
、 、
、 、
、 、
、 、
、 、
、 ,写出一个用浓度表示这些微粒之间的电荷守恒的关系式。
,写出一个用浓度表示这些微粒之间的电荷守恒的关系式。Ⅱ.某同学在两个相同的特制容器中分别加入
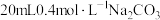 溶液和
溶液和 溶液,再分别用
溶液,再分别用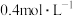 盐酸滴定,利用pH计和压力传感器检测,得到如下曲线:
盐酸滴定,利用pH计和压力传感器检测,得到如下曲线:
(3)甲、乙两条线中表示向
 溶液中滴加盐酸的是
溶液中滴加盐酸的是 溶液中滴加盐酸的是
溶液中滴加盐酸的是(4)当滴加盐酸的体积为
 时(a点、b点),所发生的反应用化学方程式表示为
时(a点、b点),所发生的反应用化学方程式表示为 图分析,滴定时c点可用
图分析,滴定时c点可用(5)NaClO也是生活中常见的钠的化合物。废水脱氮工艺中有一种方法是在废水中加入过量NaClO使
 完全转化为
完全转化为 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
5 . 下列有关物质性质的比较,结论正确的是
| A.溶解度:Na2CO3<NaHCO3 | B.热稳定性:HCl<PH3 |
| C.沸点:C2H6<C4H10 | D.碱性:LiOH<Be(OH)2 |
您最近一年使用:0次
名校
解题方法
6 . 在生活中 Na2CO3和NaHCO3都可作食用碱。下列对其性质的描述用化学方程式或离子方程式表示正确的是
A.NaHCO3可作发酵粉:2NaHCO3 Na2CO3 + CO2↑ + H2O Na2CO3 + CO2↑ + H2O |
B.饱和Na2CO3溶液中通入足量CO2: +CO2+ H2O=2 +CO2+ H2O=2 |
C.Na2CO3溶液呈碱性: + 2H2O⇌H2CO3+ 2OH- + 2H2O⇌H2CO3+ 2OH- |
D.饱和Na2CO3溶液除去CH3COOC2H5中的CH3COOH: +2H+ =CO2↑+ H2O +2H+ =CO2↑+ H2O |
您最近一年使用:0次
2022-07-21更新
|
107次组卷
|
3卷引用:上海市奉贤区2020届高三5月教学质量调研(二模)化学试题
上海市奉贤区2020届高三5月教学质量调研(二模)化学试题(已下线)第07讲 钠及其重要化合物(精练)-2022年高考化学一轮复习讲练测黑龙江省哈尔滨工业大学附属中学2021-2022学年高二下学期期末考试化学试题
解题方法
7 . Na、K属于碱金属元素,其形成的物质在生活生产中有广泛应用。NaCl不仅可以作调味剂,在工业生产中也占据着重要地位。
(1)写出Na+电子式____ ,比较Na+和Cl-的半径大小____ ,NaCl属于___ 晶体。
(2)NaCl是氯碱工业的原料,此工业可以制取的产品有____ (至少写出2种)。
(3)KIO3常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为:______I2+______KClO3+______→______KH(IO3)2+5KCl+3Cl2↑。配平该反应的化学方程式____ 。反应中生成的Cl2可用____ 吸收制备漂粉精。
NaHCO3俗称小苏打,可用于治疗胃酸过多。
(4)有实验小组利用pH传感器探究Na2CO3和NaHCO3的性质,实验过程如表所示。
写出Na2CO3与澄清石灰水反应的离子方程式___ ,OH-未参与该反应的实验证据是____ 。
(5)结合离子方程式说明NaHCO3可用于治疗胃酸过多的原因____ 。胃酸过多易引起胃溃疡,小苏打可用于治疗胃溃疡,如果处于胃溃疡的活动期,医生不建议服用小苏打,请猜测医生不建议的原因____ 。
(1)写出Na+电子式
(2)NaCl是氯碱工业的原料,此工业可以制取的产品有
(3)KIO3常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为:______I2+______KClO3+______→______KH(IO3)2+5KCl+3Cl2↑。配平该反应的化学方程式
NaHCO3俗称小苏打,可用于治疗胃酸过多。
(4)有实验小组利用pH传感器探究Na2CO3和NaHCO3的性质,实验过程如表所示。
| 实验操作 | 实验数据 |
 |  |
写出Na2CO3与澄清石灰水反应的离子方程式
(5)结合离子方程式说明NaHCO3可用于治疗胃酸过多的原因
您最近一年使用:0次
解题方法
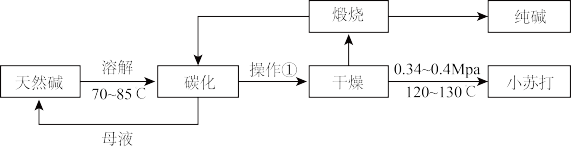
8 . Na2CO3和NaHCO3是重要的无机化工产品,广泛应用于食品、化工、医药等领域。如图是利用天然碱(主要成分为Na2CO3、NaHCO3和少量NaCl)制备Na2CO3和NaHCO3的工艺流程。
完成下列填空:
(1)操作①为___ 。
(2)碳化装置中反应的离子方程式___ 。
(3)解释选择0.34~0.4MPa干燥的原因___ 。
(4)对比索尔维制碱法,说明利用天然碱制碱的优势___ 。
(5)为了测定产品中小苏打中NaHCO3的含量进行以下实验。
实验步骤:
步骤一:称2.000g小苏打样品,配制小苏打溶液250mL。
步骤二:取20.00mL小苏打溶液置于锥形瓶中,用0.1000mol·L-1盐酸滴定,溶液pH随盐酸体积变化如图所示。

完成下列填空:
①取20.00mL小苏打溶液需要使用的定量仪器名称____ 。
②根据滴定曲线分析,若采用传统滴定法,应选择的指示剂是___ ,此时滴定终点的现象为___ 。
③计算该样品中NaHCO3的质量分数为____ 。

完成下列填空:
(1)操作①为
(2)碳化装置中反应的离子方程式
(3)解释选择0.34~0.4MPa干燥的原因
(4)对比索尔维制碱法,说明利用天然碱制碱的优势
(5)为了测定产品中小苏打中NaHCO3的含量进行以下实验。
实验步骤:
步骤一:称2.000g小苏打样品,配制小苏打溶液250mL。
步骤二:取20.00mL小苏打溶液置于锥形瓶中,用0.1000mol·L-1盐酸滴定,溶液pH随盐酸体积变化如图所示。

完成下列填空:
①取20.00mL小苏打溶液需要使用的定量仪器名称
②根据滴定曲线分析,若采用传统滴定法,应选择的指示剂是
③计算该样品中NaHCO3的质量分数为
您最近一年使用:0次
名校
9 . 侯氏制碱法为我国纯碱工业做出了重要贡献。
Ⅰ.某化学兴趣小组模拟侯氏制碱法制备NaHCO3,进一步处理得到Na2CO3和NH4Cl,实验流程如图:
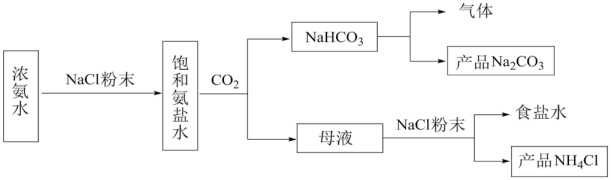
回答下列问题:
(1)生成NaHCO3的总反应的化学方程式为_______ 。
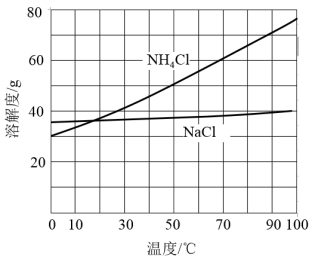
(2)向母液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为_______ 、_______ 、_______ 、洗涤、干燥。
II.实验中制得的纯碱中含有少量NaCl,该小组设计如图所示装置,测定实验得到的纯碱中Na2CO3的含量。

(3)装置A中的试剂为_______ ,装置C中的试剂为_______ 。
(4)实验结束后通入空气的目的:_______ 。
(5)实验前称取26.50g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为_______ (保留2位小数)。按照以上装置及操作,有同学提出测定结果可能会偏大,他的理由是_______ 。
Ⅰ.某化学兴趣小组模拟侯氏制碱法制备NaHCO3,进一步处理得到Na2CO3和NH4Cl,实验流程如图:

回答下列问题:
(1)生成NaHCO3的总反应的化学方程式为
(2)向母液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为

II.实验中制得的纯碱中含有少量NaCl,该小组设计如图所示装置,测定实验得到的纯碱中Na2CO3的含量。

(3)装置A中的试剂为
(4)实验结束后通入空气的目的:
(5)实验前称取26.50g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为
您最近一年使用:0次
2021-12-23更新
|
466次组卷
|
2卷引用:上海市奉贤区2022届高三一模化学试题
21-22高三上·上海黄浦·期中
名校
解题方法
10 . 以下实验设计能达到实验目的的是
| 实验目的 | 实验设计 |
| A.除去NaHCO3固体中的Na2CO3 | 将固体加热至恒重 |
| B.制备无水AlCl3 | 蒸发Al与稀盐酸反应后的溶液 |
| C.分离乙醇(沸点78.3℃)苯(沸点80.1℃)的混合物 | 将混合物进行蒸馏 |
| D.鉴别NaBr和KI溶液 | 分别加新制氯水后,用CCl4萃取 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



