名校
1 . 一种可充电锌—空气电池放电时的工作原理如下图所示。已知:Ⅰ室溶液中,锌主要以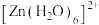 的形式存在,并存在电离平衡
的形式存在,并存在电离平衡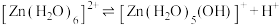 。下列说法错误的是
。下列说法错误的是
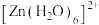 的形式存在,并存在电离平衡
的形式存在,并存在电离平衡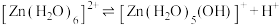 。下列说法错误的是
。下列说法错误的是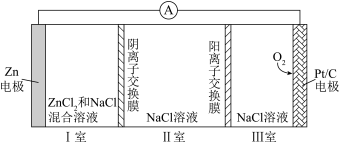
A.放电时,Ⅰ室溶液中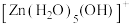 浓度增大 浓度增大 |
B.放电时,Ⅱ室中的 通过阴离子交换膜进入Ⅰ室 通过阴离子交换膜进入Ⅰ室 |
C.充电时, 电极的电极反应为 电极的电极反应为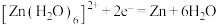 |
D.充电时,每生成 ,Ⅲ室溶液质量理论上减少 ,Ⅲ室溶液质量理论上减少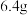 |
您最近一年使用:0次
2023-10-29更新
|
1903次组卷
|
7卷引用:海南省海口市海南中学2023-2024学年高二下学期4月期中考试化学试题
海南省海口市海南中学2023-2024学年高二下学期4月期中考试化学试题广西北海市2024届高三一模考试化学试题新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高三上学期12月月考化学试卷(已下线)热点14 电化学及其应用(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)山东省济宁市微山县第二中学2023-2024学年高三上学期第三次月考化学试题2024届广西2024年“贵百河”高三下学期4月新高考模拟二模化学试题
2 . 水煤合成气的生产和应用在化学工业中有极为重要的地位。回答下列问题:
(1)利用合成气(主要成分CO、CO2和H2)在催化剂作用下合成甲醇,可能发生的反应有:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-63 kJ•mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
③CH3OH(g)=CO(g)+2H2(g) ΔH3
已知部分化学键键能数据如下表:
则ΔH3=_______ kJ•mol-1。
(2)CO2和CH4在一定条件下反应也可制得合成水煤气。在1.0 L密闭容器中充入1.0 mol CH4和1.0 mol CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2,测得CH4的平衡转化率与温度及压强的关系如下图所示。
2CO(g)+2H2,测得CH4的平衡转化率与温度及压强的关系如下图所示。
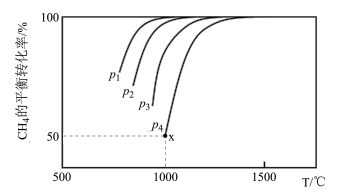
①比较压强大小:p1_______ p3(选填“>”、“<”或“=”)。
②若要提高CH4的平衡转化率,可采取的措施有_______ ,_______ 。(任写两条)
③若p4=2.0 MPa,则x点的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)化学家利用电化学原理回收CO2达到节能减排的目的,有一种实验设计的装置如下图所示。
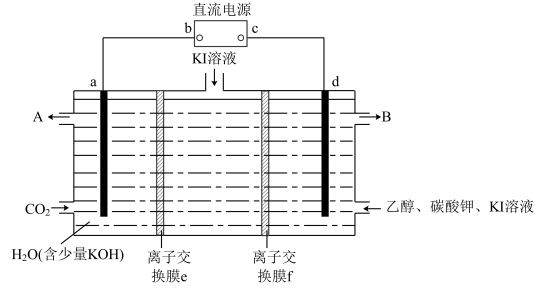
已知在碱性条件下,卤素单质可以将乙醇氧化为乙醛。实验一段时间后,测得a电极周围有甲酸根离子HCOO-生成。回答:
①电极b为_______ 极;
②电解时a电极附近溶液的pH_______ (选填“降低”、“升高”、“不变”);
③e为_______ 交换膜;
④d电极周围除了发生电极反应外,还有_______ (用离子方程式表示)。
(1)利用合成气(主要成分CO、CO2和H2)在催化剂作用下合成甲醇,可能发生的反应有:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-63 kJ•mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
③CH3OH(g)=CO(g)+2H2(g) ΔH3
已知部分化学键键能数据如下表:
| 化学键 | H-H | C=O | C≡O | O-H |
| 键能(kJ•mol-1) | 436 | 803 | 1076 | 465 |
(2)CO2和CH4在一定条件下反应也可制得合成水煤气。在1.0 L密闭容器中充入1.0 mol CH4和1.0 mol CO2,在一定条件下发生反应CH4(g)+CO2(g)
 2CO(g)+2H2,测得CH4的平衡转化率与温度及压强的关系如下图所示。
2CO(g)+2H2,测得CH4的平衡转化率与温度及压强的关系如下图所示。
①比较压强大小:p1
②若要提高CH4的平衡转化率,可采取的措施有
③若p4=2.0 MPa,则x点的平衡常数Kp=
(3)化学家利用电化学原理回收CO2达到节能减排的目的,有一种实验设计的装置如下图所示。

已知在碱性条件下,卤素单质可以将乙醇氧化为乙醛。实验一段时间后,测得a电极周围有甲酸根离子HCOO-生成。回答:
①电极b为
②电解时a电极附近溶液的pH
③e为
④d电极周围除了发生电极反应外,还有
您最近一年使用:0次
2022-11-05更新
|
141次组卷
|
2卷引用:海南省海口中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
3 . 下列关于各图象的解释或结论正确的是


A.由甲可知:热化学方程式是H2(g)+ O2(g)=H2O(g) ΔH=-241.8kJ/mol O2(g)=H2O(g) ΔH=-241.8kJ/mol |
B.由乙可知:对于恒温恒容条件下的反应2NO2(g) N2O4(g),A点为平衡状态 N2O4(g),A点为平衡状态 |
| C.由丙可知:相同pH的盐酸和醋酸溶液分别加水稀释,b点溶液的导电性比c点溶液的导电性强 |
| D.由丁可知:同温度、同物质的量浓度的HA溶液与HB溶液相比,其pH前者小于后者 |
您最近一年使用:0次
2020-01-17更新
|
633次组卷
|
2卷引用:海南省海南中学2019-2020学年高二上学期期末考试化学试题
名校
4 . 在密闭容器中将2 mol NaHCO3(s)和一定量Na2O2混合,在加热条件下让其充分反应,150 ℃下所得气体仅含两种组分,反应后固体的物质的量(n)的取值范围是
| A.n≥1 | B.1<n<2 | C.2≤n<4 | D.n≥4 |
您最近一年使用:0次
2018-09-04更新
|
360次组卷
|
4卷引用:海南省海口市华侨中学2019-2020学年高一(上)期末化学必修一期末复习试卷
海南省海口市华侨中学2019-2020学年高一(上)期末化学必修一期末复习试卷【全国百强校】黑龙江省哈尔滨师范大学附属中学2019届高三上学期开学考试化学试题(已下线)2019年7月3日 《每日一题》2020年高考一轮复习-以物质的量为中心的化学计算安徽省六安市舒城育才学校2020-2021学年高二上学期期末考试化学试题
名校
解题方法
5 . 碳及其化合物与人类的生活、生产紧密联系。
(1)已知2g甲烷完全燃烧生成稳定的氧化物时放出Q kJ的热量,写出表示甲烷燃烧热的热化学方程式:___________
(2)已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+130 kJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1。断开1 mol H—H键、O===O键分别需要吸收436 kJ、496 kJ的热量,则断开1 mol O—H键需要吸收的热量为___________
A.332 kJ B.462 kJ C.118 kJ D.360 kJ
(3)以CO2和H2O为原料制备HCOOH和O2的原电池原理如图.

电极a为_____ (填“正”或“负”)极,电极b发生的电极反应式是:___________________ .
(1)已知2g甲烷完全燃烧生成稳定的氧化物时放出Q kJ的热量,写出表示甲烷燃烧热的热化学方程式:
(2)已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+130 kJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1。断开1 mol H—H键、O===O键分别需要吸收436 kJ、496 kJ的热量,则断开1 mol O—H键需要吸收的热量为
A.332 kJ B.462 kJ C.118 kJ D.360 kJ
(3)以CO2和H2O为原料制备HCOOH和O2的原电池原理如图.

电极a为
您最近一年使用:0次
名校
解题方法
6 . 臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是____ 和____ (填分子式)。
(2)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=_______________ kJ·mol–1
(3)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
①pH增大能加速O3分解,表明对O3分解起催化作用的微粒是____ 。
②在30 ℃、pH=4.0条件下,O3的分解速率为_____ mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为_____ (填字母)。
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0
(4)O3可由臭氧发生器(原理如图)电解稀硫酸制得。

①图中阴极为____ (填“A”或“B”),其电极反应式为_________________________ 。
②若C处通入O2,则A极的电极反应式为_________ ,右室pH变化___________ (填升高、降低、不变)
(1)O3与KI溶液反应生成的两种单质是
(2)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=
(3)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
| pH t /min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的微粒是
②在30 ℃、pH=4.0条件下,O3的分解速率为
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0
(4)O3可由臭氧发生器(原理如图)电解稀硫酸制得。

①图中阴极为
②若C处通入O2,则A极的电极反应式为
您最近一年使用:0次



