名校
解题方法
1 . 将CO或 转化为高附加值化学品是颇具前景的合成路线。
转化为高附加值化学品是颇具前景的合成路线。
(1)相比于煤和石油,天然气作为燃料的主要优点有_______ 。
(2)煤的气化可将煤转化为可燃性气体,写出生成水煤气的化学方程式_______ 。
(3)钴系催化剂催化下CO加氢反应的一种路径如下图所示(*表示微粒吸附在催化剂表面的形态): 和
和 反应生成
反应生成 反应的重要中间体有
反应的重要中间体有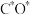 、
、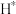 、
、_______ 、 和
和_______ 。
(4) 与二甲醚可发生反应:
与二甲醚可发生反应:
 。反应中二甲醚的平衡转化率与温度和压强的关系见下图:
。反应中二甲醚的平衡转化率与温度和压强的关系见下图:
_______ 0(填“大于”“小于”或“等于”)0,a、b、c的大小关系为_______ 。
②TK下,向恒压密闭容器中充入CO和 ,反应前
,反应前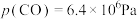 ,
,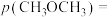
 ;充分反应达到平衡后CO的转化率为25%,则TK下该反应的平衡常数
;充分反应达到平衡后CO的转化率为25%,则TK下该反应的平衡常数
_______ 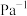 。
。
(5)以 为原料,电解法制取乙烯、乙烷的装置如图,生成乙烷的电极反应式为:
为原料,电解法制取乙烯、乙烷的装置如图,生成乙烷的电极反应式为:_______ ,当左侧有8.96L(标准状况) 反应时,a极区产品中乙烯的体积分数为50%,此时左右两侧溶液质量变化差
反应时,a极区产品中乙烯的体积分数为50%,此时左右两侧溶液质量变化差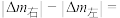
_______ g。
 转化为高附加值化学品是颇具前景的合成路线。
转化为高附加值化学品是颇具前景的合成路线。(1)相比于煤和石油,天然气作为燃料的主要优点有
(2)煤的气化可将煤转化为可燃性气体,写出生成水煤气的化学方程式
(3)钴系催化剂催化下CO加氢反应的一种路径如下图所示(*表示微粒吸附在催化剂表面的形态):
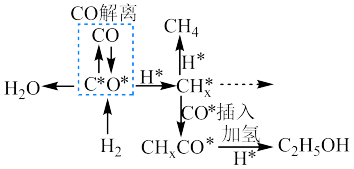
 和
和 反应生成
反应生成 反应的重要中间体有
反应的重要中间体有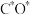 、
、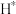 、
、 和
和(4)
 与二甲醚可发生反应:
与二甲醚可发生反应:
 。反应中二甲醚的平衡转化率与温度和压强的关系见下图:
。反应中二甲醚的平衡转化率与温度和压强的关系见下图:

②TK下,向恒压密闭容器中充入CO和
 ,反应前
,反应前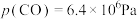 ,
,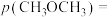
 ;充分反应达到平衡后CO的转化率为25%,则TK下该反应的平衡常数
;充分反应达到平衡后CO的转化率为25%,则TK下该反应的平衡常数
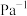 。
。(5)以
 为原料,电解法制取乙烯、乙烷的装置如图,生成乙烷的电极反应式为:
为原料,电解法制取乙烯、乙烷的装置如图,生成乙烷的电极反应式为: 反应时,a极区产品中乙烯的体积分数为50%,此时左右两侧溶液质量变化差
反应时,a极区产品中乙烯的体积分数为50%,此时左右两侧溶液质量变化差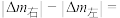
您最近一年使用:0次
2 . 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
I.制取氢气
(1)甲醇和水蒸气制取氢气的过程中有下列反应:
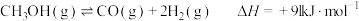
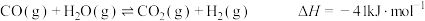
写出以甲醇为原料制取氢气的热化学方程式______ 。
(2)理论上,能提高 平衡产率的措施有
平衡产率的措施有______ (写出一条即可)。
II.储存氢气
硼氢化钠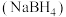 是研究最广泛的储氢材料之一。
是研究最广泛的储氢材料之一。
已知:i. 的电负性为2.0
的电负性为2.0  的电负性为2.1
的电负性为2.1
ii. 下
下 在水中的溶解度为
在水中的溶解度为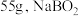 在水中的溶解度为
在水中的溶解度为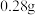
(3)向 水溶液中加入催化剂
水溶液中加入催化剂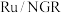 后,能够迅速反应,生成偏硼酸钠
后,能够迅速反应,生成偏硼酸钠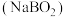 和氢气。写出该反应的化学方程式
和氢气。写出该反应的化学方程式______ 。
(4)在研究浓度对催化剂Ru/NGR活性的影响时,发现B点后(见下图)增加 的浓度,制氢速率反而下降,推断可能的原因是
的浓度,制氢速率反而下降,推断可能的原因是______ 。 溶液可制得
溶液可制得 ,实现物质的循环使用,制备装置如图所示。
,实现物质的循环使用,制备装置如图所示。______
②电解过程中,阴极区溶液
______ (填“增大”“减小”或“不变”)
I.制取氢气
(1)甲醇和水蒸气制取氢气的过程中有下列反应:
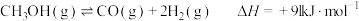
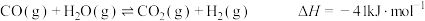
写出以甲醇为原料制取氢气的热化学方程式
(2)理论上,能提高
 平衡产率的措施有
平衡产率的措施有II.储存氢气
硼氢化钠
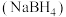 是研究最广泛的储氢材料之一。
是研究最广泛的储氢材料之一。已知:i.
 的电负性为2.0
的电负性为2.0  的电负性为2.1
的电负性为2.1ii.
 下
下 在水中的溶解度为
在水中的溶解度为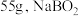 在水中的溶解度为
在水中的溶解度为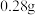
(3)向
 水溶液中加入催化剂
水溶液中加入催化剂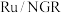 后,能够迅速反应,生成偏硼酸钠
后,能够迅速反应,生成偏硼酸钠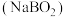 和氢气。写出该反应的化学方程式
和氢气。写出该反应的化学方程式(4)在研究浓度对催化剂Ru/NGR活性的影响时,发现B点后(见下图)增加
 的浓度,制氢速率反而下降,推断可能的原因是
的浓度,制氢速率反而下降,推断可能的原因是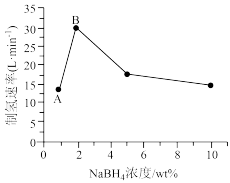
 溶液可制得
溶液可制得 ,实现物质的循环使用,制备装置如图所示。
,实现物质的循环使用,制备装置如图所示。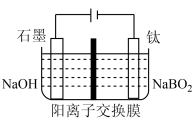
②电解过程中,阴极区溶液

您最近一年使用:0次
名校
解题方法
3 . CO2减排能有效降低温室效应,同时,CO2也是一种重要的资源,因此CO2捕集与转化技术研究备受关注。
I.CO2催化加氢制甲醇
(1)已知:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ•mol-1
则CO2催化加氢制甲醇的热化学方程式为_______ 。若反应①为慢反应(活化能高),下列图中能体现上述能量变化的是_______ 。
(2)已知离子液体聚合物在不同温度和不同CO2流速下,CO2吸附容量随时间的变化如图1和图2。
①离子液体聚合物捕集CO2的反应为_______ (填“吸热”或“放热”)反应。
②离子液体聚合物捕集CO2的有利条件是_______ 。
Ⅲ:Me-CO2电池捕集CO2
图3是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和氯化钠溶液作为水系电解液,以氮掺杂单壁碳纳米角(N-SWCNH)为催化剂,其主要放电产物为NaHCO3和C。_______ (填“正”或“负”)。
(4)B极的电极反应为_______ 。
I.CO2催化加氢制甲醇
(1)已知:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ•mol-1
则CO2催化加氢制甲醇的热化学方程式为
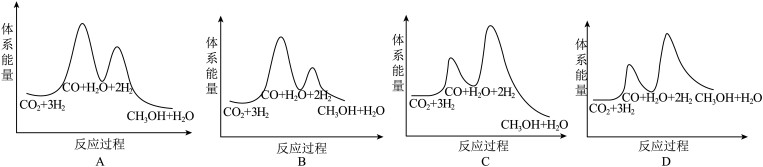
(2)已知离子液体聚合物在不同温度和不同CO2流速下,CO2吸附容量随时间的变化如图1和图2。
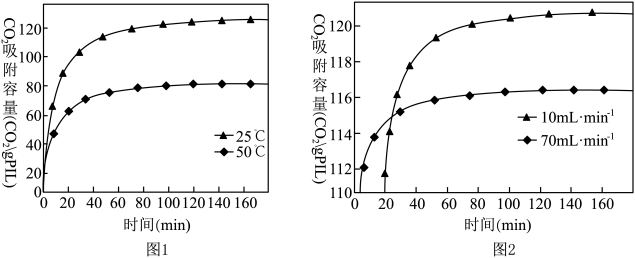
①离子液体聚合物捕集CO2的反应为
②离子液体聚合物捕集CO2的有利条件是
Ⅲ:Me-CO2电池捕集CO2
图3是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和氯化钠溶液作为水系电解液,以氮掺杂单壁碳纳米角(N-SWCNH)为催化剂,其主要放电产物为NaHCO3和C。
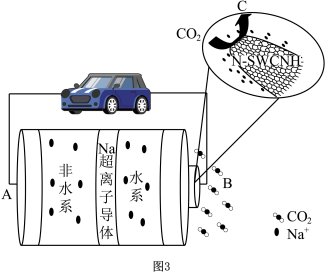
(4)B极的电极反应为
您最近一年使用:0次
2023高三上·江苏·专题练习
4 . 二氧化碳的排放受到环境和能源领域的关注,其综合利用是研究的重要课题。
Ⅰ.第19届亚洲运动会使用废碳再生的绿色零碳甲醇作为主火炬塔燃料,利用焦炉气中的 与从工业尾气中捕集的
与从工业尾气中捕集的 合成,实现循环内零碳排放。
合成,实现循环内零碳排放。
(1)已知:反应I: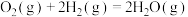
 kJ/mol
kJ/mol
反应Ⅱ:
 kJ/mol
kJ/mol
合成甲醇的反应:

_______ kJ/mol。
(2) 催化加氢制甲醇可能的反应历程如下图。
催化加氢制甲醇可能的反应历程如下图。 首先在Zn-Ga-O表面解离成2个
首先在Zn-Ga-O表面解离成2个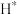 ,随后参与到
,随后参与到 的还原过程。
的还原过程。
理论上,反应历程中消耗的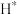 与生成的甲醇的物质的量之比为
与生成的甲醇的物质的量之比为_______ 。
(3)该催化条件下,主要的副反应为: 。实际工业生产中,需要在260℃、压强恒为4.0 MPa的反应釜中进行上述反应。为确保反应的连续性,需向反应釜中以进气流量0.04 mol/min、
。实际工业生产中,需要在260℃、压强恒为4.0 MPa的反应釜中进行上述反应。为确保反应的连续性,需向反应釜中以进气流量0.04 mol/min、 持续通入原料,同时控制出气流量。
持续通入原料,同时控制出气流量。
①需控制出气流量小于进气流量的原因为_______ 。
②已知出气流量为0.03 mol/min,单位时间 的转化率为60%,则流出气体中
的转化率为60%,则流出气体中 的百分含量为
的百分含量为_______ 。
Ⅱ.高炉气中捕集 制储氢物质HCOOH的综合利用示意图如下图所示:
制储氢物质HCOOH的综合利用示意图如下图所示: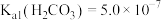 ,
,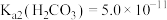
(4)T温度下,当吸收池中溶液的 时,此时该溶液中
时,此时该溶液中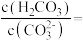
_______ 。
(5)电解池中 电催化还原为HCOOH。
电催化还原为HCOOH。
①铂电极反应方程式为_______ 。
②铂电极上的副反应除析氢外,没有其它放电过程。若生成HCOOH的电解效率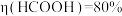 。当电路中转移3 mol
。当电路中转移3 mol  时,阴极室溶液的质量增加
时,阴极室溶液的质量增加_______ g。定义:
Ⅰ.第19届亚洲运动会使用废碳再生的绿色零碳甲醇作为主火炬塔燃料,利用焦炉气中的
 与从工业尾气中捕集的
与从工业尾气中捕集的 合成,实现循环内零碳排放。
合成,实现循环内零碳排放。(1)已知:反应I:
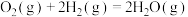
 kJ/mol
kJ/mol反应Ⅱ:

 kJ/mol
kJ/mol合成甲醇的反应:


(2)
 催化加氢制甲醇可能的反应历程如下图。
催化加氢制甲醇可能的反应历程如下图。 首先在Zn-Ga-O表面解离成2个
首先在Zn-Ga-O表面解离成2个 ,随后参与到
,随后参与到 的还原过程。
的还原过程。
理论上,反应历程中消耗的
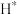 与生成的甲醇的物质的量之比为
与生成的甲醇的物质的量之比为(3)该催化条件下,主要的副反应为:
 。实际工业生产中,需要在260℃、压强恒为4.0 MPa的反应釜中进行上述反应。为确保反应的连续性,需向反应釜中以进气流量0.04 mol/min、
。实际工业生产中,需要在260℃、压强恒为4.0 MPa的反应釜中进行上述反应。为确保反应的连续性,需向反应釜中以进气流量0.04 mol/min、 持续通入原料,同时控制出气流量。
持续通入原料,同时控制出气流量。①需控制出气流量小于进气流量的原因为
②已知出气流量为0.03 mol/min,单位时间
 的转化率为60%,则流出气体中
的转化率为60%,则流出气体中 的百分含量为
的百分含量为Ⅱ.高炉气中捕集
 制储氢物质HCOOH的综合利用示意图如下图所示:
制储氢物质HCOOH的综合利用示意图如下图所示:
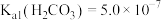 ,
,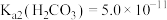
(4)T温度下,当吸收池中溶液的
 时,此时该溶液中
时,此时该溶液中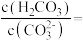
(5)电解池中
 电催化还原为HCOOH。
电催化还原为HCOOH。①铂电极反应方程式为
②铂电极上的副反应除析氢外,没有其它放电过程。若生成HCOOH的电解效率
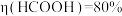 。当电路中转移3 mol
。当电路中转移3 mol  时,阴极室溶液的质量增加
时,阴极室溶液的质量增加
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题。
Ⅰ.下图为在某催化剂表面合成氨反应机理。
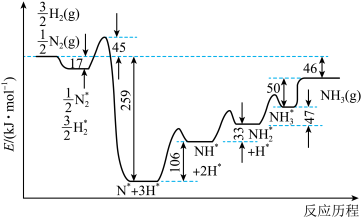
(1)图中决速步骤(即速率最慢步骤)的化学方程式为___________ 。
(2)反应 的
的
___________ kJ/mol。
Ⅱ.元素铬(Cr)在溶液中主要以 (蓝紫色)、
(蓝紫色)、 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,
(黄色)等形式存在, 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:
(3) 与
与 的化学性质相似,在
的化学性质相似,在 溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是
溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是___________ 。
(4) 和
和 在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的
在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的 溶液中(
溶液中(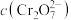 )随
)随 的)的变化如图所示。
的)的变化如图所示。
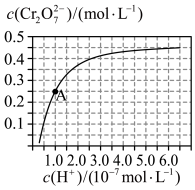
①用离子方程式表示 溶液中的转化反应
溶液中的转化反应___________ 。
②由图可知,溶液酸性增大, 的平衡转化率
的平衡转化率___________ (填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为___________ 。
③升高温度,溶液中 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
___________ 0(填“大于”“小于”或“等于”)。
(5)+6价铬的化合物毒性较大,常用 将废液中的
将废液中的 还原成
还原成 ,反应的离子方程式为
,反应的离子方程式为___________ 。
Ⅰ.下图为在某催化剂表面合成氨反应机理。

(1)图中决速步骤(即速率最慢步骤)的化学方程式为
(2)反应
 的
的
Ⅱ.元素铬(Cr)在溶液中主要以
 (蓝紫色)、
(蓝紫色)、 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,
(黄色)等形式存在, 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:(3)
 与
与 的化学性质相似,在
的化学性质相似,在 溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是
溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是(4)
 和
和 在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的
在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的 溶液中(
溶液中(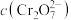 )随
)随 的)的变化如图所示。
的)的变化如图所示。
①用离子方程式表示
 溶液中的转化反应
溶液中的转化反应②由图可知,溶液酸性增大,
 的平衡转化率
的平衡转化率③升高温度,溶液中
 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(5)+6价铬的化合物毒性较大,常用
 将废液中的
将废液中的 还原成
还原成 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 . 在一定的温度和压强下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。
已知:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=﹣165kJ·mol-1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH= +41kJ·mol-1
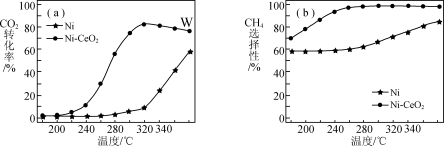
催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测CO2转化率和生成CH4选择性随温度变化的影响如图所示。
CH4选择性=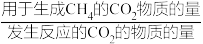 ×100%
×100%
下列有关说法正确的是
已知:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=﹣165kJ·mol-1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH= +41kJ·mol-1
催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测CO2转化率和生成CH4选择性随温度变化的影响如图所示。

CH4选择性=
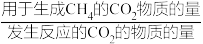 ×100%
×100%下列有关说法正确的是
| A.CO(g)+3H2(g)=CH4(g)+H2O(g) ΔH=+206kJ·mol-1 |
| B.延长W点的反应时间,一定能提高CO2的转化率 |
| C.在260℃~320℃间,以Ni-CeO2为催化剂,升高温度CH4的产率增大 |
| D.高于320℃后,以Ni为催化剂,随温度的升高CO2转化率上升的原因是平衡正向移动 |
您最近一年使用:0次
2023-10-05更新
|
378次组卷
|
2卷引用:河北省保定市河北安国中学等4校2022-2023学年高三上学期11月期中化学试题
解题方法
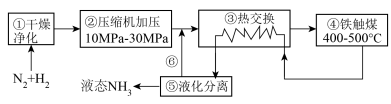
7 . I.如图为工业合成氨的流程图:_______ (填序号)。
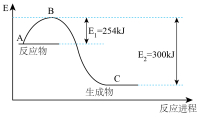
(2)如图是未用催化剂N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请在图中绘制同条件下加入铁触媒后相应的能量变化曲线:_______ ,并写出该条件下2molNH3(g)分解对应的热化学方程式:_______ 。
(3)则:α1_______ α2、α1_______ α3(填“>”、“=”或“<”)
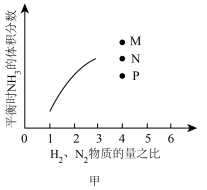
(4)如图甲表示500℃、60.0MPa条件下,平衡时NH3的体积分数与原料气投料比的关系。若投料比为4时,氨气的体积分数为40%,NH3的体积分数可能为图中的_______ 点,平衡时N2的体积分数为_______ 。_______ 。
(2)如图是未用催化剂N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请在图中绘制同条件下加入铁触媒后相应的能量变化曲线:
| 序号 | 起始投入量 | 平衡转化率 | ||
| N2 | H2 | NH3 | ||
| ①恒温恒容 | 1mol | 3mol | 0 | α1 |
| ②绝热恒容 | 1mol | 3mol | 0 | α2 |
| ③恒温恒压 | 2mol | 6mol | 0 | α3 |
(4)如图甲表示500℃、60.0MPa条件下,平衡时NH3的体积分数与原料气投料比的关系。若投料比为4时,氨气的体积分数为40%,NH3的体积分数可能为图中的
您最近一年使用:0次
解题方法
8 . 比利时根特大学曾在Science上发表一篇“甲烷超干重整”论文,体现了 重整技术是一种实现“碳中和”的有效手段,具有广阔的市场前景、经济效应和社会意义。甲烷超干重整反应为:
重整技术是一种实现“碳中和”的有效手段,具有广阔的市场前景、经济效应和社会意义。甲烷超干重整反应为: 。“甲烷超干重整”是一种特殊的
。“甲烷超干重整”是一种特殊的 重整技术。
重整技术。 重整技术涉及的反应如下:
重整技术涉及的反应如下:
反应Ⅰ:
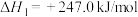
反应Ⅱ:
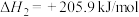
反应Ⅲ:
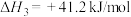
回答下列问题:
(1)甲烷超干重整反应的
___________ kJ/mol。通过焓变数据分析,“甲烷超干重整”反应对比反应Ⅰ型的 重整的优势为
重整的优势为___________ 。
(2) 重整技术存在与碳有关的多个反应的平衡。这些平衡的存在会导致二氧化碳转化率降低,拖累整体的碳利用率。“甲烷超干重整”的巨大优势在于利于高效催化剂将生成的水排除体系,请利用平衡移动原理分析优势
重整技术存在与碳有关的多个反应的平衡。这些平衡的存在会导致二氧化碳转化率降低,拖累整体的碳利用率。“甲烷超干重整”的巨大优势在于利于高效催化剂将生成的水排除体系,请利用平衡移动原理分析优势___________ 。
(3)“甲烷超干重整”的高效催化剂能有效抑制有水参与或生成的副反应,按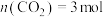 ,
,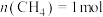 加入1L刚性密闭容器中进行“甲烷超干重整"。
加入1L刚性密闭容器中进行“甲烷超干重整"。
①下列描述能说明该反应达到平衡状态的是___________ 。
A.容器内混合气体的密度保持不变
B.容器内压强保持不变
C. 和CO的物质的量之比保持不变
和CO的物质的量之比保持不变
D.断裂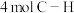 键的同时形成
键的同时形成
②若反应均达平衡时,甲烷的转化率为90%,二氧化碳的转化率为85%,则“甲烷超干重整”反应的选择性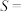
___________ %(保留2位小数);反应I的平衡常数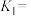
___________ (写出计算式即可)。[反应选择性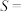 (主反应的转化率/所有反应的转化率)*100%]
(主反应的转化率/所有反应的转化率)*100%]
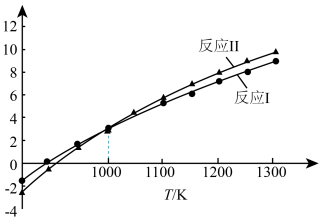
(4) 重整技术反应Ⅰ和Ⅱ平衡常数与温度的关系如图所示,则1000K时,反应Ⅲ的平衡常数
重整技术反应Ⅰ和Ⅱ平衡常数与温度的关系如图所示,则1000K时,反应Ⅲ的平衡常数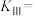
___________ 。
 重整技术是一种实现“碳中和”的有效手段,具有广阔的市场前景、经济效应和社会意义。甲烷超干重整反应为:
重整技术是一种实现“碳中和”的有效手段,具有广阔的市场前景、经济效应和社会意义。甲烷超干重整反应为: 。“甲烷超干重整”是一种特殊的
。“甲烷超干重整”是一种特殊的 重整技术。
重整技术。 重整技术涉及的反应如下:
重整技术涉及的反应如下:反应Ⅰ:

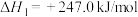
反应Ⅱ:

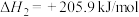
反应Ⅲ:

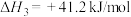
回答下列问题:
(1)甲烷超干重整反应的

 重整的优势为
重整的优势为(2)
 重整技术存在与碳有关的多个反应的平衡。这些平衡的存在会导致二氧化碳转化率降低,拖累整体的碳利用率。“甲烷超干重整”的巨大优势在于利于高效催化剂将生成的水排除体系,请利用平衡移动原理分析优势
重整技术存在与碳有关的多个反应的平衡。这些平衡的存在会导致二氧化碳转化率降低,拖累整体的碳利用率。“甲烷超干重整”的巨大优势在于利于高效催化剂将生成的水排除体系,请利用平衡移动原理分析优势(3)“甲烷超干重整”的高效催化剂能有效抑制有水参与或生成的副反应,按
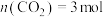 ,
,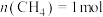 加入1L刚性密闭容器中进行“甲烷超干重整"。
加入1L刚性密闭容器中进行“甲烷超干重整"。①下列描述能说明该反应达到平衡状态的是
A.容器内混合气体的密度保持不变
B.容器内压强保持不变
C.
 和CO的物质的量之比保持不变
和CO的物质的量之比保持不变 D.断裂
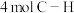 键的同时形成
键的同时形成
②若反应均达平衡时,甲烷的转化率为90%,二氧化碳的转化率为85%,则“甲烷超干重整”反应的选择性
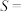
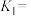
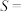 (主反应的转化率/所有反应的转化率)*100%]
(主反应的转化率/所有反应的转化率)*100%](4)
 重整技术反应Ⅰ和Ⅱ平衡常数与温度的关系如图所示,则1000K时,反应Ⅲ的平衡常数
重整技术反应Ⅰ和Ⅱ平衡常数与温度的关系如图所示,则1000K时,反应Ⅲ的平衡常数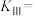

您最近一年使用:0次
解题方法
9 . 合成氨工业在20世纪初期迅速发展,开始用氨作炸药工业的原料,为战争服务。第一次世界大战结束后,氨转向为农业、工业服务。50年代后合成氨的原料构成发生重大变化,近30年来合成氨工业发展很快,三位化学家因为合成氨反应获得诺贝尔奖。
回答下列问题:
(1)2007年度诺贝尔化学奖获得者格哈德·埃特尔,确认了合成氨反应机理。673K时,各步反应的能量变化如图,其中吸附在能化剂表面上的粒子用“*”标注。

①图中决速步骤的反应方程式为___________ 。
②工业上投料时 ,试从化学反应平衡和化学反应速率的角度解释其原因:
,试从化学反应平衡和化学反应速率的角度解释其原因:___________ 。
(2) 与
与 作用分别生成
作用分别生成 、
、 、
、 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的 、
、 和
和 的混合气体以一定流速经过装有催化剂的反应管,
的混合气体以一定流速经过装有催化剂的反应管, 的转化率、
的转化率、 的选择性[
的选择性[ ]与温度的关系如图。
]与温度的关系如图。

①其他条件不变,在175~300℃范围内升高温度,出口处氮氧化物的量___________ (填“增大”或“减小”), 的平衡转化率
的平衡转化率___________ (填“增大”或“或小”)。
②为能更有效除去尾气中的 ,且使
,且使 的选择性高,应选择的最佳温度为
的选择性高,应选择的最佳温度为___________ 。
(3)工业合成氨需要的原料之一是 。国际上最为有效的制氢工艺是甲烷水蒸气重整反应,涉及的主要反应如下:
。国际上最为有效的制氢工艺是甲烷水蒸气重整反应,涉及的主要反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
一定条件下,向恒容容器中以物质的量之比为1:3的比例投入甲烷和水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则 的物质的量分数
的物质的量分数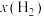 =
=___________ ( ),反应Ⅲ以物质的量分数表示的平衡常数
),反应Ⅲ以物质的量分数表示的平衡常数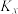 =
=___________ (可用分数表示)。
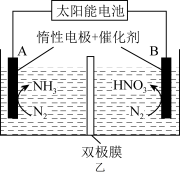
(4)利用磷盐分子作为质子导体,可实现高速率电催化还原反应合成 ,其原理如图所示。
,其原理如图所示。

此过程中涉及到生成 的反应有
的反应有___________ 。
回答下列问题:
(1)2007年度诺贝尔化学奖获得者格哈德·埃特尔,确认了合成氨反应机理。673K时,各步反应的能量变化如图,其中吸附在能化剂表面上的粒子用“*”标注。

①图中决速步骤的反应方程式为
②工业上投料时
 ,试从化学反应平衡和化学反应速率的角度解释其原因:
,试从化学反应平衡和化学反应速率的角度解释其原因:(2)
 与
与 作用分别生成
作用分别生成 、
、 、
、 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的 、
、 和
和 的混合气体以一定流速经过装有催化剂的反应管,
的混合气体以一定流速经过装有催化剂的反应管, 的转化率、
的转化率、 的选择性[
的选择性[ ]与温度的关系如图。
]与温度的关系如图。
①其他条件不变,在175~300℃范围内升高温度,出口处氮氧化物的量
 的平衡转化率
的平衡转化率②为能更有效除去尾气中的
 ,且使
,且使 的选择性高,应选择的最佳温度为
的选择性高,应选择的最佳温度为(3)工业合成氨需要的原料之一是
 。国际上最为有效的制氢工艺是甲烷水蒸气重整反应,涉及的主要反应如下:
。国际上最为有效的制氢工艺是甲烷水蒸气重整反应,涉及的主要反应如下:反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

一定条件下,向恒容容器中以物质的量之比为1:3的比例投入甲烷和水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则
 的物质的量分数
的物质的量分数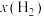 =
= ),反应Ⅲ以物质的量分数表示的平衡常数
),反应Ⅲ以物质的量分数表示的平衡常数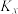 =
=(4)利用磷盐分子作为质子导体,可实现高速率电催化还原反应合成
 ,其原理如图所示。
,其原理如图所示。
此过程中涉及到生成
 的反应有
的反应有
您最近一年使用:0次
名校
10 . 中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水蒸气,其主要过程如图所示。

已知:几种物质中化学键的键能如下表所示。
若反应过程中分解了2mol水蒸气,下列说法错误的是

已知:几种物质中化学键的键能如下表所示。
| 化学键 |  |  |  |  |
键能/( ) ) | 463 | 496 | 436 | 138 |
| A.过程Ⅰ吸收了926kJ能量 |
| B.过程Ⅱ涉及非极性键的生成 |
| C.过程Ⅲ属于放热反应 |
D.总反应的热化学方程式为 |
您最近一年使用:0次
2023-02-10更新
|
745次组卷
|
5卷引用:河北省沧州市2022-2023学年高二上学期期末考试化学试题
河北省沧州市2022-2023学年高二上学期期末考试化学试题重庆市主城区(九龙坡区)2023届学业质量调研第三次抽查化学试题(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)湖北省仙桃市田家炳实验高级中学2023-2024学年高三上学期11月月考化学试题云南省开远市第一中学校2023-2024学年高二下学期3月月考化学试题



