22-23高二·全国·假期作业
解题方法
1 . 脱除沼气中的H2S具有重要意义,脱除H2S有多种方法。
(1)受热分解法。将H2S和CH4混合气导入热解器,反应分两步进行。
反应Ⅰ:2H2S(g)=2H2(g)+S2(g) =169.8kJ/mol
=169.8kJ/mol
反应Ⅱ:CH4(g)+S2(g)=CS2(g)+2H2(g) =63.7kJ/mol
=63.7kJ/mol
现将硫化氢和甲烷按照2:1体积比投料,并用N2稀释,常压和不同温度下反应,反应相同时间后,H2、S2和CS2体积分数如图所示。 =
=___________ 。
②1050℃时,H2的体积分数为___________ 。
③在950℃~1150℃范围内,其他条件不变,随着温度的升高,S2(g)的体积分数先增大而后减小,其原因可能是___________ 。
(2)光电催化法。某光电催化法脱除H2S的原理如图所示。___________ 。
②与受热分解法相比,光电催化法的优点是___________ 。
(3)催化重整法。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。___________ 。
②脱除一段时间后,催化剂的活性降低,原因是___________ 。
(1)受热分解法。将H2S和CH4混合气导入热解器,反应分两步进行。
反应Ⅰ:2H2S(g)=2H2(g)+S2(g)
 =169.8kJ/mol
=169.8kJ/mol反应Ⅱ:CH4(g)+S2(g)=CS2(g)+2H2(g)
 =63.7kJ/mol
=63.7kJ/mol现将硫化氢和甲烷按照2:1体积比投料,并用N2稀释,常压和不同温度下反应,反应相同时间后,H2、S2和CS2体积分数如图所示。

 =
=②1050℃时,H2的体积分数为
③在950℃~1150℃范围内,其他条件不变,随着温度的升高,S2(g)的体积分数先增大而后减小,其原因可能是
(2)光电催化法。某光电催化法脱除H2S的原理如图所示。
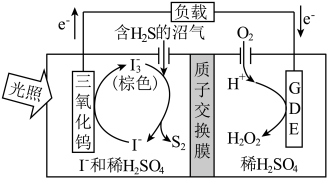
②与受热分解法相比,光电催化法的优点是
(3)催化重整法。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。
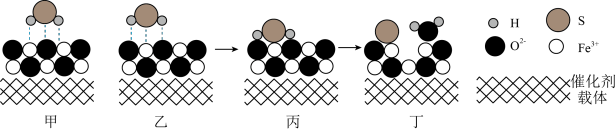
②脱除一段时间后,催化剂的活性降低,原因是
您最近一年使用:0次
名校
解题方法
2 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。

已知:
①25℃时一些难溶氢氧化物的 :
:
②“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ),
), 的分子中含过氧键,它在水溶液中的第一步电离完全,第二步电离微弱。
的分子中含过氧键,它在水溶液中的第一步电离完全,第二步电离微弱。
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为___________ 。
(2)“氧化”中,用石灰乳调节 ,
, 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ ;滤渣的成分为 、
、 、
、___________ (填化学式)。
(3)“氧化”中保持空气通入速率不变, 氧化率与时间的关系如下图。
氧化率与时间的关系如下图。 体积分数为
体积分数为___________ 时, 氧化速率最大;继续增大
氧化速率最大;继续增大 体积分数时,
体积分数时, 氧化速率减小的原因是
氧化速率减小的原因是___________ 。

(4)“钴镍渣”中得到的 在空气中可被氧化成
在空气中可被氧化成 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(5)“沉镁”中,25℃时为使 沉淀完全(c(Mg2+)≤10-5mol/L),需控制溶液的pH为
沉淀完全(c(Mg2+)≤10-5mol/L),需控制溶液的pH为___________ 。
 、
、 、
、 、
、 、
、 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。
已知:
①25℃时一些难溶氢氧化物的
 :
:| 物质 |  |  |  |  |
 |  |  |  | 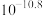 |
 ),
), 的分子中含过氧键,它在水溶液中的第一步电离完全,第二步电离微弱。
的分子中含过氧键,它在水溶液中的第一步电离完全,第二步电离微弱。回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,用石灰乳调节
 ,
, 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、 、
、(3)“氧化”中保持空气通入速率不变,
 氧化率与时间的关系如下图。
氧化率与时间的关系如下图。 体积分数为
体积分数为 氧化速率最大;继续增大
氧化速率最大;继续增大 体积分数时,
体积分数时, 氧化速率减小的原因是
氧化速率减小的原因是
(4)“钴镍渣”中得到的
 在空气中可被氧化成
在空气中可被氧化成 ,该反应的化学方程式为
,该反应的化学方程式为(5)“沉镁”中,25℃时为使
 沉淀完全(c(Mg2+)≤10-5mol/L),需控制溶液的pH为
沉淀完全(c(Mg2+)≤10-5mol/L),需控制溶液的pH为
您最近一年使用:0次
解题方法
3 . 工业废气中常含有一定量的 ,可通过热解法、光解法和氧化法脱除。
,可通过热解法、光解法和氧化法脱除。
(1) 与
与 在石英管中发生热解时发生如下两步反应:
在石英管中发生热解时发生如下两步反应: ,
,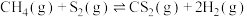 ,常压和1100℃下反应一段时间后,测得
,常压和1100℃下反应一段时间后,测得 和
和 的体积分数分别为5.5%、0.4%,则
的体积分数分别为5.5%、0.4%,则 的体积分数为
的体积分数为___________ 。
(2) 催化剂在光照时会产生电子和具有强氧化性的电子空穴
催化剂在光照时会产生电子和具有强氧化性的电子空穴 ,在催化剂表面负载Pt、
,在催化剂表面负载Pt、 时,有利于电子和空穴的分离,该光催化分解
时,有利于电子和空穴的分离,该光催化分解 的反应机理如图所示,此过程可描述为
的反应机理如图所示,此过程可描述为___________ 。

(3) 氧化法脱除
氧化法脱除 的装置如下左图所示。其他条件一定,溶液中
的装置如下左图所示。其他条件一定,溶液中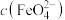 与电流密度(电流密度与电压成正比)的关系如下右图所示。
与电流密度(电流密度与电压成正比)的关系如下右图所示。

①写出电解时阳极的电极反应式:___________ 。
②电流密度大于 时,溶液中
时,溶液中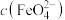 上升幅度变小的原因是
上升幅度变小的原因是___________ 。
③控制电流密度为 ,分别以不同浓度的
,分别以不同浓度的 溶液为电解质,电解相同时间后通入
溶液为电解质,电解相同时间后通入 充分反应,测得
充分反应,测得 的氧化率与
的氧化率与 溶液浓度的关系如图所示。
溶液浓度的关系如图所示。 时
时 的氧化率达到最大的原因是
的氧化率达到最大的原因是___________ 。

 ,可通过热解法、光解法和氧化法脱除。
,可通过热解法、光解法和氧化法脱除。(1)
 与
与 在石英管中发生热解时发生如下两步反应:
在石英管中发生热解时发生如下两步反应: ,
,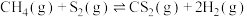 ,常压和1100℃下反应一段时间后,测得
,常压和1100℃下反应一段时间后,测得 和
和 的体积分数分别为5.5%、0.4%,则
的体积分数分别为5.5%、0.4%,则 的体积分数为
的体积分数为(2)
 催化剂在光照时会产生电子和具有强氧化性的电子空穴
催化剂在光照时会产生电子和具有强氧化性的电子空穴 ,在催化剂表面负载Pt、
,在催化剂表面负载Pt、 时,有利于电子和空穴的分离,该光催化分解
时,有利于电子和空穴的分离,该光催化分解 的反应机理如图所示,此过程可描述为
的反应机理如图所示,此过程可描述为
(3)
 氧化法脱除
氧化法脱除 的装置如下左图所示。其他条件一定,溶液中
的装置如下左图所示。其他条件一定,溶液中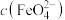 与电流密度(电流密度与电压成正比)的关系如下右图所示。
与电流密度(电流密度与电压成正比)的关系如下右图所示。
①写出电解时阳极的电极反应式:
②电流密度大于
 时,溶液中
时,溶液中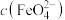 上升幅度变小的原因是
上升幅度变小的原因是③控制电流密度为
 ,分别以不同浓度的
,分别以不同浓度的 溶液为电解质,电解相同时间后通入
溶液为电解质,电解相同时间后通入 充分反应,测得
充分反应,测得 的氧化率与
的氧化率与 溶液浓度的关系如图所示。
溶液浓度的关系如图所示。 时
时 的氧化率达到最大的原因是
的氧化率达到最大的原因是
您最近一年使用:0次
2023-12-09更新
|
366次组卷
|
2卷引用:江苏省南通市2023-2024学年高二上学期期中考试化学试题
名校
4 . 利用CO2和 H2可制得甲烷,实现资源综合利用。
已知:I. 2
2 2
2 2
2 1
1 -1
-1
II. CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-165.0 kJ·mol-1
在一定的温度和压力下,将按一定比例混合的CO2和H2混合气体通过装有催化剂的反应器, 反应相同时间, CO2转化率和 CH4选择性随温度变化关系如图所示。
CH4选择性=
已知:I.
 2
2 2
2 2
2 1
1 -1
-1II. CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-165.0 kJ·mol-1
在一定的温度和压力下,将按一定比例混合的CO2和H2混合气体通过装有催化剂的反应器, 反应相同时间, CO2转化率和 CH4选择性随温度变化关系如图所示。
CH4选择性=


| A.反应Ⅱ:2E(C=O)+4E(H-H)<4E(C-H)+4E(H-O)(E表示键能) |
| B.240℃时,其他条件不变,增大压强能提高CO2的转化率 |
| C.在260~300℃间, 其他条件不变, 升高温度 CH4的产率增大 |
| D.320℃时CO2的转化率最大,说明反应I和反应II一定都达到了平衡状态 |
您最近一年使用:0次
2023-12-06更新
|
577次组卷
|
3卷引用:江苏省徐州市第一中学、淮阴中学、姜堰中学2023-2024学年高三上学期联考化学试题
5 . 氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。
(1)与汽油相比,氢气作为燃料的优点是___________ (至少答出两点)。
(2)氢气可用于制备 ,已知:
,已知:
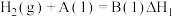
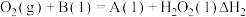
其中A、B为有机物,两反应均为自发反应,则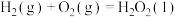 的
的
_______ 0(填“>”“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应: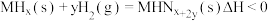 达到化学平衡。下列有关叙述正确的是
达到化学平衡。下列有关叙述正确的是___________ 。
a.容器内气体压强保持不变
b.吸收 只需
只需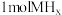
c.若升高温度,该反应的平衡常数增大
(4)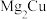 是一种储氢合金。350℃时,
是一种储氢合金。350℃时,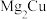 与
与 反应,生成
反应,生成 和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。
和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。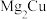 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(5)电解法制取 可同时获得氢气:
可同时获得氢气: ,工作原理如图所示、通电后,铁电极附近生成紫红色
,工作原理如图所示、通电后,铁电极附近生成紫红色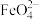 ,镍电极有气泡产生。若
,镍电极有气泡产生。若 溶液浓度过高,铁电极区会产生红褐色物质。已知:
溶液浓度过高,铁电极区会产生红褐色物质。已知: 只在强碱性条件下稳定,易被
只在强碱性条件下稳定,易被 还原。
还原。

①电解一段时间后, 降低的区域在
降低的区域在___________ 。(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出的原因是___________ 。
③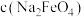 随初始
随初始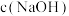 的变化如图,分析M、N点
的变化如图,分析M、N点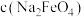 低于最高值的原因:
低于最高值的原因:___________ 。

(1)与汽油相比,氢气作为燃料的优点是
(2)氢气可用于制备
 ,已知:
,已知: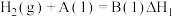
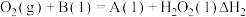
其中A、B为有机物,两反应均为自发反应,则
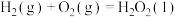 的
的
(3)在恒温恒容的密闭容器中,某储氢反应:
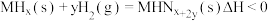 达到化学平衡。下列有关叙述正确的是
达到化学平衡。下列有关叙述正确的是a.容器内气体压强保持不变
b.吸收
 只需
只需
c.若升高温度,该反应的平衡常数增大
(4)
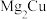 是一种储氢合金。350℃时,
是一种储氢合金。350℃时,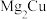 与
与 反应,生成
反应,生成 和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。
和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。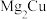 与
与 反应的化学方程式为
反应的化学方程式为(5)电解法制取
 可同时获得氢气:
可同时获得氢气: ,工作原理如图所示、通电后,铁电极附近生成紫红色
,工作原理如图所示、通电后,铁电极附近生成紫红色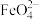 ,镍电极有气泡产生。若
,镍电极有气泡产生。若 溶液浓度过高,铁电极区会产生红褐色物质。已知:
溶液浓度过高,铁电极区会产生红褐色物质。已知: 只在强碱性条件下稳定,易被
只在强碱性条件下稳定,易被 还原。
还原。
①电解一段时间后,
 降低的区域在
降低的区域在②电解过程中,须将阴极产生的气体及时排出的原因是
③
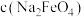 随初始
随初始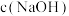 的变化如图,分析M、N点
的变化如图,分析M、N点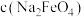 低于最高值的原因:
低于最高值的原因:
您最近一年使用:0次
名校
解题方法
6 . 氢气是一种理想的绿色能源,有科学家预言,氢能将成为人类的主要能源。已知以水为原料通过下列途径均可制得氢气。
(i)太阳光催化分解水:
(ii)焦炭与水反应:
(iii)甲烷与水反应:
(1)反应i中主要的能量转化为___________ ;你认为通过此途径进行 工业化生产的最突出优点是
工业化生产的最突出优点是___________ 。
(2)相同温度压强下,若分别以i、ii反应生成 ,反应ii比i要少吸收
,反应ii比i要少吸收___________ kJ热量;你认为ii反应需要吸热较小的原因可能是___________ (从 角度考虑)。
角度考虑)。
(3)①写出反应的化学平衡常数的表达式:
___________
②一定温度下,iii反应中使用催化剂后,下列物理量能保持不变的有___________ 。
A.焓变 B.反应活化能
B.反应活化能 C.活化分子百分比 D.平衡常数
C.活化分子百分比 D.平衡常数
(4)①利用上述热化学方程式,推测反应
___________  ;
;
②键能也可以用于估算化学反应的反应热( )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:
已知白磷的标准燃烧热为-2378kJ/mol,白磷( )的结构为正四面体,白磷完全燃烧的产物结构如图所示,则上表中
)的结构为正四面体,白磷完全燃烧的产物结构如图所示,则上表中
___________ 。

(i)太阳光催化分解水:

(ii)焦炭与水反应:

(iii)甲烷与水反应:

(1)反应i中主要的能量转化为
 工业化生产的最突出优点是
工业化生产的最突出优点是(2)相同温度压强下,若分别以i、ii反应生成
 ,反应ii比i要少吸收
,反应ii比i要少吸收 角度考虑)。
角度考虑)。(3)①写出反应的化学平衡常数的表达式:

②一定温度下,iii反应中使用催化剂后,下列物理量能保持不变的有
A.焓变
 B.反应活化能
B.反应活化能 C.活化分子百分比 D.平衡常数
C.活化分子百分比 D.平衡常数
(4)①利用上述热化学方程式,推测反应

 ;
;②键能也可以用于估算化学反应的反应热(
 )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
键能( ) ) | 172 | 335 | 498 | X |
 )的结构为正四面体,白磷完全燃烧的产物结构如图所示,则上表中
)的结构为正四面体,白磷完全燃烧的产物结构如图所示,则上表中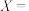

您最近一年使用:0次
2023-11-21更新
|
324次组卷
|
4卷引用:江苏省扬州大学附属中学2023-2024学年高二上学期11月期中化学试题
2023高三上·江苏·专题练习
7 . 二氧化碳的排放受到环境和能源领域的关注,其综合利用是研究的重要课题。
Ⅰ.第19届亚洲运动会使用废碳再生的绿色零碳甲醇作为主火炬塔燃料,利用焦炉气中的 与从工业尾气中捕集的
与从工业尾气中捕集的 合成,实现循环内零碳排放。
合成,实现循环内零碳排放。
(1)已知:反应I: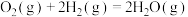
 kJ/mol
kJ/mol
反应Ⅱ:
 kJ/mol
kJ/mol
合成甲醇的反应:

_______ kJ/mol。
(2) 催化加氢制甲醇可能的反应历程如下图。
催化加氢制甲醇可能的反应历程如下图。 首先在Zn-Ga-O表面解离成2个
首先在Zn-Ga-O表面解离成2个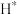 ,随后参与到
,随后参与到 的还原过程。
的还原过程。
理论上,反应历程中消耗的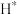 与生成的甲醇的物质的量之比为
与生成的甲醇的物质的量之比为_______ 。
(3)该催化条件下,主要的副反应为: 。实际工业生产中,需要在260℃、压强恒为4.0 MPa的反应釜中进行上述反应。为确保反应的连续性,需向反应釜中以进气流量0.04 mol/min、
。实际工业生产中,需要在260℃、压强恒为4.0 MPa的反应釜中进行上述反应。为确保反应的连续性,需向反应釜中以进气流量0.04 mol/min、 持续通入原料,同时控制出气流量。
持续通入原料,同时控制出气流量。
①需控制出气流量小于进气流量的原因为_______ 。
②已知出气流量为0.03 mol/min,单位时间 的转化率为60%,则流出气体中
的转化率为60%,则流出气体中 的百分含量为
的百分含量为_______ 。
Ⅱ.高炉气中捕集 制储氢物质HCOOH的综合利用示意图如下图所示:
制储氢物质HCOOH的综合利用示意图如下图所示: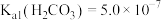 ,
,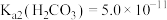
(4)T温度下,当吸收池中溶液的 时,此时该溶液中
时,此时该溶液中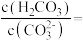
_______ 。
(5)电解池中 电催化还原为HCOOH。
电催化还原为HCOOH。
①铂电极反应方程式为_______ 。
②铂电极上的副反应除析氢外,没有其它放电过程。若生成HCOOH的电解效率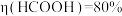 。当电路中转移3 mol
。当电路中转移3 mol  时,阴极室溶液的质量增加
时,阴极室溶液的质量增加_______ g。定义:
Ⅰ.第19届亚洲运动会使用废碳再生的绿色零碳甲醇作为主火炬塔燃料,利用焦炉气中的
 与从工业尾气中捕集的
与从工业尾气中捕集的 合成,实现循环内零碳排放。
合成,实现循环内零碳排放。(1)已知:反应I:
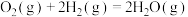
 kJ/mol
kJ/mol反应Ⅱ:

 kJ/mol
kJ/mol合成甲醇的反应:


(2)
 催化加氢制甲醇可能的反应历程如下图。
催化加氢制甲醇可能的反应历程如下图。 首先在Zn-Ga-O表面解离成2个
首先在Zn-Ga-O表面解离成2个 ,随后参与到
,随后参与到 的还原过程。
的还原过程。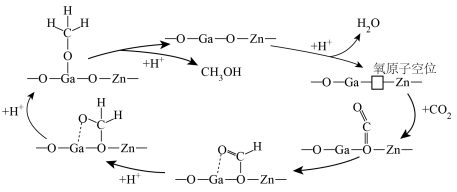
理论上,反应历程中消耗的
 与生成的甲醇的物质的量之比为
与生成的甲醇的物质的量之比为(3)该催化条件下,主要的副反应为:
 。实际工业生产中,需要在260℃、压强恒为4.0 MPa的反应釜中进行上述反应。为确保反应的连续性,需向反应釜中以进气流量0.04 mol/min、
。实际工业生产中,需要在260℃、压强恒为4.0 MPa的反应釜中进行上述反应。为确保反应的连续性,需向反应釜中以进气流量0.04 mol/min、 持续通入原料,同时控制出气流量。
持续通入原料,同时控制出气流量。①需控制出气流量小于进气流量的原因为
②已知出气流量为0.03 mol/min,单位时间
 的转化率为60%,则流出气体中
的转化率为60%,则流出气体中 的百分含量为
的百分含量为Ⅱ.高炉气中捕集
 制储氢物质HCOOH的综合利用示意图如下图所示:
制储氢物质HCOOH的综合利用示意图如下图所示:
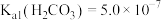 ,
,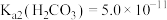
(4)T温度下,当吸收池中溶液的
 时,此时该溶液中
时,此时该溶液中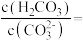
(5)电解池中
 电催化还原为HCOOH。
电催化还原为HCOOH。①铂电极反应方程式为
②铂电极上的副反应除析氢外,没有其它放电过程。若生成HCOOH的电解效率
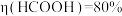 。当电路中转移3 mol
。当电路中转移3 mol  时,阴极室溶液的质量增加
时,阴极室溶液的质量增加
您最近一年使用:0次
8 . CO2的资源化利用具有重要的意义。
(1)合成尿素[CO(NH2)2]是利用CO2的途径之一。尿素合成主要通过下列反应实现:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH1=-272kJ·mol−1
反应Ⅱ:NH2COONH4(s)=CO(NH2)2(l)+H2O(g) ΔH2=138kJ·mol−1
①二氧化碳和氨气合成尿素固体和水蒸气的反应自发进行的条件是_______ (填“低温”、“高温”或“任意条件”)。
②MgO是CO2和环氧乙烷合成碳酸乙烯酯的催化剂,可由MgCl2与沉淀剂(尿素、氢氧化钠)反应,先生成沉淀,过滤后将沉淀焙烧得到。已知向MgCl2溶液中加入尿素生成的是Mg5(CO3)4(OH)2沉淀。与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是_______ 。
(2)二氧化碳加氢制甲醇已经成为研究热点。甲醇合成主要发生反应的化学反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.01kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.17kJ·mol-1
在密闭容器中,1.01×105Pa、n起始(CO2):n起始(H2)=1:3,其他条件相同时,反应温度对CO2的转化率和CH3OH的选择性的影响如图1、2所示。其中,CH3OH的选择性可表示为 ×100%。
×100%。

①图1,温度高于260°C时,CO2的平衡转化率呈上升变化的原因是_______ 。
②图2,温度相同时CH3OH选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是_______ 。
(3)用电化学方法还原CO2将其转化为其它化学产品可以实现对CO2的综合利用。图3是在酸性条件下电化学还原CO2的装置。

已知法拉第效率(FE)表示为:FE(B)%= 。控制pH=1、电解液中存在KCl时,电化学还原CO2过程中CH4(其他含碳产物未标出)和H2的法拉第效率变化如图4所示。
。控制pH=1、电解液中存在KCl时,电化学还原CO2过程中CH4(其他含碳产物未标出)和H2的法拉第效率变化如图4所示。

①写出阴极产生CH4的电极反应_______ 。
②结合上图的变化规律,推测KCl可能的作用是_______ 。
③c(KCl)=3mol/L时,22.4L(已折合为标准状况,下同)的CO2被完全吸收并还原为CH4和C2H4,分离H2后,将CH4和C2H4混合气体通入如图5所示装置(反应完全),出口处收集到气体8.96L(不考虑水蒸气),则FE(C2H4)%=_______ 。

(1)合成尿素[CO(NH2)2]是利用CO2的途径之一。尿素合成主要通过下列反应实现:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH1=-272kJ·mol−1
反应Ⅱ:NH2COONH4(s)=CO(NH2)2(l)+H2O(g) ΔH2=138kJ·mol−1
①二氧化碳和氨气合成尿素固体和水蒸气的反应自发进行的条件是
②MgO是CO2和环氧乙烷合成碳酸乙烯酯的催化剂,可由MgCl2与沉淀剂(尿素、氢氧化钠)反应,先生成沉淀,过滤后将沉淀焙烧得到。已知向MgCl2溶液中加入尿素生成的是Mg5(CO3)4(OH)2沉淀。与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是
(2)二氧化碳加氢制甲醇已经成为研究热点。甲醇合成主要发生反应的化学反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.01kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.17kJ·mol-1
在密闭容器中,1.01×105Pa、n起始(CO2):n起始(H2)=1:3,其他条件相同时,反应温度对CO2的转化率和CH3OH的选择性的影响如图1、2所示。其中,CH3OH的选择性可表示为
 ×100%。
×100%。
①图1,温度高于260°C时,CO2的平衡转化率呈上升变化的原因是
②图2,温度相同时CH3OH选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是
(3)用电化学方法还原CO2将其转化为其它化学产品可以实现对CO2的综合利用。图3是在酸性条件下电化学还原CO2的装置。

已知法拉第效率(FE)表示为:FE(B)%=
 。控制pH=1、电解液中存在KCl时,电化学还原CO2过程中CH4(其他含碳产物未标出)和H2的法拉第效率变化如图4所示。
。控制pH=1、电解液中存在KCl时,电化学还原CO2过程中CH4(其他含碳产物未标出)和H2的法拉第效率变化如图4所示。
①写出阴极产生CH4的电极反应
②结合上图的变化规律,推测KCl可能的作用是
③c(KCl)=3mol/L时,22.4L(已折合为标准状况,下同)的CO2被完全吸收并还原为CH4和C2H4,分离H2后,将CH4和C2H4混合气体通入如图5所示装置(反应完全),出口处收集到气体8.96L(不考虑水蒸气),则FE(C2H4)%=

您最近一年使用:0次
解题方法
9 . CxHy、NOx、CO、CO2、SO2及固体颗粒物等会引起光化学烟雾、温室效应等,将污染物资源化是治理污染的一种有效途径。
I.
Ⅱ.
III.
(1)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填标号)。
(2)反应I、Ⅱ、Ⅲ的平衡常数的对数lgK随反应温度T的变化曲线如图所示,曲线②为反应_______ (填“I”或“Ⅱ”或“Ⅲ”);结合各反应的△H,归纳llgK-T曲线变化规律:_______ (任意一条即可)。

(3)某研究小组探究催化剂对CO、NO转化的影响。将CO、NO以一定流速通过两种不同的催化剂进行反应,测定尾气脱氮率(脱氮率即NO转化率),结果如图所示,温度在400~450℃,曲线Ⅱ中脱氮率随温度升高快速增大的主要原因可能是_______ 。

(4)用电化学方法还原CO2将其转化为其它化学产品可以实现对CO2的综合利用。如图是酸性条件下电化学还原CO2的装置示意图:

已知:法拉第效率(FE)的定义: 。控制pH=1、电解液中存在KCl时,电化学还原CO2过程中CH4(其他含碳产物未标出)和H2的法拉第效率变化如图所示。
。控制pH=1、电解液中存在KCl时,电化学还原CO2过程中CH4(其他含碳产物未标出)和H2的法拉第效率变化如图所示。

①写出阴极产生C2H4的电极反应:______
②结合上图的变化规律,推测KCl作用的可能是_______ 。
③c(KCl)=3mol/L时,22.4L(已折合为标准状况,下同)的CO2被完全吸收并还原为CH4和C2H4,分离H2后,将CH4和C2H4混合气体通入如图所示装置(反应完全),出口处收集到气体6.72L(不考虑水蒸气),则FE(C2H4)=_______ 。

I.

Ⅱ.

III.

(1)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填标号)。
| A.增大H2的浓度,反应I、Ⅱ、Ⅲ的正反应速率都增加 |
| B.加入反应I的催化剂,可提高CO的平衡转化率 |
C.反应Ⅱ: |
| D.升高反应温度,反应Ⅲ的正反应速率增大,逆反应速率减小,平衡正向移动 |

(3)某研究小组探究催化剂对CO、NO转化的影响。将CO、NO以一定流速通过两种不同的催化剂进行反应,测定尾气脱氮率(脱氮率即NO转化率),结果如图所示,温度在400~450℃,曲线Ⅱ中脱氮率随温度升高快速增大的主要原因可能是

(4)用电化学方法还原CO2将其转化为其它化学产品可以实现对CO2的综合利用。如图是酸性条件下电化学还原CO2的装置示意图:

已知:法拉第效率(FE)的定义:
 。控制pH=1、电解液中存在KCl时,电化学还原CO2过程中CH4(其他含碳产物未标出)和H2的法拉第效率变化如图所示。
。控制pH=1、电解液中存在KCl时,电化学还原CO2过程中CH4(其他含碳产物未标出)和H2的法拉第效率变化如图所示。
①写出阴极产生C2H4的电极反应:
②结合上图的变化规律,推测KCl作用的可能是
③c(KCl)=3mol/L时,22.4L(已折合为标准状况,下同)的CO2被完全吸收并还原为CH4和C2H4,分离H2后,将CH4和C2H4混合气体通入如图所示装置(反应完全),出口处收集到气体6.72L(不考虑水蒸气),则FE(C2H4)=

您最近一年使用:0次
解题方法
10 . 中国科学家首次实现了二氧化碳到淀粉的从头合成,相关成果北京时间9月24日由国际知名学术期刊《科学》在线发表,因此 的捕集及其资源化利用成为科学家研究的重要课题。
的捕集及其资源化利用成为科学家研究的重要课题。
Ⅰ.二氧化碳合成“合成气”
(1)捕获的高浓度 能与
能与 制备合成气
制备合成气 ,该过程主要涉及以下反应:
,该过程主要涉及以下反应:
①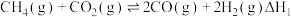
②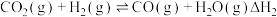
③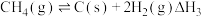
④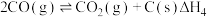
根据盖斯定律,反应①的
___________ (写出代数式即可)。
Ⅱ.二氧化碳合成低碳烯烃
(2)用可再生能源电还原 时,采用高浓度的
时,采用高浓度的 抑制酸性电解液中的析氢反应来提高乙烯的生成率,装置如图所示。阴极发生的反应为:
抑制酸性电解液中的析氢反应来提高乙烯的生成率,装置如图所示。阴极发生的反应为:_______ ;每转移 电子,阳极生成
电子,阳极生成___________  气体(标准状况)
气体(标准状况) 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
A.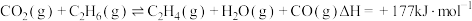 (主反应)
(主反应)
B.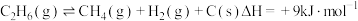 (副反应)
(副反应)
其中,反应 的反应历程可分为如下两步:
的反应历程可分为如下两步:
a.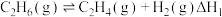 (反应速率较快)
(反应速率较快)
b.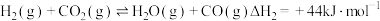 (反应速率较慢)
(反应速率较慢)
密闭容器中充入 和
和 合成
合成 ,发生主反应,温度对催化剂
,发生主反应,温度对催化剂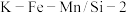 性能的影响如图所示,工业生产综合各方面的因素,反应选择
性能的影响如图所示,工业生产综合各方面的因素,反应选择 的原因是
的原因是_______ 。
主反应:
副反应:
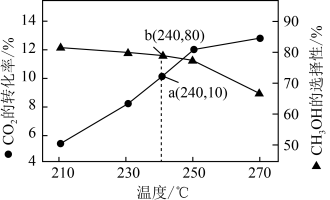
某一刚性容器中充入 和
和 ,在催化剂存在条件下进行反应,测得温度与平衡转化率、产物选择性的关系如图所示。已知:选择性
,在催化剂存在条件下进行反应,测得温度与平衡转化率、产物选择性的关系如图所示。已知:选择性 。
。 平衡时,生成的
平衡时,生成的 的物质的量是
的物质的量是___________ 。
Ⅳ.新型二氧化碳固定法
(5)某课题组设计一种新型的固定 方法,如图所示。若原料用
方法,如图所示。若原料用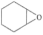 ,则产物为
,则产物为___________ 。
 的捕集及其资源化利用成为科学家研究的重要课题。
的捕集及其资源化利用成为科学家研究的重要课题。Ⅰ.二氧化碳合成“合成气”
(1)捕获的高浓度
 能与
能与 制备合成气
制备合成气 ,该过程主要涉及以下反应:
,该过程主要涉及以下反应:①
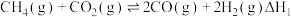
②
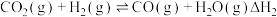
③
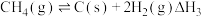
④
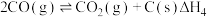
根据盖斯定律,反应①的

Ⅱ.二氧化碳合成低碳烯烃
(2)用可再生能源电还原
 时,采用高浓度的
时,采用高浓度的 抑制酸性电解液中的析氢反应来提高乙烯的生成率,装置如图所示。阴极发生的反应为:
抑制酸性电解液中的析氢反应来提高乙烯的生成率,装置如图所示。阴极发生的反应为: 电子,阳极生成
电子,阳极生成 气体(标准状况)
气体(标准状况)
 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:A.
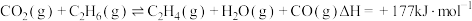 (主反应)
(主反应)B.
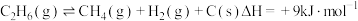 (副反应)
(副反应)其中,反应
 的反应历程可分为如下两步:
的反应历程可分为如下两步:a.
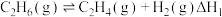 (反应速率较快)
(反应速率较快)b.
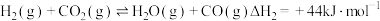 (反应速率较慢)
(反应速率较慢)密闭容器中充入
 和
和 合成
合成 ,发生主反应,温度对催化剂
,发生主反应,温度对催化剂 性能的影响如图所示,工业生产综合各方面的因素,反应选择
性能的影响如图所示,工业生产综合各方面的因素,反应选择 的原因是
的原因是
主反应:

副反应:

某一刚性容器中充入
 和
和 ,在催化剂存在条件下进行反应,测得温度与平衡转化率、产物选择性的关系如图所示。已知:选择性
,在催化剂存在条件下进行反应,测得温度与平衡转化率、产物选择性的关系如图所示。已知:选择性 。
。
 平衡时,生成的
平衡时,生成的 的物质的量是
的物质的量是Ⅳ.新型二氧化碳固定法
(5)某课题组设计一种新型的固定
 方法,如图所示。若原料用
方法,如图所示。若原料用 ,则产物为
,则产物为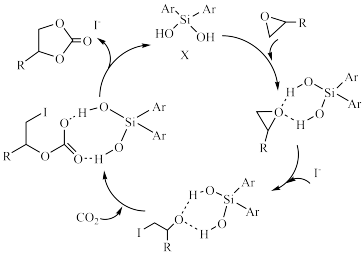
您最近一年使用:0次



