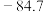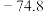名校
解题方法
1 .  和
和 都是重要的能源物质,
都是重要的能源物质, 催化加氢合成甲醇是一种有效利用氢气且减少温室气体
催化加氢合成甲醇是一种有效利用氢气且减少温室气体 排放的方法。
排放的方法。
(1)通过计算机分析,我们可从势能图认识 加氢制甲醇在不同催化条件下存在的两种反应路径,如图所示,下列说法正确的是
加氢制甲醇在不同催化条件下存在的两种反应路径,如图所示,下列说法正确的是___________ 。
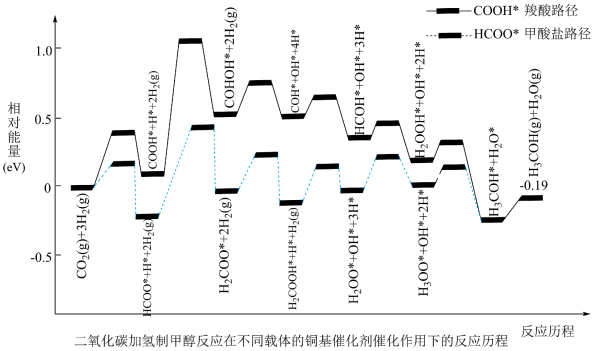
①甲酸盐路径的决速步是
②不考虑 ,两种路径中产生的含碳中间体种类均有6种
,两种路径中产生的含碳中间体种类均有6种
③该反应的活化能
④催化剂相同,使用不同的载体也可改变反应历程
(2) 催化加氢合成甲醇的过程中会发生副反应。
催化加氢合成甲醇的过程中会发生副反应。
副反应I:
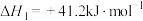
副反应II: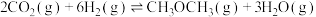

主反应为

 的选择性
的选择性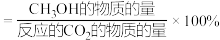
 的转化率
的转化率
①在一定条件下,选择合适的催化剂只进行反应副反应I,控制 和
和 初始投料比为
初始投料比为 时,在不同温度下
时,在不同温度下 ,
, ,
, ,达到平衡后,
,达到平衡后, 的转化率分别为50%、60%、75%,已知反应速率
的转化率分别为50%、60%、75%,已知反应速率 ,
, 、
、 分别为正、逆向反应速率常数,x为物质的量分数。
分别为正、逆向反应速率常数,x为物质的量分数。 最大的是温度
最大的是温度_________ (填“ ”、“
”、“ ”或“
”或“ ”,下同),
”,下同),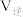 最大的是温度
最大的是温度________ 。
②控制 和
和 初始投料比为
初始投料比为 时,温度对
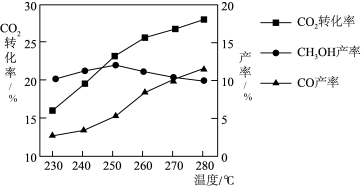
时,温度对 平衡转化率及甲醇和CO的产率的影响如图所示,则在250℃以上,升高温度
平衡转化率及甲醇和CO的产率的影响如图所示,则在250℃以上,升高温度 的转化率增大,但甲醇的产率降低,原因是
的转化率增大,但甲醇的产率降低,原因是___________ 。为增大 的产率,可采用的方法是
的产率,可采用的方法是___________ (填一项即可)。
③一定条件下,在固定容积的容器中通入1mol 和3mol
和3mol 发生上述反应,初始压强为p,达到平衡时,容器中
发生上述反应,初始压强为p,达到平衡时,容器中 的物质的量为0.4mol,
的物质的量为0.4mol, 物质的量为0.1mol,
物质的量为0.1mol, 的转化率为70%,则
的转化率为70%,则 的选择性为
的选择性为___________ 。主反应的平衡常数 的计算表达式为
的计算表达式为___________ (用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
 和
和 都是重要的能源物质,
都是重要的能源物质, 催化加氢合成甲醇是一种有效利用氢气且减少温室气体
催化加氢合成甲醇是一种有效利用氢气且减少温室气体 排放的方法。
排放的方法。(1)通过计算机分析,我们可从势能图认识
 加氢制甲醇在不同催化条件下存在的两种反应路径,如图所示,下列说法正确的是
加氢制甲醇在不同催化条件下存在的两种反应路径,如图所示,下列说法正确的是
①甲酸盐路径的决速步是

②不考虑
 ,两种路径中产生的含碳中间体种类均有6种
,两种路径中产生的含碳中间体种类均有6种③该反应的活化能

④催化剂相同,使用不同的载体也可改变反应历程
(2)
 催化加氢合成甲醇的过程中会发生副反应。
催化加氢合成甲醇的过程中会发生副反应。副反应I:

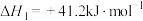
副反应II:
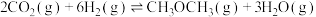

主反应为


 的选择性
的选择性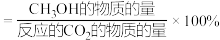
 的转化率
的转化率
①在一定条件下,选择合适的催化剂只进行反应副反应I,控制
 和
和 初始投料比为
初始投料比为 时,在不同温度下
时,在不同温度下 ,
, ,
, ,达到平衡后,
,达到平衡后, 的转化率分别为50%、60%、75%,已知反应速率
的转化率分别为50%、60%、75%,已知反应速率 ,
, 、
、 分别为正、逆向反应速率常数,x为物质的量分数。
分别为正、逆向反应速率常数,x为物质的量分数。 最大的是温度
最大的是温度 ”、“
”、“ ”或“
”或“ ”,下同),
”,下同),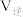 最大的是温度
最大的是温度②控制
 和
和 初始投料比为
初始投料比为 时,温度对
时,温度对 平衡转化率及甲醇和CO的产率的影响如图所示,则在250℃以上,升高温度
平衡转化率及甲醇和CO的产率的影响如图所示,则在250℃以上,升高温度 的转化率增大,但甲醇的产率降低,原因是
的转化率增大,但甲醇的产率降低,原因是 的产率,可采用的方法是
的产率,可采用的方法是
③一定条件下,在固定容积的容器中通入1mol
 和3mol
和3mol 发生上述反应,初始压强为p,达到平衡时,容器中
发生上述反应,初始压强为p,达到平衡时,容器中 的物质的量为0.4mol,
的物质的量为0.4mol, 物质的量为0.1mol,
物质的量为0.1mol, 的转化率为70%,则
的转化率为70%,则 的选择性为
的选择性为 的计算表达式为
的计算表达式为
您最近一年使用:0次
2024-03-09更新
|
368次组卷
|
2卷引用:福建省厦门第一中学2023-2024学年高三下学期2月第一次月考化学试卷
名校
解题方法
2 . Mn3O4可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。软锰矿主要成分是MnO2,还含有少量的Fe2O3、SiO2、Al2O3,采用以下工艺流程可由软锰矿制得Mn3O4。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“酸浸、还原”时,为了加快化学反应速率,可以采取的措施有_______ (只需填一种),“酸浸、还原”后溶液中含有的金属阳离子主要有_______ ,铁屑与MnO2发生反应的离子方程式为________ 。
(2)“调节pH”时加入H2O2溶液的目的是_________ ,“调节pH”的范围为______ 。
(3)“沉锰”时,其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如图所示。

①50℃后,溶液温度越高,锰离子的沉淀率越低的原因是_______ 。
②配制氨水时,要用脱氧蒸馏水,原因是________ 。
(4)“氧化”时一般控制温度在80℃~85℃,可以采取的加热方法是_______ ,反应化学方程式为_______ 。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
(1)“酸浸、还原”时,为了加快化学反应速率,可以采取的措施有
(2)“调节pH”时加入H2O2溶液的目的是
(3)“沉锰”时,其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如图所示。

①50℃后,溶液温度越高,锰离子的沉淀率越低的原因是
②配制氨水时,要用脱氧蒸馏水,原因是
(4)“氧化”时一般控制温度在80℃~85℃,可以采取的加热方法是
您最近一年使用:0次
名校
解题方法
3 . 氢能是一种极具发展潜力的清洁能源,目前有以下制取氢气的方法:
(1)水煤气变换制氢: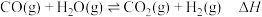
已知: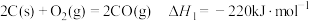
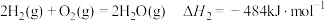
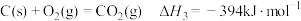
水煤气变换制氢体系中,一定时间内, 的添加情况与
的添加情况与 的体积分数关系如图。
的体积分数关系如图。
①水煤气变换制氢反应的
___________  。
。
②添加 后
后 的体积分数增大的原因是
的体积分数增大的原因是___________ (用化学方程式表达)。
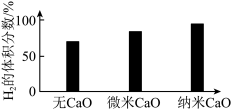
③对比纳米 和微
和微 ,前者
,前者 的体积分数更大的原因是
的体积分数更大的原因是___________ 。
(2)甲醇水蒸气重整制氢: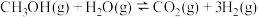 。控制原料气
。控制原料气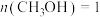 ,体系中甲醇的平衡转化率与温度和压强的关系如图。
,体系中甲醇的平衡转化率与温度和压强的关系如图。
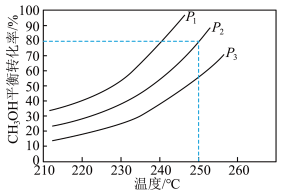
①甲醇水蒸气重整制氢反应在___________ 条件(填“高温”“低温”或“任意温度”)下能自发进行。
②图中的压强由小到大的顺序是___________ ,理由是___________ 。
③温度为250℃、压强为P2时,该反应的压力平衡常数Kp=___________ (列出算式)。
(3)乙醇重整制氢两条途径的机理如下图,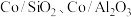 和
和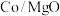 催化剂(酸性
催化剂(酸性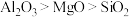 )在反应中表现出良好的催化活性和氢气选择性,但经长期反应后,催化剂表面均发现了积碳,积碳量
)在反应中表现出良好的催化活性和氢气选择性,但经长期反应后,催化剂表面均发现了积碳,积碳量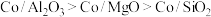 ,试分析
,试分析 表面的积碳量最大的原因
表面的积碳量最大的原因___________ 。
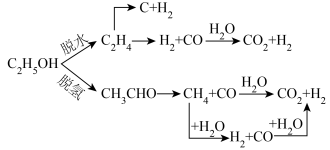
(1)水煤气变换制氢:
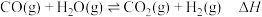
已知:
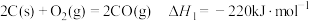
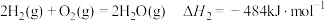
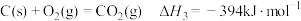
水煤气变换制氢体系中,一定时间内,
 的添加情况与
的添加情况与 的体积分数关系如图。
的体积分数关系如图。
①水煤气变换制氢反应的

 。
。②添加
 后
后 的体积分数增大的原因是
的体积分数增大的原因是③对比纳米
 和微
和微 ,前者
,前者 的体积分数更大的原因是
的体积分数更大的原因是(2)甲醇水蒸气重整制氢:
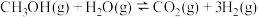 。控制原料气
。控制原料气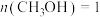 ,体系中甲醇的平衡转化率与温度和压强的关系如图。
,体系中甲醇的平衡转化率与温度和压强的关系如图。
①甲醇水蒸气重整制氢反应在
②图中的压强由小到大的顺序是
③温度为250℃、压强为P2时,该反应的压力平衡常数Kp=
(3)乙醇重整制氢两条途径的机理如下图,
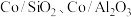 和
和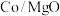 催化剂(酸性
催化剂(酸性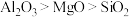 )在反应中表现出良好的催化活性和氢气选择性,但经长期反应后,催化剂表面均发现了积碳,积碳量
)在反应中表现出良好的催化活性和氢气选择性,但经长期反应后,催化剂表面均发现了积碳,积碳量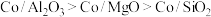 ,试分析
,试分析 表面的积碳量最大的原因
表面的积碳量最大的原因
您最近一年使用:0次
2024-01-13更新
|
336次组卷
|
2卷引用:福建省厦门双十中学2023-2024学年高三上学期12月月考化学试题
名校
4 . 甲醚是重要的有机合成原料,甲醇制备甲醚的反应: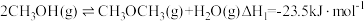 ;工业上常用CO2或CO催化氢化法合成CH3OH。回答下列问题:
;工业上常用CO2或CO催化氢化法合成CH3OH。回答下列问题:
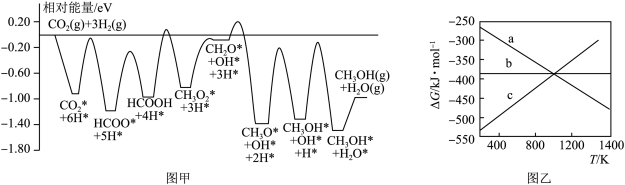
(1)CO2和H2在某催化剂表面合成CH3OH: ,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为
,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为___________ 。已知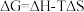 (△H、△S随温度的变化不大),随温度的变化关系如图乙所示,图中表示该反应的直线是
(△H、△S随温度的变化不大),随温度的变化关系如图乙所示,图中表示该反应的直线是___________ (填代号)。
(2)CO催化加氢法合成CH3OH,进而制备CH3OCH3的过程中涉及如下反应:
反应I: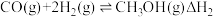
反应II: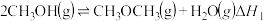
反应III: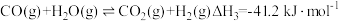
①在298K,101kPa时,CO(g)、H2(g)、CH3OH(g)的摩尔燃烧焓如下表:
则△H2=___________ 。
②一定温度下,向2L恒容密闭容器中充入2molCO(g)和4molH2(g)制备,初始压强为p0Pa,5min达到平衡时CO(g)的转化率为70%,c(CH3OH)=2c(CH3OCH3),且c(H2)=0.9mol⋅L-1.则0~5min内,v(CO)=___________ mol。L-1.min-1;反应I的平衡常数Kp=___________ (用p0表示);平衡后,保持温度和容器体积不变,向容器中再充入1molCO(g)和2molH2(g),重新达到平衡后,CH3OCH3(g)的物质的量分数___________ (填“增大”、“减小”或“不变”)。
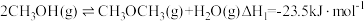 ;工业上常用CO2或CO催化氢化法合成CH3OH。回答下列问题:
;工业上常用CO2或CO催化氢化法合成CH3OH。回答下列问题:(1)CO2和H2在某催化剂表面合成CH3OH:
 ,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为
,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为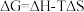 (△H、△S随温度的变化不大),随温度的变化关系如图乙所示,图中表示该反应的直线是
(△H、△S随温度的变化不大),随温度的变化关系如图乙所示,图中表示该反应的直线是
(2)CO催化加氢法合成CH3OH,进而制备CH3OCH3的过程中涉及如下反应:
反应I:
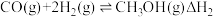
反应II:
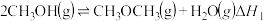
反应III:
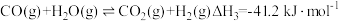
①在298K,101kPa时,CO(g)、H2(g)、CH3OH(g)的摩尔燃烧焓如下表:
| 物质 | CO(g) | H2(g) | CH3OH(g) |
| 摩尔燃烧焓(△H)/(kJ·mol-1) | -283.0 | -285.8 | -726.5 |
②一定温度下,向2L恒容密闭容器中充入2molCO(g)和4molH2(g)制备,初始压强为p0Pa,5min达到平衡时CO(g)的转化率为70%,c(CH3OH)=2c(CH3OCH3),且c(H2)=0.9mol⋅L-1.则0~5min内,v(CO)=
您最近一年使用:0次
名校
解题方法
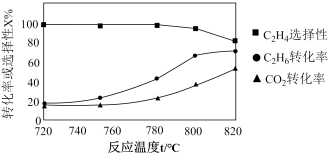
5 . 低碳烷烃脱氢制低碳烯烃对有效利用化石能源有重要意义。
(1)乙烷脱氢制乙烯
主反应:

副反应:



①标准摩尔生成焓是指在25℃和101kPa,由最稳定的单质生成1mol化合物的焓变。利用下表数据计算
______ 。
②恒容条件下,有利于提高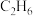 平衡转化率的措施是
平衡转化率的措施是______ (填标号)。
A.高温 B.高压 C.原料气中掺入 D原料气中掺入
D原料气中掺入
③在800℃、恒容条件下加入1mol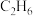 ,此时压强为100kPa,进行脱氢反应,若测得平衡体系中气体有0.3mol
,此时压强为100kPa,进行脱氢反应,若测得平衡体系中气体有0.3mol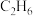 、0.6mol
、0.6mol 、0.1mol
、0.1mol 和0.7mol
和0.7mol ,则主反应
,则主反应
______ 。
(2)乙烷裂解中各基元反应及对应活化能如下表。根据表格数据判断:
①链引发过程中,更容易断裂的化学键是______ 。
②链传递的主要途径为反应______ →反应______ (填序号),造成产物甲烷含量不高。
(3)使用 进行乙烷脱氢催化性能研究。不同温度下,乙烷转化率及乙烯选择性随反应时间的变化曲线分别如图a、图b。
进行乙烷脱氢催化性能研究。不同温度下,乙烷转化率及乙烯选择性随反应时间的变化曲线分别如图a、图b。

①550~620℃,在反应初始阶段,温度越高,乙烷转化率越大的原因是__________________ 。
②该催化剂的最佳工作温度为______ 。
(1)乙烷脱氢制乙烯
主反应:


副反应:




①标准摩尔生成焓是指在25℃和101kPa,由最稳定的单质生成1mol化合物的焓变。利用下表数据计算

物质 |
|
|
|
标准摩尔主成焓/ |
| +52.3 |
|
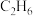 平衡转化率的措施是
平衡转化率的措施是A.高温 B.高压 C.原料气中掺入
 D原料气中掺入
D原料气中掺入
③在800℃、恒容条件下加入1mol
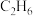 ,此时压强为100kPa,进行脱氢反应,若测得平衡体系中气体有0.3mol
,此时压强为100kPa,进行脱氢反应,若测得平衡体系中气体有0.3mol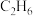 、0.6mol
、0.6mol 、0.1mol
、0.1mol 和0.7mol
和0.7mol ,则主反应
,则主反应
(2)乙烷裂解中各基元反应及对应活化能如下表。根据表格数据判断:
反应类型 | 反应 | 活化能 |
链引发 | ⅰ | 451 |
ⅱ | 417 | |
链传递 | ⅲ | 47 |
ⅳ | 54 | |
ⅴ | 181 | |
链终止 | ⅵ | 0 |
ⅶ | 0 |
②链传递的主要途径为反应
(3)使用
 进行乙烷脱氢催化性能研究。不同温度下,乙烷转化率及乙烯选择性随反应时间的变化曲线分别如图a、图b。
进行乙烷脱氢催化性能研究。不同温度下,乙烷转化率及乙烯选择性随反应时间的变化曲线分别如图a、图b。
①550~620℃,在反应初始阶段,温度越高,乙烷转化率越大的原因是
②该催化剂的最佳工作温度为
您最近一年使用:0次
名校
6 . 温室气体让地球发烧,倡导低碳生活,是一种可持续发展的环保责任,将 应用于生产中实现其综合利用是目前的研究热点。
应用于生产中实现其综合利用是目前的研究热点。
(1)在催化作用下由 和
和 转化为
转化为 的反应历程示意图如下图。
的反应历程示意图如下图。

在合成 的反应历程中,下列有关说法正确的是
的反应历程中,下列有关说法正确的是___________ (填字母)。
a.该催化剂使反应的平衡常数增大
b. 过程中,有
过程中,有 键断裂和
键断裂和 键形成
键形成
c.生成乙酸的反应原子利用率等于100%
d.
(2)以 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
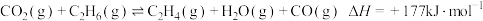 (主反应)
(主反应)
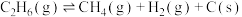
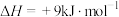 (副反应)
(副反应)
①主反应的反应历程可分为如下两步,反应过程中能量变化如图所示:

i.

ii.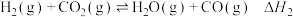

___________ ,主反应的决速步骤为___________ (填“反应i”或“反应ii”)。
②向恒压密闭容器中充入 和
和 ,温度对催化剂K—Fe—Mn/Si—2性能的影响如图所示,工业生产中主反应应选择的温度是
,温度对催化剂K—Fe—Mn/Si—2性能的影响如图所示,工业生产中主反应应选择的温度是___________ 。
 应用于生产中实现其综合利用是目前的研究热点。
应用于生产中实现其综合利用是目前的研究热点。(1)在催化作用下由
 和
和 转化为
转化为 的反应历程示意图如下图。
的反应历程示意图如下图。
在合成
 的反应历程中,下列有关说法正确的是
的反应历程中,下列有关说法正确的是a.该催化剂使反应的平衡常数增大
b.
 过程中,有
过程中,有 键断裂和
键断裂和 键形成
键形成c.生成乙酸的反应原子利用率等于100%
d.

(2)以
 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下: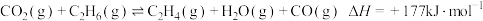 (主反应)
(主反应)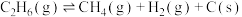
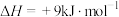 (副反应)
(副反应)①主反应的反应历程可分为如下两步,反应过程中能量变化如图所示:

i.


ii.
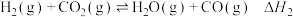

②向恒压密闭容器中充入
 和
和 ,温度对催化剂K—Fe—Mn/Si—2性能的影响如图所示,工业生产中主反应应选择的温度是
,温度对催化剂K—Fe—Mn/Si—2性能的影响如图所示,工业生产中主反应应选择的温度是
您最近一年使用:0次
名校
解题方法
7 . 乙烯产量是衡量一个国家石油化工发展水平的重要标志,羟基氮化硼可高效催化乙烷氧化脱氢制乙烯。
主反应: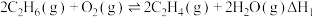
副反应: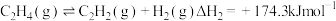
(1) 的燃烧热
的燃烧热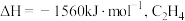 的燃烧热
的燃烧热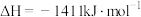 ,
,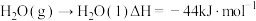 ,则
,则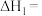
___________ 。
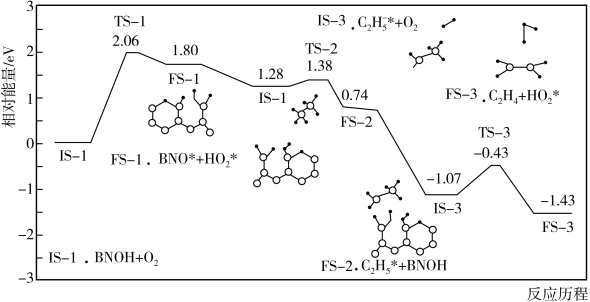
(2)主反应的部分反应历程如下图所示(图中IS表示起始态,TS表示过渡态,FS表示终态)。这一部分反应中慢反应的活化能
___________  。
。
(3)提高乙烯平衡产率的方法是___________ (任写两条),提高乙烯单位时间产量的关键因素是___________ 。
(4)工业上催化氧化制乙烯时,通常在乙烷和氧气的混合气体中掺入惰性气体,即将一定比例的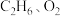 和
和 混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如下图所示。
混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如下图所示。
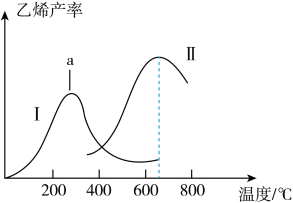
①曲线1中,a点右侧乙烯产量随温度升高而降低的原因是___________ 。
②两种催化剂比较,催化剂Ⅱ的优点与不足是___________ 。
(5)一定温度下,维持压强始终为p,向反应装置中通入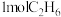 、
、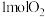 和
和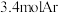 的混合气体,经过
的混合气体,经过 后,反应达到平衡,此时乙烷的转化率为
后,反应达到平衡,此时乙烷的转化率为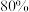 ,乙烯选择性为
,乙烯选择性为 ,(乙烯选择性
,(乙烯选择性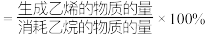 )。
)。
①反应速率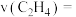
___________ 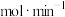 。
。
②已知:气体分压 气体总压
气体总压 气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数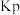 ,则主反应在该温度下的
,则主反应在该温度下的
___________ (列出计算式即可,不必化简)。
主反应:
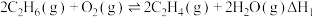
副反应:
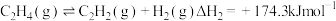
(1)
 的燃烧热
的燃烧热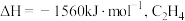 的燃烧热
的燃烧热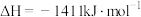 ,
,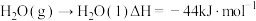 ,则
,则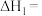
(2)主反应的部分反应历程如下图所示(图中IS表示起始态,TS表示过渡态,FS表示终态)。这一部分反应中慢反应的活化能

 。
。
(3)提高乙烯平衡产率的方法是
(4)工业上催化氧化制乙烯时,通常在乙烷和氧气的混合气体中掺入惰性气体,即将一定比例的
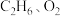 和
和 混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如下图所示。
混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如下图所示。
①曲线1中,a点右侧乙烯产量随温度升高而降低的原因是
②两种催化剂比较,催化剂Ⅱ的优点与不足是
(5)一定温度下,维持压强始终为p,向反应装置中通入
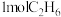 、
、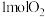 和
和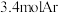 的混合气体,经过
的混合气体,经过 后,反应达到平衡,此时乙烷的转化率为
后,反应达到平衡,此时乙烷的转化率为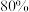 ,乙烯选择性为
,乙烯选择性为 ,(乙烯选择性
,(乙烯选择性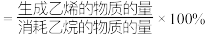 )。
)。①反应速率
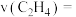
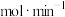 。
。②已知:气体分压
 气体总压
气体总压 气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数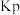 ,则主反应在该温度下的
,则主反应在该温度下的
您最近一年使用:0次
名校
8 . 利用CO2和 H2可制得甲烷,实现资源综合利用。
已知:I. 2
2 2
2 2
2 1
1 -1
-1
II. CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-165.0 kJ·mol-1
在一定的温度和压力下,将按一定比例混合的CO2和H2混合气体通过装有催化剂的反应器, 反应相同时间, CO2转化率和 CH4选择性随温度变化关系如图所示。
CH4选择性=
已知:I.
 2
2 2
2 2
2 1
1 -1
-1II. CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-165.0 kJ·mol-1
在一定的温度和压力下,将按一定比例混合的CO2和H2混合气体通过装有催化剂的反应器, 反应相同时间, CO2转化率和 CH4选择性随温度变化关系如图所示。
CH4选择性=


| A.反应Ⅱ:2E(C=O)+4E(H-H)<4E(C-H)+4E(H-O)(E表示键能) |
| B.240℃时,其他条件不变,增大压强能提高CO2的转化率 |
| C.在260~300℃间, 其他条件不变, 升高温度 CH4的产率增大 |
| D.320℃时CO2的转化率最大,说明反应I和反应II一定都达到了平衡状态 |
您最近一年使用:0次
2023-12-06更新
|
577次组卷
|
3卷引用:福建省福州市八县市一中2024届高三下学期模拟联考化学试题
9 . 探究甲醇对丙烷制丙烯的影响。丙烷制烯烃过程主要发生的反应有
ⅰ.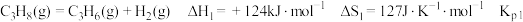
ⅱ.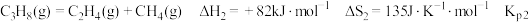
ⅲ.
已知: 为用气体分压表示的平衡常数,分压=物质的量分数×总压。在
为用气体分压表示的平衡常数,分压=物质的量分数×总压。在 下,丙烷单独进料时,平衡体系中各组分的体积分数
下,丙烷单独进料时,平衡体系中各组分的体积分数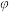 见下表。
见下表。
(1)比较反应自发进行(∆G=∆H-T∆S<0)的最低温度,反应 ⅰ_____ 反应 ⅱ(填“>”或“<”)。
(2)①在该温度下,Kp2远大于 Kp1,但φ(C3H6)和φ(C2H4)相差不大,说明反应 ⅲ 的正向进行有利于反应 ⅰ 的__________ 反应和反应 ⅱ 的_________ 反应(填“正向”或“逆向”)。
②从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为:__________ 。
③平衡体系中检测不到 ,可认为存在反应:
,可认为存在反应: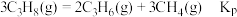 ,下列相关说法正确的是
,下列相关说法正确的是_______ (填标号)。
a.
b.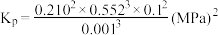
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
④由表中数据推算:丙烯选择性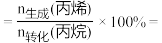
_______ (列出计算式)。
(3)丙烷甲醇共进料时,还发生反应:
ⅳ.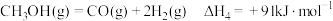
在 下,平衡体系中各组分体积分数与进料比的关系如图所示。
下,平衡体系中各组分体积分数与进料比的关系如图所示。
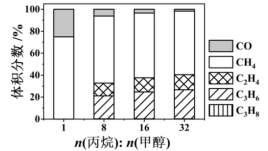
①进料比n(丙烷) (甲醇)
(甲醇) 时,体系总反应:
时,体系总反应:
_______ 
②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是_______ 。
ⅰ.
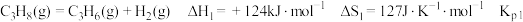
ⅱ.
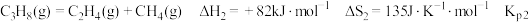
ⅲ.

已知:
 为用气体分压表示的平衡常数,分压=物质的量分数×总压。在
为用气体分压表示的平衡常数,分压=物质的量分数×总压。在 下,丙烷单独进料时,平衡体系中各组分的体积分数
下,丙烷单独进料时,平衡体系中各组分的体积分数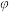 见下表。
见下表。| 物质 | 丙烯 | 乙烯 | 甲烷 | 丙烷 | 氢气 |
| 体积分数(%) | 21 | 23.7 | 55.2 | 0.1 | 0 |
(2)①在该温度下,Kp2远大于 Kp1,但φ(C3H6)和φ(C2H4)相差不大,说明反应 ⅲ 的正向进行有利于反应 ⅰ 的
②从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为:
③平衡体系中检测不到
 ,可认为存在反应:
,可认为存在反应: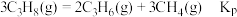 ,下列相关说法正确的是
,下列相关说法正确的是a.

b.
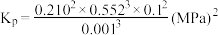
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
④由表中数据推算:丙烯选择性
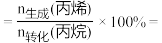
(3)丙烷甲醇共进料时,还发生反应:
ⅳ.
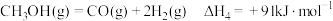
在
 下,平衡体系中各组分体积分数与进料比的关系如图所示。
下,平衡体系中各组分体积分数与进料比的关系如图所示。
①进料比n(丙烷)
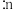 (甲醇)
(甲醇) 时,体系总反应:
时,体系总反应: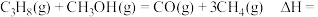

②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是
您最近一年使用:0次
名校
解题方法
10 . 汽车尾气中氮氧化合物、碳氧化合物的处理会污染环境。
(1)①已知:6g碳完全被氧气氧化放出197kJ的热量,则该反应的热化学方程式可表示为:___________ 。
②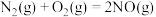

则反应

___________ 。
(2)运用电化学方法可以进行NO的消除和CO含量检测。
①用电化学气敏传感器测定汽车尾气中CO含量,原理如图所示。A电极为___________ 极,电极反应式为___________ 。当O2消耗1.12L(标准状况下),电路中理论上过的电子数目为___________ 。

②间接电解法除NO。其原理如图所示,从A中出来的气体是___________ ,电解池阴极的电极反应式___________ 。用离子方程式表示吸收柱中除去NO的原理___________ 。
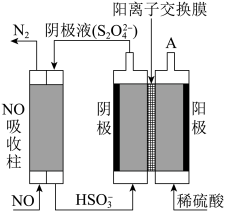
(1)①已知:6g碳完全被氧气氧化放出197kJ的热量,则该反应的热化学方程式可表示为:
②
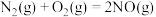
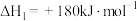

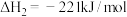
则反应


(2)运用电化学方法可以进行NO的消除和CO含量检测。
①用电化学气敏传感器测定汽车尾气中CO含量,原理如图所示。A电极为

②间接电解法除NO。其原理如图所示,从A中出来的气体是

您最近一年使用:0次