1 . 氮氧化物(NOx)、CO2和SO2等气体会造成环境问题。对燃煤废气进行化学方法处理,可实现绿色环保、节能减排、废物利用等目的。
(1)利用甲烷催化还原NOx。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-572kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ•mol-1
则甲烷将NO2还原为N2并生成气态水时的热化学方程式为___ 。
(2)利用CO2生成甲醇燃料。
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1,将6molCO2和8molH2充入容积为2L的密闭容器中,恒温下,H2的物质的量随时间的变化曲线如图1实线所示,则:
CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1,将6molCO2和8molH2充入容积为2L的密闭容器中,恒温下,H2的物质的量随时间的变化曲线如图1实线所示,则:
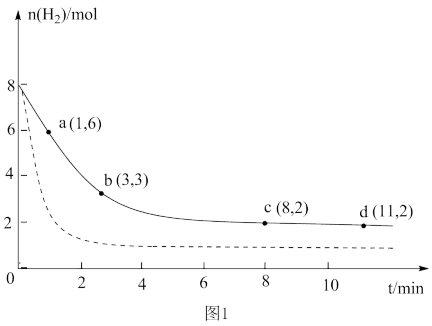
①该反应在0~8min内CO2的平均反应速率为___ 。
②仅改变某一条件再进行实验,测得H2的物质的量随时间的变化曲线如图1虚线所示。与实线相比,虚线改变的条件可能是___ 。
(3)工业上利用CO与H2反应合成甲醇。
已知:CO(g)+2H2(g) CH3OH(g) △H=-129.0kJ•mol-1,在一恒容密闭容器中,按照nmolCO和2nmolH2投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示,则下列说法正确的是
CH3OH(g) △H=-129.0kJ•mol-1,在一恒容密闭容器中,按照nmolCO和2nmolH2投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示,则下列说法正确的是___ (填字母)。

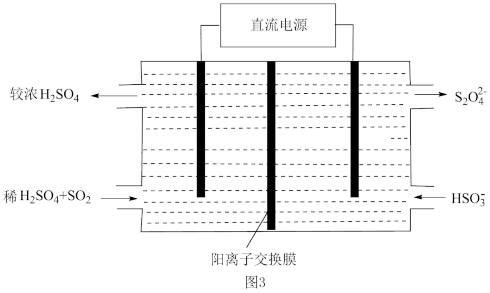
(4)利用如图3所示装置(电极均为惰性电极)可吸收SO2,阳极的电极反应式为___ 。
(5)常温下,Ksp(BaCO3)=2.5×10-9,Ksp(BaSO4)=1.0×1010,控制条件可实现如下沉淀转换:BaSO4(s)+CO (aq)
(aq) BaCO3(s)+SO
BaCO3(s)+SO (aq)。欲用1LNa2CO3溶液将0.01molBaSO4全部转化为BaCO3,此时溶液中c(CO
(aq)。欲用1LNa2CO3溶液将0.01molBaSO4全部转化为BaCO3,此时溶液中c(CO )为
)为___ 。
(1)利用甲烷催化还原NOx。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-572kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ•mol-1
则甲烷将NO2还原为N2并生成气态水时的热化学方程式为
(2)利用CO2生成甲醇燃料。
已知:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1,将6molCO2和8molH2充入容积为2L的密闭容器中,恒温下,H2的物质的量随时间的变化曲线如图1实线所示,则:
CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1,将6molCO2和8molH2充入容积为2L的密闭容器中,恒温下,H2的物质的量随时间的变化曲线如图1实线所示,则:
①该反应在0~8min内CO2的平均反应速率为
②仅改变某一条件再进行实验,测得H2的物质的量随时间的变化曲线如图1虚线所示。与实线相比,虚线改变的条件可能是
(3)工业上利用CO与H2反应合成甲醇。
已知:CO(g)+2H2(g)
 CH3OH(g) △H=-129.0kJ•mol-1,在一恒容密闭容器中,按照nmolCO和2nmolH2投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示,则下列说法正确的是
CH3OH(g) △H=-129.0kJ•mol-1,在一恒容密闭容器中,按照nmolCO和2nmolH2投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示,则下列说法正确的是
| A.温度:T1<T2<T3 |
| B.正反应速率:v(a)>v(c)、v(b)>v(d) |
| C.平衡常数:K(a)<K(c)、K(b)=K(d) |
| D.平均摩尔质量:M(a)>M(c)、M(b)>M(d) |

(5)常温下,Ksp(BaCO3)=2.5×10-9,Ksp(BaSO4)=1.0×1010,控制条件可实现如下沉淀转换:BaSO4(s)+CO
 (aq)
(aq) BaCO3(s)+SO
BaCO3(s)+SO (aq)。欲用1LNa2CO3溶液将0.01molBaSO4全部转化为BaCO3,此时溶液中c(CO
(aq)。欲用1LNa2CO3溶液将0.01molBaSO4全部转化为BaCO3,此时溶液中c(CO )为
)为
您最近一年使用:0次
2022-01-08更新
|
151次组卷
|
2卷引用:西藏林芝市第一中学2020-2021学年高三上学期第四次月考化学试题
名校
2 . 氮的化合物种类繁多,性质也各不相同。请回答下列问题:
(1)已知:
①SO3(g)+NO(g)=NO2(g)+SO2(g) ∆H1=+41.8kJ·mol-1
②2SO2(g)+O2(g)=2SO3(g) ∆H2=-196.6kJ·mol-1
则2NO2(g)=2NO(g)+O2(g)的∆H=_______ 。
(2)NO作为主要空气污染物,其主要来源是汽车尾气,研究人员用活性炭对汽车尾气中的NO进行吸附,并发生反应:C(s)+2NO(g)⇌N2(g)+CO2(g) ∆H<0.在恒压密闭容器中加入足量活性炭和一定量NO气体,反应相同时间时,测得NO的转化率α(NO)随温度的变化如图所示:
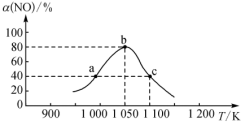
图中a、b、c三点中,达到平衡的点是_______ ;温度为1100K时,N2的平衡体积分数为_______ 。
(3)现代技术用氨气将汽车尾气中的NOx还原为N2和H2O,反应原理是NO(g)+NO2(g)+2NH3(g) 3H2O(g)+2N2(g) ∆H<0。
3H2O(g)+2N2(g) ∆H<0。
①实际生产中NO(g)+NO2(g)+2NH3(g) 3H2O(g)+2N2(g)的反应温度不宜过高的原因是
3H2O(g)+2N2(g)的反应温度不宜过高的原因是_______ 。
②500℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3,8min时反应达到平衡,此时NH3的转化率为40%,体系压强为p0MPa,则0~8min内用N2表示的平均反应速率v(N2)=_______ mol·L-1·min-1,500℃时该反应的平衡常数Kp=_______ MPa(用含p0的代数式表示,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
(1)已知:
①SO3(g)+NO(g)=NO2(g)+SO2(g) ∆H1=+41.8kJ·mol-1
②2SO2(g)+O2(g)=2SO3(g) ∆H2=-196.6kJ·mol-1
则2NO2(g)=2NO(g)+O2(g)的∆H=
(2)NO作为主要空气污染物,其主要来源是汽车尾气,研究人员用活性炭对汽车尾气中的NO进行吸附,并发生反应:C(s)+2NO(g)⇌N2(g)+CO2(g) ∆H<0.在恒压密闭容器中加入足量活性炭和一定量NO气体,反应相同时间时,测得NO的转化率α(NO)随温度的变化如图所示:

图中a、b、c三点中,达到平衡的点是
(3)现代技术用氨气将汽车尾气中的NOx还原为N2和H2O,反应原理是NO(g)+NO2(g)+2NH3(g)
 3H2O(g)+2N2(g) ∆H<0。
3H2O(g)+2N2(g) ∆H<0。①实际生产中NO(g)+NO2(g)+2NH3(g)
 3H2O(g)+2N2(g)的反应温度不宜过高的原因是
3H2O(g)+2N2(g)的反应温度不宜过高的原因是②500℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3,8min时反应达到平衡,此时NH3的转化率为40%,体系压强为p0MPa,则0~8min内用N2表示的平均反应速率v(N2)=
您最近一年使用:0次
2021-07-13更新
|
3542次组卷
|
8卷引用:西藏拉萨中学2022届高三第七次月考理综化学试题
名校
解题方法
3 . 二氧化钛(TiO2)是一种重要的工业原料,可用四氯化钛(TiCl4)制备。已知:
Ⅰ.TiCl4(g)+O2(g) TiO2(s)+2Cl2(g) ΔH1=-178.4 kJ•mol-1
TiO2(s)+2Cl2(g) ΔH1=-178.4 kJ•mol-1
Ⅱ.2C(s)+O2(g) 2CO(g) ΔH2=-219.9 kJ•mol -1
2CO(g) ΔH2=-219.9 kJ•mol -1
请回答下列问题:
(1)TiCl4(g)与CO(g)反应生成 TiO2(s)、C(s)和氯气的热化学方程式为___________ 。
(2)若反应Ⅰ的逆反应活化能表示为 E kJ•mol -1,则 E___________ 178.4(填“>”“<”或 “=”)。
(3)t℃时,向10 L恒容密闭容器中充入1 mol TiCl4和2 mol O2,发生反应Ⅰ.4 min 达到平衡时测得 TiO2 的物质的量为 0.2 mol。
①0~4 min 内,用 Cl2 表示的反应速率 v(Cl2)=___________ 。
②TiCl4的平衡转化率 α=___________ 。
③下列措施,既能加快反应速率又能增大TiCl4平衡转化率的是___________ (填选项字母)。
A.缩小容器容积 B.加入催化剂 C.分离出部分TiO2 D.增大 O2 浓度 E.降低温度
④ t℃时,向10 L恒容密闭容器中充入4 mol TiCl4和一定量O2的混合气体,发生反应Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比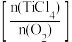 的关系如图所示:
的关系如图所示:
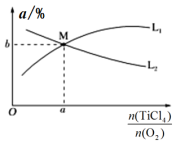
能表示TiCl4平衡转化率的曲线为___________ (填“L1”或 “L2”);M 点的坐标为___________ 。
(4)也可以利用四氯化钛(TiCl4)水解制备TiO2,该反应的方程式为:___________ 。
Ⅰ.TiCl4(g)+O2(g)
 TiO2(s)+2Cl2(g) ΔH1=-178.4 kJ•mol-1
TiO2(s)+2Cl2(g) ΔH1=-178.4 kJ•mol-1Ⅱ.2C(s)+O2(g)
 2CO(g) ΔH2=-219.9 kJ•mol -1
2CO(g) ΔH2=-219.9 kJ•mol -1请回答下列问题:
(1)TiCl4(g)与CO(g)反应生成 TiO2(s)、C(s)和氯气的热化学方程式为
(2)若反应Ⅰ的逆反应活化能表示为 E kJ•mol -1,则 E
(3)t℃时,向10 L恒容密闭容器中充入1 mol TiCl4和2 mol O2,发生反应Ⅰ.4 min 达到平衡时测得 TiO2 的物质的量为 0.2 mol。
①0~4 min 内,用 Cl2 表示的反应速率 v(Cl2)=
②TiCl4的平衡转化率 α=
③下列措施,既能加快反应速率又能增大TiCl4平衡转化率的是
A.缩小容器容积 B.加入催化剂 C.分离出部分TiO2 D.增大 O2 浓度 E.降低温度
④ t℃时,向10 L恒容密闭容器中充入4 mol TiCl4和一定量O2的混合气体,发生反应Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比
 的关系如图所示:
的关系如图所示:
能表示TiCl4平衡转化率的曲线为
(4)也可以利用四氯化钛(TiCl4)水解制备TiO2,该反应的方程式为:
您最近一年使用:0次
2021-02-03更新
|
1190次组卷
|
2卷引用:西藏自治区拉萨市拉萨中学2022届高三第八次月考理综化学试题
解题方法
4 . 温室效应和污染正在成为日益严重的环境问题。
Ⅰ.煤制得的化工原料中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
①水解反应:COS(g)+H2O(g) H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1
②氢解反应:COS(g)+H2(g) H2S(g)+CO(g) ΔH2=-54 kJ·mol-1
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1
(1)请计算CO(g)+H2O(g) H2(g)+CO2(g) ΔH3=
H2(g)+CO2(g) ΔH3=_________ kJ·mol-1。
(2)在定温定容条件下,下列事实说明反应①达到平衡状态的是________ (填字母)。
A.容器的压强不再改变 B.混合气体的密度不再改变
C.H2S的百分含量不再改变 D.生成1 mol H—O键,同时生成1 mol H—S键
(3)一定温度和压强下,在1 L的密闭容器中,充入1 mol CO2和3 mol H2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
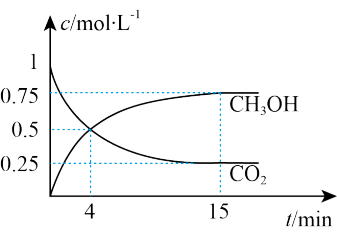
①反应进行到4 min 时,v(正)______ v(逆) (填“>”“<"或“=”)。0~4 min,H2的平均反应速率v(H2)=___ mol· L-1·min-1。
②写出一种在该温度下提高CH3OH产率的方法_____________________ 。
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:
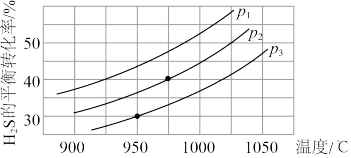
2H2S(g) 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。
(4)该反应ΔH_________ 0;ΔS________ 0。(填“>”或“<”)
(5)图中压强P1、P2、P3由大到小的顺序是__________________ 。
(6)在压强为P2,温度为975℃时,该反应的平衡常数K=___________ (保留2位有效数字)
Ⅰ.煤制得的化工原料中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
①水解反应:COS(g)+H2O(g)
 H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1②氢解反应:COS(g)+H2(g)
 H2S(g)+CO(g) ΔH2=-54 kJ·mol-1
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1(1)请计算CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH3=
H2(g)+CO2(g) ΔH3=(2)在定温定容条件下,下列事实说明反应①达到平衡状态的是
A.容器的压强不再改变 B.混合气体的密度不再改变
C.H2S的百分含量不再改变 D.生成1 mol H—O键,同时生成1 mol H—S键
(3)一定温度和压强下,在1 L的密闭容器中,充入1 mol CO2和3 mol H2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
①反应进行到4 min 时,v(正)
②写出一种在该温度下提高CH3OH产率的方法
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:
2H2S(g)
 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。(4)该反应ΔH
(5)图中压强P1、P2、P3由大到小的顺序是
(6)在压强为P2,温度为975℃时,该反应的平衡常数K=

您最近一年使用:0次
名校
解题方法
5 . 下列说法正确的是
| A.反应NH3(g)+HCl(g)=NH4Cl(s)常温下能自发进行,则该反应的ΔH>0 |
B.铜锌原电池中,盐桥中的K+和NO 分别移向正极和负极 分别移向正极和负极 |
| C.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率 |
| D.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
您最近一年使用:0次
2020-09-25更新
|
528次组卷
|
4卷引用:西藏自治区林芝市第二高级中学2020-2021学年高二上学期第二学段考试理综化学试题
6 . 氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:

回答下列问题:
①写出反应I的热化学方程式_________ 。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是
2NO2(g)反应速率的是_______ (填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________ (反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:

①T℃时,该反应的平衡常数为_____________________ (保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________________________________ 。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______ v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g) N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。

一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____________ ;在上图标出点中,指出能表示反应达到平衡状态的点是___ ,理由是________ 。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)
 2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
回答下列问题:
①写出反应I的热化学方程式
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)
 2NO2(g)反应速率的是
2NO2(g)反应速率的是(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
①T℃时,该反应的平衡常数为
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正
(3)NO2存在如下平衡:2NO2(g)
 N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=
您最近一年使用:0次
2020-01-15更新
|
508次组卷
|
8卷引用:西藏自治区拉萨市拉萨中学2020届高三第七次月考试理综化学试题
西藏自治区拉萨市拉萨中学2020届高三第七次月考试理综化学试题山东省泰安市2020届高三上学期期末考试化学试题(已下线)2020届高三《新题速递·化学》2月第01期(考点10-12)河北省石家庄市第二中学2020届高三下学期教学质量检测模拟考试理综化学试题江西省南昌市新建区第二中学2020届高三下学期第四次线上测试(全国I卷)理综化学试题(已下线)考点08 化学反应速率及其影响因素-2020年高考化学命题预测与模拟试题分类精编(已下线)考点10 化学平衡常数及其图象分析-2020年高考化学命题预测与模拟试题分类精编贵州省威宁县第八中学2021-2022学年高三上学期第一次月考化学试题
7 . (1)实验室由Al盐制备Al(OH)3最佳选择NH3·H2O,其离子反应方程式:____________________________
(2)12.4g Na2X含有0.4mol Na+, Na2X的摩尔质量为________ 。
(3)由氨气和氢气组成的混合气体的平均相对分子质量为12,则氨气和氢气的物质的量之比为_________
(4)已知 离子可与R2-离子反应,R2-被氧化为R单质,
离子可与R2-离子反应,R2-被氧化为R单质, 的还原产物中M为+3价;又已知100mL c(
的还原产物中M为+3价;又已知100mL c( )=0.2 mol·L-1的溶液可与100mL c(R2- )=0.6 mol·L-1的溶液恰好完全反应,则n值为
)=0.2 mol·L-1的溶液可与100mL c(R2- )=0.6 mol·L-1的溶液恰好完全反应,则n值为__________
A.4 B.5 C.6 D.7
(2)12.4g Na2X含有0.4mol Na+, Na2X的摩尔质量为
(3)由氨气和氢气组成的混合气体的平均相对分子质量为12,则氨气和氢气的物质的量之比为
(4)已知
 离子可与R2-离子反应,R2-被氧化为R单质,
离子可与R2-离子反应,R2-被氧化为R单质, 的还原产物中M为+3价;又已知100mL c(
的还原产物中M为+3价;又已知100mL c( )=0.2 mol·L-1的溶液可与100mL c(R2- )=0.6 mol·L-1的溶液恰好完全反应,则n值为
)=0.2 mol·L-1的溶液可与100mL c(R2- )=0.6 mol·L-1的溶液恰好完全反应,则n值为A.4 B.5 C.6 D.7
您最近一年使用:0次
名校
8 . 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是


| A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ |
| B.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
C.在1 L的容器中发生反应,10 min内 N2减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol·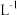 • •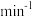 |
| D.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
您最近一年使用:0次
2018-11-05更新
|
452次组卷
|
13卷引用:西藏林芝一中2018-2019学年高一下学期期末考试化学试题
西藏林芝一中2018-2019学年高一下学期期末考试化学试题2015-2016学年广东省惠来、揭东一中高一下期末化学试卷2017届湖南省长沙市长郡中学高三上学期第三次月考模拟化学试卷2017届湖南省师大附中高三上月考三化学试卷2016-2017学年江西省南昌市八一中学等五校高二上联考二化学试卷【全国百强校】甘肃省兰州第一中学2017-2018学年高一下学期期末考试化学试题北京市师范大学附属中学2017-2018学年高一下学期期末考试化学试题【全国百强校】陕西省西安市第一中学2018-2019学年高二上学期10月月考化学试题湖北省武汉市蔡甸区汉阳一中2019-2020学年高一下学期期中联考化学试题河北省石家庄市辛集市第二中学2019-2020学年高一下学期期末考试化学试题云南省昆明市官渡区第一中学2019-2020学年高二上学期开学考试化学试题安徽省定远县育才学校2020-2021学年高二上学期第一次月考化学试题湖南省常德市芷兰实验中学2020-2021学年高二上学期第二次月考化学试题
9 . 在相同温度下,向1L的恒容密闭容器中,按照如下方式投料,
已知:2HI(g)⇌H2(g)+I2(g) ΔH=+26.5 kJ·mol-1。
(1)已知甲容器中,H2物质的量随时间的变化如右图所示:
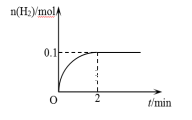
①0~2min内的平均反应速率v(H2)=____ 。
②该温度下反应的平衡常数K1=____ 。若温度升高,则K1____ (填“变大”或“变小”)。
③下列各项能说明反应在该温度下已达到平衡状态的是____ 。
A.各组分浓度不变 B.混合气体密度不变
C.v(H2)=0 D.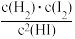 恒定
恒定
(2)对比甲、乙、丙,回答下列问题:
①K1、K2、K3的大小关系是____ 。
②下列物理量中,乙为甲的2倍的是____ 。
A.平衡常数 B.HI的平衡浓度
C.达到平衡的时间 D.平衡时H2的体积分数
(3)已知相同温度下,反应2HBr(g)⇌H2(g)+Br2(g)的平衡常数为KHBr,反应2HI(g)⇌H2(g)+I2(g)的平衡常数为KHI,且KHI>KHBr,下列推断正确的是____ 。
A.相同条件下,平衡时的转化率:HI>HBr B.分解的速率:HI>HBr
C.氧化性:Br2>I2D.HX的稳定性:HI>HBr
| 容器 | HI(g) | H2(g) | I2(g) | 平衡常数 |
| 甲 | 1 | 0 | 0 | K1 |
| 乙 | 2 | 0 | 0 | K2 |
| 丙 | 0 | 0.5 | 0.5 | K3 |
已知:2HI(g)⇌H2(g)+I2(g) ΔH=+26.5 kJ·mol-1。
(1)已知甲容器中,H2物质的量随时间的变化如右图所示:

①0~2min内的平均反应速率v(H2)=
②该温度下反应的平衡常数K1=
③下列各项能说明反应在该温度下已达到平衡状态的是
A.各组分浓度不变 B.混合气体密度不变
C.v(H2)=0 D.
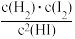 恒定
恒定(2)对比甲、乙、丙,回答下列问题:
①K1、K2、K3的大小关系是
②下列物理量中,乙为甲的2倍的是
A.平衡常数 B.HI的平衡浓度
C.达到平衡的时间 D.平衡时H2的体积分数
(3)已知相同温度下,反应2HBr(g)⇌H2(g)+Br2(g)的平衡常数为KHBr,反应2HI(g)⇌H2(g)+I2(g)的平衡常数为KHI,且KHI>KHBr,下列推断正确的是
A.相同条件下,平衡时的转化率:HI>HBr B.分解的速率:HI>HBr
C.氧化性:Br2>I2D.HX的稳定性:HI>HBr
您最近一年使用:0次
真题
名校
10 . 三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式__________ 。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g) SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol−1
SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol−1
3SiH2Cl2(g) SiH4(g)+2SiHCl3 (g) ΔH2=−30 kJ·mol−1
SiH4(g)+2SiHCl3 (g) ΔH2=−30 kJ·mol−1
则反应4SiHCl3(g) SiH4(g)+ 3SiCl4(g)的ΔH=
SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol−1。
(3)对于反应2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
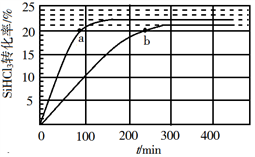
①343 K时反应的平衡转化率α=_________ %。平衡常数K343 K=__________ (保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是___________ ;要缩短反应达到平衡的时间,可采取的措施有____________ 、___________ 。
③比较a、b处反应速率大小:υa________ υb(填“大于”“小于”或“等于”)。反应速率υ=υ正−υ逆=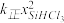 −
− ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处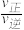 =
=__________ (保留1位小数)。
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)
 SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol−1
SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol−13SiH2Cl2(g)
 SiH4(g)+2SiHCl3 (g) ΔH2=−30 kJ·mol−1
SiH4(g)+2SiHCl3 (g) ΔH2=−30 kJ·mol−1则反应4SiHCl3(g)
 SiH4(g)+ 3SiCl4(g)的ΔH=
SiH4(g)+ 3SiCl4(g)的ΔH=(3)对于反应2SiHCl3(g)
 SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
①343 K时反应的平衡转化率α=
②在343 K下:要提高SiHCl3转化率,可采取的措施是
③比较a、b处反应速率大小:υa
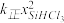 −
− ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处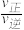 =
=
您最近一年使用:0次
2018-06-09更新
|
11970次组卷
|
8卷引用:西藏自治区日喀则市南木林高级中学2018-2019学年高二上学期期中考试化学试题



