名校
解题方法
1 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为____________ (答出一条即可)。
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ),其中
),其中 元素的化合价为
元素的化合价为______ 。
(3)已知: 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素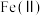 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ ;再加入石灰乳,所得滤渣中主要成分是 、
、______ 。
②通入混合气中 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是____________ ; 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是____________ 。 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成
 沉淀的离子方程式:
沉淀的离子方程式:______ 。
②若“镍钴分离”后溶液中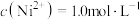 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中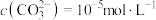 ,则沉镍率=
,则沉镍率=______ 。[已知: ,沉镍率=
,沉镍率=
 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。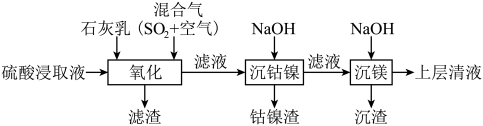
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(
 ),其中
),其中 元素的化合价为
元素的化合价为(3)已知:
 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素
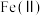 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、②通入混合气中
 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是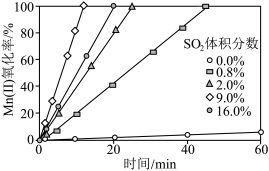
 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成 沉淀的离子方程式:
沉淀的离子方程式:②若“镍钴分离”后溶液中
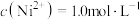 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中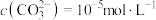 ,则沉镍率=
,则沉镍率= ,沉镍率=
,沉镍率=
您最近一年使用:0次
2024-02-17更新
|
483次组卷
|
4卷引用:专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)安徽省合肥市第一中学2023-2024学年高三上学期期末考试化学试题2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学
名校
解题方法
2 . 氨是一种重 要的化工原料,可用于制造铵态化肥。已知:N2(g)+3H2(g) 2NH3(g) ΔH=-91kJ/mol。回答下列问题:
2NH3(g) ΔH=-91kJ/mol。回答下列问题:
(1)已知上述反应的熵变(ΔS)为-198.9J·mol-1·K-1,该反应能自发进行的温度可能是___________(填标号)。
(2)在恒温恒容条件下,充入等物质的量的N2和H2合成氨气,下列情况表明该反应达到平衡状态的是___________(填标号)。
(3)在催化剂作用下,合成氨的反应速率为 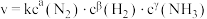 (k为速率常数,只与温度、催化剂有关,与浓度无关。a、β、γ为反应级数,可取正整数、负整数、0,也可取分数)。 为了测定反应级数,在一定温度下进行实验,其结果如下:
(k为速率常数,只与温度、催化剂有关,与浓度无关。a、β、γ为反应级数,可取正整数、负整数、0,也可取分数)。 为了测定反应级数,在一定温度下进行实验,其结果如下:
①α+β+γ=___________
②已知经验公式为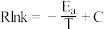 (其中,Ea、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得Rlnk与温度(
(其中,Ea、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得Rlnk与温度( )的关系如图1所示。
)的关系如图1所示。
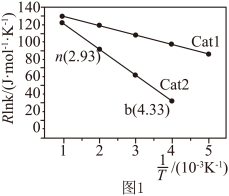
催化效率较高的是______ (填“Catl”或“Cat2”),在Cat2催化剂作用下。活化能Ea为 ___________
(4)在体积均为2L的甲、乙两恒容密闭容器中分别通入 l mol N2 和3mol H2,分别在不同条件下达到平衡,测得 NH₃的物质的量与时间的关系如图2所示。
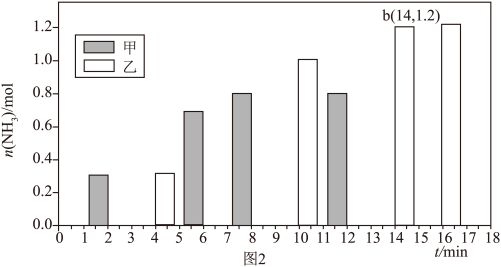
①相对甲,乙仅改变的一个条件是___________ ,正反应速率:a___________ (填“>”、“<”或“=”)b。
②在该条件下,乙的平衡常数为___________ (结果保留2位小数)。
 2NH3(g) ΔH=-91kJ/mol。回答下列问题:
2NH3(g) ΔH=-91kJ/mol。回答下列问题:(1)已知上述反应的熵变(ΔS)为-198.9J·mol-1·K-1,该反应能自发进行的温度可能是___________(填标号)。
| A.25 ℃ | B.150 ℃ | C.1273 ℃ | D.1457.5 ℃ |
| A.混合气体密度不随时间变化 | B.N₂ 体积分数不随时间变化 |
| C.混合气体总压强不随时间变化 | D.H2与 NH3的消耗速率之比为3∶2 |
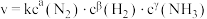 (k为速率常数,只与温度、催化剂有关,与浓度无关。a、β、γ为反应级数,可取正整数、负整数、0,也可取分数)。 为了测定反应级数,在一定温度下进行实验,其结果如下:
(k为速率常数,只与温度、催化剂有关,与浓度无关。a、β、γ为反应级数,可取正整数、负整数、0,也可取分数)。 为了测定反应级数,在一定温度下进行实验,其结果如下:| 序号 | c(N2)/(mol·L-1) | c(H2)/(mol·L-1) | c(NH3)/( mol·L-1) | 反应速率 |
| I | 1 | 1 | 1 | V |
| Ⅱ | 2 | 1 | 1 | 2v |
| Ⅲ | 1 | 4 | 1 | 16v |
| Ⅳ | 1 | 4 | 2 | 16v |
②已知经验公式为
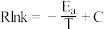 (其中,Ea、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得Rlnk与温度(
(其中,Ea、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得Rlnk与温度( )的关系如图1所示。
)的关系如图1所示。
催化效率较高的是
(4)在体积均为2L的甲、乙两恒容密闭容器中分别通入 l mol N

①相对甲,乙仅改变的一个条件是
②在该条件下,乙的平衡常数为
您最近一年使用:0次
2023-10-17更新
|
436次组卷
|
3卷引用:甘肃省白银市部分高中2024届高三上学期10月联考化学试题
解题方法
3 . 硫化氢为易燃危化品。油气开采、石油化工、煤化工等行业废气普遍应为: 。
。
回答下列问题:
(1)已知:ⅰ.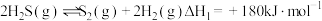
ⅱ.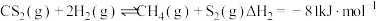
则总反应的
________  。
。
(2)下列叙述能说明总反应达到平衡状态的是________ (填标号)。
a.
b.恒温恒容条件下,体系压强不再变化
c.气体的总质量不再变化
d.混合气体平均摩尔质量不再变化
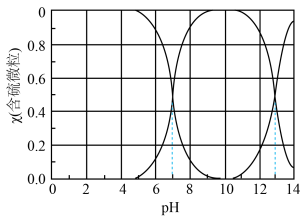
(3)常温下 在水溶液中的物质的量分数(
在水溶液中的物质的量分数(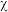 )随
)随 变化的分布曲线如图所示,
变化的分布曲线如图所示, 时,溶液中最主要的含硫微粒是
时,溶液中最主要的含硫微粒是________ ,向其中加入一定浓度的 溶液,加酸产生淡黄色沉淀,反应的离子方程式为
溶液,加酸产生淡黄色沉淀,反应的离子方程式为________ 。
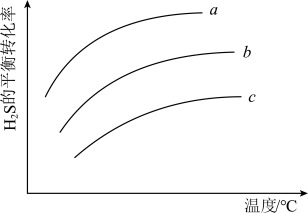
(4)压强恒定条件下,进料比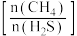 分别为
分别为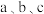 ,总反应中
,总反应中 的平衡转化率随温度变化情况如图所示,则
的平衡转化率随温度变化情况如图所示,则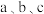 由大到小的顺序为
由大到小的顺序为________ ; 的平䚘转化率随温度升高而增大的原因是
的平䚘转化率随温度升高而增大的原因是_____ 。
(5)在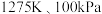 反应条件下,将物质的量分数之比为
反应条件下,将物质的量分数之比为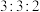 的
的 、
、 混合气进行甲烷处理硫化氢反应,平衡时混合气中
混合气进行甲烷处理硫化氢反应,平衡时混合气中 分压与
分压与 的分压相同,
的分压相同, 的平衡转化率为
的平衡转化率为________  (保留小数点后一位),平衡常数
(保留小数点后一位),平衡常数
________  (以分压表示,分压
(以分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
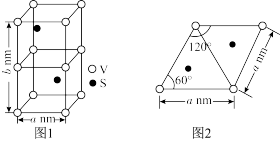
(6)某六方硫钒化合物晶体的晶胞如图1所示,图2为该晶胞的俯视图,该物质的化学式为________ ,晶体密度为________  (设
(设 为阿伏加德罗常数的值,列出计算式)。
为阿伏加德罗常数的值,列出计算式)。
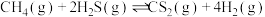 。
。回答下列问题:
(1)已知:ⅰ.
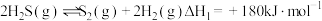
ⅱ.
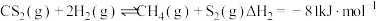
则总反应的

 。
。(2)下列叙述能说明总反应达到平衡状态的是
a.

b.恒温恒容条件下,体系压强不再变化
c.气体的总质量不再变化
d.混合气体平均摩尔质量不再变化
(3)常温下
 在水溶液中的物质的量分数(
在水溶液中的物质的量分数(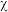 )随
)随 变化的分布曲线如图所示,
变化的分布曲线如图所示, 时,溶液中最主要的含硫微粒是
时,溶液中最主要的含硫微粒是 溶液,加酸产生淡黄色沉淀,反应的离子方程式为
溶液,加酸产生淡黄色沉淀,反应的离子方程式为
(4)压强恒定条件下,进料比
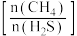 分别为
分别为 ,总反应中
,总反应中 的平衡转化率随温度变化情况如图所示,则
的平衡转化率随温度变化情况如图所示,则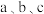 由大到小的顺序为
由大到小的顺序为 的平䚘转化率随温度升高而增大的原因是
的平䚘转化率随温度升高而增大的原因是
(5)在
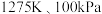 反应条件下,将物质的量分数之比为
反应条件下,将物质的量分数之比为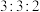 的
的 、
、 混合气进行甲烷处理硫化氢反应,平衡时混合气中
混合气进行甲烷处理硫化氢反应,平衡时混合气中 分压与
分压与 的分压相同,
的分压相同, 的平衡转化率为
的平衡转化率为 (保留小数点后一位),平衡常数
(保留小数点后一位),平衡常数
 (以分压表示,分压
(以分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。(6)某六方硫钒化合物晶体的晶胞如图1所示,图2为该晶胞的俯视图,该物质的化学式为
 (设
(设 为阿伏加德罗常数的值,列出计算式)。
为阿伏加德罗常数的值,列出计算式)。
您最近一年使用:0次
解题方法
4 . 研究CO2资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。
(1)已知:
Ⅰ.
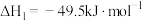
Ⅱ.
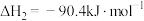
Ⅲ.

①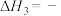
_______ 
②一定条件下,向体积为2L的恒容密闭容器中通入1molCO2和3molH2,发生上述反应,达到平衡时,容器中CH3OH(g)的物质的量为0.5mol;CO的物质的量为0.3mol;此时H2O(g)的浓度为_______ mol·L-1。
(2)CO2在Cu—ZnO催化下,同时发生反应Ⅰ、Ⅲ;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2;起始及达到平衡时(t min时恰好达到平衡);容器内各气体物质的量及总压强如下表:
若反应Ⅰ、Ⅲ均达到平衡时,p0=1.4p;则表中n=_______ ;0~t min内,CO2的分压变化率为_______ kPa·min⁻¹;反应Ⅰ的平衡常数Kp=_______ (kPa)-2(用含p的式子表示)。
(3)CO2催化加氢制甲烷涉及的反应主要有:
主反应:
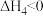
副反应:

若将CO2和H2按体积比为1∶4混合(n总=5mol);匀速通入装有催化剂的反应容器中,发生反应(包括主反应和副反应)。反应相同时间,CO2转化率、CH4和CO选择性随温度变化的曲线分别如图所示。
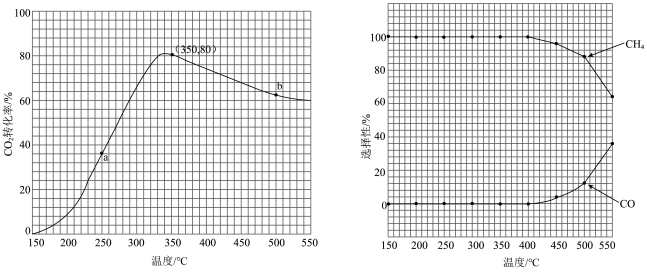
①a点的正反应速率和逆反应速率的大小关系为v正(a)_______ (填“>”、“=”或“<”)v逆(a)。
②催化剂在较低温度时主要选择_______ (填“主反应”或“副反应”)。
③350~400℃;CO2转化率呈现减小的变化趋势,其原因是_______ 。
(1)已知:
Ⅰ.

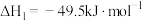
Ⅱ.

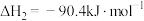
Ⅲ.


①
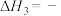

②一定条件下,向体积为2L的恒容密闭容器中通入1molCO2和3molH2,发生上述反应,达到平衡时,容器中CH3OH(g)的物质的量为0.5mol;CO的物质的量为0.3mol;此时H2O(g)的浓度为
(2)CO2在Cu—ZnO催化下,同时发生反应Ⅰ、Ⅲ;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2;起始及达到平衡时(t min时恰好达到平衡);容器内各气体物质的量及总压强如下表:
| 物质的量/mol | 总压强/kPa | |||||
| CO2 | H2 | CH3OH(g) | CO | H2O(g) | ||
| 起始 | 0.5 | 0.9 | 0 | 0 | 0 | p0 |
| 平衡 | n | 0.3 | p | |||
(3)CO2催化加氢制甲烷涉及的反应主要有:
主反应:

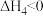
副反应:


若将CO2和H2按体积比为1∶4混合(n总=5mol);匀速通入装有催化剂的反应容器中,发生反应(包括主反应和副反应)。反应相同时间,CO2转化率、CH4和CO选择性随温度变化的曲线分别如图所示。

①a点的正反应速率和逆反应速率的大小关系为v正(a)
②催化剂在较低温度时主要选择
③350~400℃;CO2转化率呈现减小的变化趋势,其原因是
您最近一年使用:0次
2023-09-09更新
|
264次组卷
|
4卷引用:甘肃省白银市靖远县2024届高三上学期第一次联考化学试题
名校
5 . 温室气体让地球发烧,倡导低碳生活,是一种可持续发展的环保责任,将CO2应用于生产中实现其综合利用是目前的研究热点。
I.
(1)在催化作用下由CO2和CH4转化为CH3COOH,一定温度下,在恒容密闭容器中按1:1充入CO2和CH4,发生反应CO2(g)+CH4(g) CH3COOH(g),下列各项能判断该反应已经达到平衡状态的是:____。
CH3COOH(g),下列各项能判断该反应已经达到平衡状态的是:____。
II.研究证明,CO2可作为合成低碳烯烃的原料,目前利用CO2与H2合成乙烯相关的热化学方程式如下:
反应ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.01kJ·mol-1
反应ⅱ:2CH3OH(g)=C2H4(g)+2H2O(g) ΔH2=-29.98kJ·mol-1
(2)由CO2制C2H4的热化学方程式_______ 。
(3)一定条件下,CO2(g)+3H2(g)=CH3OH(g)+H2O(g)的反应历程如图所示:_______ (“1”或“2”)步决定。
III.在三个容积均为1L的密闭容器中以不同的氢碳比[ ]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g),CO2的平衡转化率随温度的变化如图所示。
C2H4(g)+4H2O(g),CO2的平衡转化率随温度的变化如图所示。_______ ,氢碳比①_______ ②(填“>”“<”或“=”)。
(5)若起始充入0.5molCO2、1.0molH2,计算Q点的平衡常数K=_______ 。
IV.一种新型短路膜电化学电池可以消除,装置如下图所示: 的捕获,缓解温室效应,由装置示意图可知,
的捕获,缓解温室效应,由装置示意图可知, 向
向_______ 极移动,负极的电极反应式是_______ 。
I.
(1)在催化作用下由CO2和CH4转化为CH3COOH,一定温度下,在恒容密闭容器中按1:1充入CO2和CH4,发生反应CO2(g)+CH4(g)
 CH3COOH(g),下列各项能判断该反应已经达到平衡状态的是:____。
CH3COOH(g),下列各项能判断该反应已经达到平衡状态的是:____。| A.混合气体的密度不变 | B.CO2的体积分数保持不变 |
C. | D.混合气体的平均摩尔质量不变 |
II.研究证明,CO2可作为合成低碳烯烃的原料,目前利用CO2与H2合成乙烯相关的热化学方程式如下:
反应ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.01kJ·mol-1
反应ⅱ:2CH3OH(g)=C2H4(g)+2H2O(g) ΔH2=-29.98kJ·mol-1
(2)由CO2制C2H4的热化学方程式
(3)一定条件下,CO2(g)+3H2(g)=CH3OH(g)+H2O(g)的反应历程如图所示:

III.在三个容积均为1L的密闭容器中以不同的氢碳比[
 ]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g),CO2的平衡转化率随温度的变化如图所示。
C2H4(g)+4H2O(g),CO2的平衡转化率随温度的变化如图所示。
(5)若起始充入0.5molCO2、1.0molH2,计算Q点的平衡常数K=
IV.一种新型短路膜电化学电池可以消除,装置如下图所示:

 的捕获,缓解温室效应,由装置示意图可知,
的捕获,缓解温室效应,由装置示意图可知, 向
向
您最近一年使用:0次
2022-12-15更新
|
355次组卷
|
2卷引用:甘肃省庆阳市第二中学2023-2024学年高二上学期期末考试化学试题
名校
6 . 为消除燃煤烟气中含有的 、
、 ,研究者提出若干烟气“脱硫”“脱硝”的方法。
,研究者提出若干烟气“脱硫”“脱硝”的方法。
【方法一】以NaClO作为吸收剂进行一体化“脱硫”“脱硝”,将烟气中的 、NO转化为
、NO转化为 、
、 。
。
(1)

 溶液理论上最多能吸收标准状况下NO的体积为
溶液理论上最多能吸收标准状况下NO的体积为_______ L。
(2)实验室利用模拟烟气(模拟烟气中 和NO的物质的量之比为
和NO的物质的量之比为 )探究该方法“脱硫”“脱硝”的效果,一定时间内,温度对硫、硝脱除率的影响曲线如图所示。
)探究该方法“脱硫”“脱硝”的效果,一定时间内,温度对硫、硝脱除率的影响曲线如图所示。

①此方法“脱硫”“脱硝”探究实验的最佳温度为_______ ; 的脱除率高于
的脱除率高于 ,其原因除
,其原因除 的还原性比
的还原性比 强外,还可能是
强外,还可能是_______ 。
② 时,吸收液中烟气转化生成的
时,吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为_______ 。
【方法二】 技术(选择性催化还原氮氧化物)
技术(选择性催化还原氮氧化物)
研究表明,铁基催化剂在260~300℃范围内实现 技术的过程如图所示。
技术的过程如图所示。
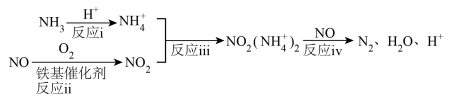
(3)根据上述机理, 在反应过程中的作用为
在反应过程中的作用为_______ ;等物质的量的 、
、 在有氧条件下转化为
在有氧条件下转化为 的总反应化学方程式为
的总反应化学方程式为_______ ;
(4)若使用锰基催化剂(活性物质为 )代替铁基催化剂,烟气中含有的
)代替铁基催化剂,烟气中含有的 会使催化剂失效而降低
会使催化剂失效而降低 脱除率,用化学方程式表示催化剂失效的原因:
脱除率,用化学方程式表示催化剂失效的原因:_______ 。
(5)向反应体系中添加 可显著提高
可显著提高 脱除率,原因是
脱除率,原因是 与
与 反应生成
反应生成 和阴离子M;阴离子M再与
和阴离子M;阴离子M再与 发生反应转化为
发生反应转化为 ,则阴离子M为
,则阴离子M为_______ 。
 、
、 ,研究者提出若干烟气“脱硫”“脱硝”的方法。
,研究者提出若干烟气“脱硫”“脱硝”的方法。【方法一】以NaClO作为吸收剂进行一体化“脱硫”“脱硝”,将烟气中的
 、NO转化为
、NO转化为 、
、 。
。(1)

 溶液理论上最多能吸收标准状况下NO的体积为
溶液理论上最多能吸收标准状况下NO的体积为(2)实验室利用模拟烟气(模拟烟气中
 和NO的物质的量之比为
和NO的物质的量之比为 )探究该方法“脱硫”“脱硝”的效果,一定时间内,温度对硫、硝脱除率的影响曲线如图所示。
)探究该方法“脱硫”“脱硝”的效果,一定时间内,温度对硫、硝脱除率的影响曲线如图所示。
①此方法“脱硫”“脱硝”探究实验的最佳温度为
 的脱除率高于
的脱除率高于 ,其原因除
,其原因除 的还原性比
的还原性比 强外,还可能是
强外,还可能是②
 时,吸收液中烟气转化生成的
时,吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为【方法二】
 技术(选择性催化还原氮氧化物)
技术(选择性催化还原氮氧化物)研究表明,铁基催化剂在260~300℃范围内实现
 技术的过程如图所示。
技术的过程如图所示。
(3)根据上述机理,
 在反应过程中的作用为
在反应过程中的作用为 、
、 在有氧条件下转化为
在有氧条件下转化为 的总反应化学方程式为
的总反应化学方程式为(4)若使用锰基催化剂(活性物质为
 )代替铁基催化剂,烟气中含有的
)代替铁基催化剂,烟气中含有的 会使催化剂失效而降低
会使催化剂失效而降低 脱除率,用化学方程式表示催化剂失效的原因:
脱除率,用化学方程式表示催化剂失效的原因:(5)向反应体系中添加
 可显著提高
可显著提高 脱除率,原因是
脱除率,原因是 与
与 反应生成
反应生成 和阴离子M;阴离子M再与
和阴离子M;阴离子M再与 发生反应转化为
发生反应转化为 ,则阴离子M为
,则阴离子M为
您最近一年使用:0次
2022-11-19更新
|
210次组卷
|
2卷引用:甘肃省永昌县第一高级中学2023-2024学年高三上学期期中考试化学试题
7 . 低碳循环”引起各国的高度重视,对CO2回收或加以利用对缓解温室效应和能源危机意义十分重大,已成为科学家研究的重要课题,回答下列问题:
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g) △H=-41kJ•mol-1
H2(g)+CO2(g) △H=-41kJ•mol-1
②C(s)+2H2(g) CH4(g) △H=-72kJ•mol-1
CH4(g) △H=-72kJ•mol-1
③2CO(g) C(s)+CO2(g) △H=-171kJ•mol-1
C(s)+CO2(g) △H=-171kJ•mol-1
写出H2与CO2反应生成H2O(g)和CH4的热化学方程式:___________ 。
(2)以CO2与NH3为原料可以合成尿素[CO(NH2)2]。在尿素合成塔中的主要反应可表示为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H<0。
CO(NH2)2(s)+H2O(g) △H<0。
①T℃时,若向容积为2L的密闭容器中加入3mol NH3和1mol CO2,达到平衡时,容器内压强为开始时的0.75倍。则该反应平衡常数K=___________ 。若保持其他条件不变,向该容器中再加入1mol CO2和1mol H2O,NH3的转化率将___________ (填“增大”、“减小”或“不变”)。以下有利于提高NH3平衡转化率的条件有___________ (填标号)。
a.恒温低压 b.低温高压 c.恒压低温 d.高温低压
②合成尿素的正、逆反应的平衡常数(K)与温度(T)的关系如图甲所示。表示正反应平衡常数的曲线为___________ (填“a”或“b”);理由为___________ 。

(3)酸性条件下,对CO2进行电解可制取工业原料乙烯,其工作的原理如图乙所示,电解时,b极的电极反应式为___________ 。

(1)已知:①CO(g)+H2O(g)
 H2(g)+CO2(g) △H=-41kJ•mol-1
H2(g)+CO2(g) △H=-41kJ•mol-1②C(s)+2H2(g)
 CH4(g) △H=-72kJ•mol-1
CH4(g) △H=-72kJ•mol-1③2CO(g)
 C(s)+CO2(g) △H=-171kJ•mol-1
C(s)+CO2(g) △H=-171kJ•mol-1写出H2与CO2反应生成H2O(g)和CH4的热化学方程式:
(2)以CO2与NH3为原料可以合成尿素[CO(NH2)2]。在尿素合成塔中的主要反应可表示为2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) △H<0。
CO(NH2)2(s)+H2O(g) △H<0。①T℃时,若向容积为2L的密闭容器中加入3mol NH3和1mol CO2,达到平衡时,容器内压强为开始时的0.75倍。则该反应平衡常数K=
a.恒温低压 b.低温高压 c.恒压低温 d.高温低压
②合成尿素的正、逆反应的平衡常数(K)与温度(T)的关系如图甲所示。表示正反应平衡常数的曲线为

(3)酸性条件下,对CO2进行电解可制取工业原料乙烯,其工作的原理如图乙所示,电解时,b极的电极反应式为

您最近一年使用:0次
名校
解题方法
8 . 当今,世界多国相继规划了碳达峰、碳中和的时间节点,因此碳的利用、捕集和减排成了研究的重点。
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1=-164.9kJ·mol-1
CH4(g)+2H2O(g) ΔH1=-164.9kJ·mol-1
反应II:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
则CH4(g)和H2O(g)重整生成CO(g)和H2(g)的热化学方程式为___________ 。
(2)将CO2和H2按体积比1:4混合(n总=5mol),匀速通入装有Ru/TiO2催化剂的反应容器中发生反应I和反应II。反应相同时间,CO2转化率、CH4和CO选择性(选择性:转化的CO2中生成CH4或CO的百分比)随温度变化曲线分别如图所示。

①a点的正反应速率和逆反应速率的大小关系为v正(a)___________ v逆(a)(填“>”“=”或“<”)。
②Ru/TiO2催化剂在较低温度主要选择___________ (填“反应I”或“反应II”)。
③350℃~400℃温度区间,CO2转化率呈现减小的变化趋势,其原因是___________ 。
④350℃时,反应达到平衡时容器体积为5L,求该温度下反应I的平衡常数K=___________ L2·mol-2。
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。若某次捕捉后得到pH=10的溶液,则溶液中c(CO ):c(H2CO3)=
):c(H2CO3)=___________ 。(已知:常温下H2CO3:Ka1=4.5×10-7、Ka2=4.7×10-11)

(4)Na−CO2电池可以实现对CO2的利用,该类电池放电的反应方程式为:4Na+3CO2=2Na2CO3+C。其工作原理如图所示,请写出正极的反应方程式___________ 。
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
反应I:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH1=-164.9kJ·mol-1
CH4(g)+2H2O(g) ΔH1=-164.9kJ·mol-1反应II:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1则CH4(g)和H2O(g)重整生成CO(g)和H2(g)的热化学方程式为
(2)将CO2和H2按体积比1:4混合(n总=5mol),匀速通入装有Ru/TiO2催化剂的反应容器中发生反应I和反应II。反应相同时间,CO2转化率、CH4和CO选择性(选择性:转化的CO2中生成CH4或CO的百分比)随温度变化曲线分别如图所示。

①a点的正反应速率和逆反应速率的大小关系为v正(a)
②Ru/TiO2催化剂在较低温度主要选择
③350℃~400℃温度区间,CO2转化率呈现减小的变化趋势,其原因是
④350℃时,反应达到平衡时容器体积为5L,求该温度下反应I的平衡常数K=
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。若某次捕捉后得到pH=10的溶液,则溶液中c(CO
 ):c(H2CO3)=
):c(H2CO3)=
(4)Na−CO2电池可以实现对CO2的利用,该类电池放电的反应方程式为:4Na+3CO2=2Na2CO3+C。其工作原理如图所示,请写出正极的反应方程式
您最近一年使用:0次
2022-01-20更新
|
787次组卷
|
5卷引用:甘肃省张掖市2021-2022学年高三第二次全市联考(3月)理综化学试题
9 . I. 已知:H2O2可看作二元弱酸。
(1)请写出H2O2与Ba(OH)2溶液反应生成的酸式盐的电子式________________ 。
某兴趣小组分析H2O2的催化分解原理。
(2)I-催化H2O2分解的原理分为两步,总反应可表示为:2H2O2(aq)=2H2O(l)+O2(g) △H<0,若第一步反应的热化学方程式为:H2O2(aq)+I-(aq)=IO-(aq)+H2O(l) △H>0 慢反应,则第二步反应的热化学方程式为:___________ △H <0 快反应
(3)能正确表示I-催化H2O2分解原理的示意图为______ 。

II. 丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图,主反应为丙烷脱氢反应,副反应为丙烷裂解反应
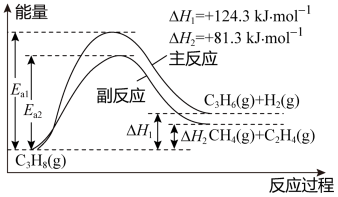
已知主反应:v正= k正p(C3H8),v逆= k逆p(C3H6)·p(H2)。
其中v正、v逆 为正、逆反应速率,k正、k逆为速率常数,p为各组分的分压。
(4)下表中为各物质的燃烧热,计算丙烯的燃烧热为△H =______ kJ·mol-1。
副反应丙烷裂解制乙烯的过程中,其原子利用率为_______ (保留三位有效数字)。
(5)在T1、T2、T3不同温度下,向体积为1L的恒容密闭容器中充入1molC3H8,开始时容器的压强分别为p1、p2、p3,仅发生主反应,丙烷转化率(α)随时间(t)的变化关系如图所示:
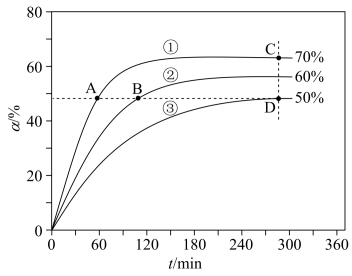
①A、B、D三点中,k正/k逆 值最大的是_________ ,
②A、B、C、D四点中,v逆 最大的是_________ 。
(1)请写出H2O2与Ba(OH)2溶液反应生成的酸式盐的电子式
某兴趣小组分析H2O2的催化分解原理。
(2)I-催化H2O2分解的原理分为两步,总反应可表示为:2H2O2(aq)=2H2O(l)+O2(g) △H<0,若第一步反应的热化学方程式为:H2O2(aq)+I-(aq)=IO-(aq)+H2O(l) △H>0 慢反应,则第二步反应的热化学方程式为:
(3)能正确表示I-催化H2O2分解原理的示意图为

II. 丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图,主反应为丙烷脱氢反应,副反应为丙烷裂解反应

已知主反应:v正= k正p(C3H8),v逆= k逆p(C3H6)·p(H2)。
其中v正、v逆 为正、逆反应速率,k正、k逆为速率常数,p为各组分的分压。
(4)下表中为各物质的燃烧热,计算丙烯的燃烧热为△H =
| H2 | CH4 | C2H4 | |
| △H /kJ·mol—1 | -285.8 | -890.3 | -1411.0 |
副反应丙烷裂解制乙烯的过程中,其原子利用率为
(5)在T1、T2、T3不同温度下,向体积为1L的恒容密闭容器中充入1molC3H8,开始时容器的压强分别为p1、p2、p3,仅发生主反应,丙烷转化率(α)随时间(t)的变化关系如图所示:

①A、B、D三点中,k正/k逆 值最大的是
②A、B、C、D四点中,v逆 最大的是
您最近一年使用:0次
2021-10-21更新
|
599次组卷
|
3卷引用:甘肃省兰州市第二十七中学2022届高三上学期第一次月考化学试题
名校
10 . 在金催化剂表面上进行某反应历程如图所示,其中吸附在金催化剂表面上的物种用·标注。下列说法正确的是
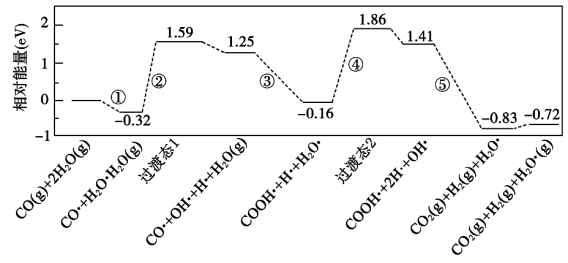

A.该反应的热效应 >0 >0 |
| B.反应过程中发生非极性键的断裂与生成 |
| C.其他条件不变,使用另一高效催化剂可使CO的平衡转化率增大 |
D.该历程中最大能垒(活化能)步骤的反应式为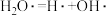 |
您最近一年使用:0次
2021-09-04更新
|
1234次组卷
|
8卷引用:甘肃省平凉市第一中学2022-2023学年高二上学期第一次月考化学试题



