名校
解题方法
1 . 宇宙中所有的一切都是能量的变化,研究化学反应中的能量变化意义重大。
(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热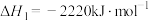 ,正丁烷的燃烧热
,正丁烷的燃烧热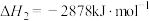 ;异丁烷的燃烧热
;异丁烷的燃烧热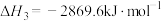 。下列有关说法正确的是
。下列有关说法正确的是_______ (填字母)。
A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(2)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。键能也可以用于估算化学反应的反应热( )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:

已知白磷的燃烧热为2378.0kJ·mol-1,白磷和白磷完全燃烧的产物结构如图所示,则上表中X=___ 。
(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
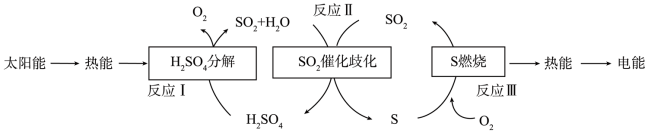
反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g)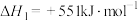
反应III:S(s)+O2(g)=SO2(g)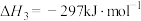
反应II的热化学方程式:_______ 。
(4)热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热( )。如图为VIA族元素(包括氧、硫、硒、碲)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
)。如图为VIA族元素(包括氧、硫、硒、碲)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
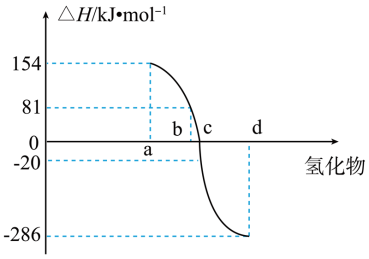
①图中d对应的氢化物是_______ (填化学式),结合元素周期律归纳非金属元素氢化物的稳定性与氢化物的生成热 的关系:
的关系:_______ 。
②硒化氢在上述条件下发生分解反应的热化学方程式为____ 。(沸点:硒化氢-41.3℃;硒684.9℃)
(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热
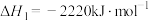 ,正丁烷的燃烧热
,正丁烷的燃烧热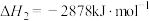 ;异丁烷的燃烧热
;异丁烷的燃烧热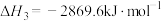 。下列有关说法正确的是
。下列有关说法正确的是A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(2)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。键能也可以用于估算化学反应的反应热(
 )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ/mol) | 172 | 335 | 498 | X |

已知白磷的燃烧热为2378.0kJ·mol-1,白磷和白磷完全燃烧的产物结构如图所示,则上表中X=
(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:

反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g)
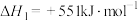
反应III:S(s)+O2(g)=SO2(g)
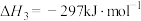
反应II的热化学方程式:
(4)热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(
 )。如图为VIA族元素(包括氧、硫、硒、碲)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
)。如图为VIA族元素(包括氧、硫、硒、碲)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
①图中d对应的氢化物是
 的关系:
的关系:②硒化氢在上述条件下发生分解反应的热化学方程式为
您最近一年使用:0次
名校
2 . 已知碳的燃烧热为393.5kJ•mol-1,氢气的燃烧热为285.8kJ•mol-1,一氧化碳的燃烧热为283.0kJ•mol-1。某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧更旺。下列有关说法正确的是
A.氢气燃烧热的热化学方程式为H2(g)+ O2(g)=H2O(g) △H=-285.8kJ•mol-1 O2(g)=H2O(g) △H=-285.8kJ•mol-1 |
B.反应C(s)+ O2(g)=CO(g)的△H<-393.5kJ•mol-1 O2(g)=CO(g)的△H<-393.5kJ•mol-1 |
| C.“煤炭燃烧得更旺”是因为少量固体碳与水反应生成了可燃性气体 |
| D.C(s)+H2O(g)=CO(g)+H2(g) △H=175.3kJ•mol-1 |
您最近一年使用:0次
2022-11-02更新
|
345次组卷
|
8卷引用:安徽省合肥一六八中学2022-2023学年高二上学期化学学科学情调研试题
名校
3 . 在下列各说法中,正确的是
A.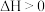 表示放热反应, 表示放热反应,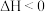 表示吸热反应 表示吸热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
C. 与 与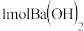 反应生成 反应生成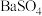 沉淀时放出的热叫做中和热 沉淀时放出的热叫做中和热 |
D. 与 与 反应放出的热就是 反应放出的热就是 的燃烧热 的燃烧热 |
您最近一年使用:0次
2022-10-25更新
|
169次组卷
|
6卷引用:安徽省合肥市肥东县综合高中2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
4 . 下列关于反应能量的说法正确的是
| A.若反应A(s)=B(s),ΔH <0,则说明A物质比B物质稳定,分子内共价键键能A比B大 |
| B.Zn(s)+ CuSO4(aq) = ZnSO4(aq) + Cu(s) ΔH =- 216 kJ·mol-1, 则反应物总能量>生成物总能量 |
C.101kPa时,2C(s) + O2(g)= 2CO(g) ΔH =- Q kJ·mol-1,则C的燃烧热为 Q kJ·mol-1 Q kJ·mol-1 |
| D.H+(aq) + OH-(aq)= H2O(l) ΔH =- 57.3 kJ·mol-1,含1mol NaOH的氢氧化钠溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量 |
您最近一年使用:0次
2022-10-20更新
|
193次组卷
|
4卷引用:安徽省宿州市十三所重点中学2022-2023学年高二上学期期中质量检测化学试题
名校
解题方法
5 . Ⅰ.已知下列热化学方程式:
①H2(g)+ O2(g)=H2O(l) △H=-285.8 kJ/mol
O2(g)=H2O(l) △H=-285.8 kJ/mol
②H2(g)+ O2(g)=H2O(l) △H=-241.8 kJ/mol
O2(g)=H2O(l) △H=-241.8 kJ/mol
③C(s)+ O2(g)=CO(g) △H=-110.5 kJ/mol
O2(g)=CO(g) △H=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
回答下列问题:
(1)碳的燃烧热的热化学方程式为_______ (填序号)。
(2)燃烧1 g H2 (g)生成液态水,放出的热量为_______ 。
Ⅱ.中和热是一类重要的反应热,也是化学研究的重要课题。已知强酸稀溶液与强碱稀溶液发生反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol。
(3)下列各组试剂混合发生反应的离子方程式为H++OH-=H2O的是_______ (填序号)。
A.盐酸与氢氧化钠溶液
B.稀硫酸与氢氧化钡溶液
C.醋酸与氢氧化钠固体
D.硫酸氢钠溶液与氢氧化钠溶液
E.氢氧化镁溶于稀盐酸
(4)若稀硫酸与氢氧化钠固体反应生成1 mol H2O(l),则反应放出的热量_______ (填“大于”“等于”或“小于”)57.3 kJ,原因是_______ 。
Ⅲ.已知:
①H2(g)+ O2(g)=H2O(l) △H1=-285.8 kJ/mol
O2(g)=H2O(l) △H1=-285.8 kJ/mol
②C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H2=-2219.9 kJ/mol
(5)在25℃和101 kPa下,H2和C3H8的混合气体5 mol完全燃烧生成CO2和液态水,放出6264.25kJ的热量。该混合气体中H2和C3H8的体积之比为_______ 。
(6)已知 H2O(l)=H2O(g) △H3=+44.0kJ/mol。写出C3H8燃烧生成CO2和水蒸气的热化学方程式:_______ 。
①H2(g)+
 O2(g)=H2O(l) △H=-285.8 kJ/mol
O2(g)=H2O(l) △H=-285.8 kJ/mol ②H2(g)+
 O2(g)=H2O(l) △H=-241.8 kJ/mol
O2(g)=H2O(l) △H=-241.8 kJ/mol ③C(s)+
 O2(g)=CO(g) △H=-110.5 kJ/mol
O2(g)=CO(g) △H=-110.5 kJ/mol ④C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
回答下列问题:
(1)碳的燃烧热的热化学方程式为
(2)燃烧1 g H2 (g)生成液态水,放出的热量为
Ⅱ.中和热是一类重要的反应热,也是化学研究的重要课题。已知强酸稀溶液与强碱稀溶液发生反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol。
(3)下列各组试剂混合发生反应的离子方程式为H++OH-=H2O的是
A.盐酸与氢氧化钠溶液
B.稀硫酸与氢氧化钡溶液
C.醋酸与氢氧化钠固体
D.硫酸氢钠溶液与氢氧化钠溶液
E.氢氧化镁溶于稀盐酸
(4)若稀硫酸与氢氧化钠固体反应生成1 mol H2O(l),则反应放出的热量
Ⅲ.已知:
①H2(g)+
 O2(g)=H2O(l) △H1=-285.8 kJ/mol
O2(g)=H2O(l) △H1=-285.8 kJ/mol②C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H2=-2219.9 kJ/mol
(5)在25℃和101 kPa下,H2和C3H8的混合气体5 mol完全燃烧生成CO2和液态水,放出6264.25kJ的热量。该混合气体中H2和C3H8的体积之比为
(6)已知 H2O(l)=H2O(g) △H3=+44.0kJ/mol。写出C3H8燃烧生成CO2和水蒸气的热化学方程式:
您最近一年使用:0次
2022-10-16更新
|
200次组卷
|
5卷引用:安徽省名校联盟2022-2023学年高二上学期阶段测试(一)化学试题
安徽省名校联盟2022-2023学年高二上学期阶段测试(一)化学试题安徽省合肥市肥西县2022-2023学年高二上学期10月月考化学试题河南省名校联盟2022-2023学年高二上学期阶段测试(一)化学试题(已下线)河南省实验中学2023-2024学年高二上学期开学考试化学试题河南省实验中学2023-2024学年高二上学期开学考试化学试题
名校
解题方法
6 . 下列关于反应能量的说法正确的是
A.一定条件下:①2SO2(g)+O2(g) 2SO3(g) △H1;②2SO3(g) 2SO3(g) △H1;②2SO3(g) 2SO2(g)+O2(g) △H2,则△H1<△H2 2SO2(g)+O2(g) △H2,则△H1<△H2 |
| B.相同条件下,若1molH(g)具有的能量为E1,1molH2(g)具有的能量为E2,则有2E1=E2 |
| C.甲烷的燃烧热△H=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1 |
| D.已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1,则1molNaOH固体与含0.5molH2SO4的稀硫酸混合放出57.3kJ的热量 |
您最近一年使用:0次
2022-09-27更新
|
344次组卷
|
4卷引用:安徽省十联盟2022-2023学年高二下学期期中考试化学(B卷)试题
7 . 2022年4月16日,在搭载神舟十三号载人飞船前往太空六个月之后,我们的英雄翟志刚、王亚平、叶光富三名航天员终于圆满完成任务,返回地球。标志着我国空间站建设以及航天技术水平又取得了新的历史性成就。下列说法正确的是
| A.空间站内使用的石英玻璃的主要成分为硅酸盐 |
| B.舱内供给呼吸的氧气是水电解的还原产物 |
| C.宇航员穿的舱外航天服可采用全棉制作 |
D.可用偏二甲肼[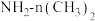 ]等有机物作为火箭发射的燃料 ]等有机物作为火箭发射的燃料 |
您最近一年使用:0次
2022-09-27更新
|
165次组卷
|
2卷引用:安徽省宿松中学2022-2023学年高二上学期开学考试化学试题
8 . (Ⅰ)请回答下列问题:
(1)在101kPa时,一定量的CO在1.00mol O2中完全燃烧,生成2.00mol CO2,放出566.0kJ热量,CO的燃烧热为ΔH=_______ ,表示CO燃烧热的热化学方程式_______ 。
(Ⅱ)试分别从能量变化和化学键变化角度研究反应2H2(g)+O2(g)=2H2O(l)的焓变。
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是_______ 。
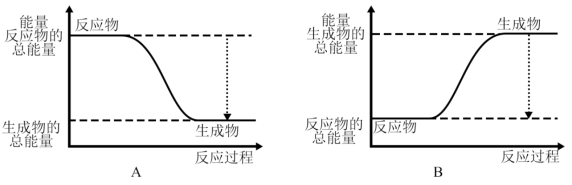
(3)从断键和成键的角度分析上述反应中能量的变化。已知化学键的键能:
由此计算2mol H2在氧气中完全燃烧生成气态水放出的热量_______ 。
(Ⅲ)依据盖斯定律回答下列问题:
已知火箭发射时可用肼(N2H4)作燃料,二氧化氮作氧化剂,这两者反应生成氮气和水蒸气。
且N2(g)+2O2(g)=2NO2(g);ΔH1=+67.7kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g);ΔH2=-534kJ/mol ②
(4)写出肼与NO2反应的热应化学方程式_______ 。
(1)在101kPa时,一定量的CO在1.00mol O2中完全燃烧,生成2.00mol CO2,放出566.0kJ热量,CO的燃烧热为ΔH=
(Ⅱ)试分别从能量变化和化学键变化角度研究反应2H2(g)+O2(g)=2H2O(l)的焓变。
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是

(3)从断键和成键的角度分析上述反应中能量的变化。已知化学键的键能:
| 化学键 | H-H | O=O | H-O |
| 键能/kJ·mol-1 | 436 | 496 | 463 |
(Ⅲ)依据盖斯定律回答下列问题:
已知火箭发射时可用肼(N2H4)作燃料,二氧化氮作氧化剂,这两者反应生成氮气和水蒸气。
且N2(g)+2O2(g)=2NO2(g);ΔH1=+67.7kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g);ΔH2=-534kJ/mol ②
(4)写出肼与NO2反应的热应化学方程式
您最近一年使用:0次
9 . 下列有关热化学方程式及其叙述正确的是
A.CH3COOH与NaOH溶液反应:H+(aq)+OH-(aq) H2O(l) △H=-57.3kJ/mol H2O(l) △H=-57.3kJ/mol |
| B.氢气燃烧热:-285.5kJ/mol,则分解水热方程式为2H2O(l)=2H2(g)+O2(g) △H= + 571kJ/mol |
C.已知N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol,则在一定条件下将1molN2和3molH2置于一密闭容器中充分反应后最多可放出92.4kJ的热量 2NH3(g) △H=-92 kJ/mol,则在一定条件下将1molN2和3molH2置于一密闭容器中充分反应后最多可放出92.4kJ的热量 |
| D.已知2C(s)+O2(g) = 2CO(g) ΔH= - 221kJ·mol-1,则石墨的燃烧热为-110.5kJ·mol-1 |
您最近一年使用:0次
2022-09-15更新
|
340次组卷
|
4卷引用:安徽省舒城晓天中学2022-2023学年高二上学期期中考试化学试题
解题方法
10 . 下列关于反应热的说法正确的是
A.a.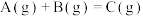  ;b. ;b. 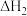 ,若a、b反应放热,则 ,若a、b反应放热,则 |
B.已知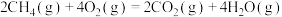  ,则甲烷的燃烧热为 ,则甲烷的燃烧热为 |
C.  ,则常温下 ,则常温下 比 比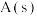 更稳定 更稳定 |
D.  ,恒温恒压下达平衡后加入X,上述反应 ,恒温恒压下达平衡后加入X,上述反应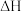 增大 增大 |
您最近一年使用:0次



