名校
1 . 下列图示与对应叙述相符的是
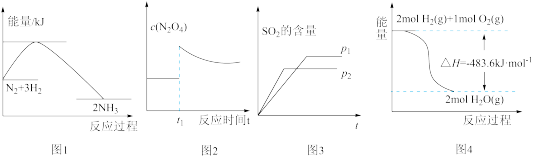

| A.图1反应达平衡后,升高温度,平衡常数K值减小 |
B.图2表示平衡2NO2(g) N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
C.图3表示可逆反应“2SO2+O2 2SO3”中SO2的含量与压强的关系,且P2>P1 2SO3”中SO2的含量与压强的关系,且P2>P1 |
| D.图4表示H2与O2发生反应过程中的能量变化,则H2的燃烧热ΔH=-241.8kJ•mol-1 |
您最近一年使用:0次
2022-09-27更新
|
328次组卷
|
3卷引用:江苏省如皋中学2022-2023学年高二上学期8月综合测试化学试题
22-23高三上·江苏南通·开学考试
2 . 丙烯是一种重要的有机化工原料,工业上以丁烯、乙烯为原料制取丙烯的反应如下: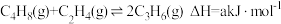 ,一定温度下,向体积为V L密闭容器中充入1 mol C4H8(g)和1 mol C2H4(g),测得C3H6的体积分数随时间的变化如图中线I所示。
,一定温度下,向体积为V L密闭容器中充入1 mol C4H8(g)和1 mol C2H4(g),测得C3H6的体积分数随时间的变化如图中线I所示。

已知几种气体的燃烧热如下表所示
下列说法正确的是
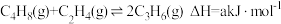 ,一定温度下,向体积为V L密闭容器中充入1 mol C4H8(g)和1 mol C2H4(g),测得C3H6的体积分数随时间的变化如图中线I所示。
,一定温度下,向体积为V L密闭容器中充入1 mol C4H8(g)和1 mol C2H4(g),测得C3H6的体积分数随时间的变化如图中线I所示。
已知几种气体的燃烧热如下表所示
| 气体 | C2H4(g) | C3H6(g) | C4H8(g) |
| 燃烧热/kJ/mol | 1411 | 2049 | 2539 |
| A.C4H8(g)燃烧的热化学方程式可表示为C4H8(g)+6O2(g)=4CO2(g)+4H2O(g) △H=-2539 kJ/mol |
| B.a=148 |
| C.该温度下反应的平衡常数为64 |
| D.图中线Ⅱ可能是其他条件一定,反应在更高温度时进行 |
您最近一年使用:0次
名校
解题方法
3 . 下列关于热化学反应的描述正确的是
A.已知 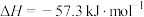 ,则HCl和 ,则HCl和 反应的反应热 反应的反应热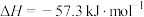 |
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是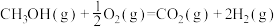 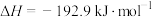 ,则 ,则 的标准燃烧热 的标准燃烧热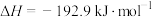 |
C.已知  ; ;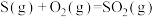  ,则 ,则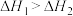 |
D.葡萄糖的标准燃烧热 ,则 ,则 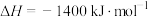 |
您最近一年使用:0次
4 . 乙醇为一种生质燃料,可由葡萄糖经生物发酵作用生成。葡萄糖可从光合作用产生,以淀粉或纤维素形式储存。葡萄糖发酵时除产生乙醇外,也同时生成产物甲。已知相关分子的摩尔生成热分别为二氧化碳: 、乙醇:
、乙醇: 、葡萄糖:
、葡萄糖: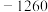 、水:
、水: (
( )。下列相关的叙述,哪些选项正确?
)。下列相关的叙述,哪些选项正确?
 、乙醇:
、乙醇: 、葡萄糖:
、葡萄糖: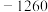 、水:
、水: (
( )。下列相关的叙述,哪些选项正确?
)。下列相关的叙述,哪些选项正确?| A.产物甲为水 |
| B.葡萄糖发酵生成乙醇为放热反应 |
| C.从淀粉及纤维素产生葡萄糖,均需经过水解 |
| D.葡萄糖经过发酵,所产生的乙醇与产物甲,两者物质的量相同 |
| E.葡萄糖发酵取得的乙醇,其燃烧的反应热,比直接将原本的葡萄糖燃烧所产生的热量多 |
您最近一年使用:0次
名校
5 . 下列热化学方程正确的是( 的绝对值均正确)
的绝对值均正确)
 的绝对值均正确)
的绝对值均正确)A.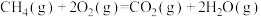 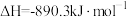 (燃烧热) (燃烧热) |
B. 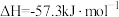 (中和热) (中和热) |
C.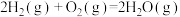 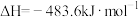 (反应热) (反应热) |
D.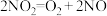 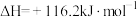 (反应热) (反应热) |
您最近一年使用:0次
2022-07-01更新
|
327次组卷
|
6卷引用:2016-2017学年四川省资阳市高二上学期期末化学试卷
6 . H2在O2中燃烧的能量变化如图所示。

下列叙述错误的是

下列叙述错误的是
| A.1molH2O(g)的能量比1molH2O(l)高44kJ |
| B.过程II生成的O-H键比过程III生成的O-H键更牢固 |
C.过程I可表示为:H2(g)+ O2(g)=O(g)+2H(g)△H=+685kJ·mol-1 O2(g)=O(g)+2H(g)△H=+685kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(g)的△H等于-244kJ·mol-1 |
您最近一年使用:0次
2022-05-13更新
|
220次组卷
|
2卷引用:山东省潍坊安丘市、高密市、诸城市2021-2022学年高一下学期期中考试化学试题
名校
解题方法
7 . 下列热化学方程式中,能表示相应物质的燃烧热的是。
A. 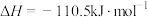 |
B. 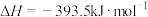 |
C.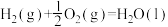 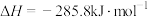 |
D.  |
您最近一年使用:0次
2022-04-13更新
|
126次组卷
|
2卷引用:河北省唐山市滦南县第一中学2021-2022学年高二上学期10月月考化学试题
名校
解题方法
8 . 下列推论不正确的是
A.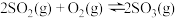 ⇌ ⇌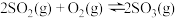 为放热反应,则 为放热反应,则 的能量一定高于 的能量一定高于 的能量 的能量 |
B.C(s,石墨)=C(s,金刚石)  ,则石墨比金刚石稳定 ,则石墨比金刚石稳定 |
C.葡萄糖的燃烧热是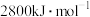 ,则 ,则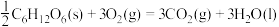  |
D. 时, 时, 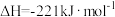 ,则碳的燃烧热为110.5KJ/mol ,则碳的燃烧热为110.5KJ/mol |
您最近一年使用:0次
2022-01-18更新
|
436次组卷
|
4卷引用:湖南省岳阳市临湘市2021-2022学年高二上学期期末教学质量检测化学试题
9 . 已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.6kJ·mol-1.以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的图示与过程如图:
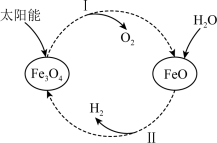
过程Ⅰ:……
过程Ⅱ:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=+129.2kJ·mol-1
下列说法正确的是

过程Ⅰ:……
过程Ⅱ:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=+129.2kJ·mol-1
下列说法正确的是
| A.该过程能量转化形式是太阳能→化学能→热能 |
B.过程Ⅰ热化学方程式为:Fe3O4(s)=3FeO(s)+ O2(g) ΔH=-156.6kJ·mol-1 O2(g) ΔH=-156.6kJ·mol-1 |
| C.氢气的燃烧热为ΔH=-285.8 kJ·mol-1 |
| D.铁氧化合物循环制H2具有成本低、产物易分离等优点 |
您最近一年使用:0次
2021-12-29更新
|
495次组卷
|
2卷引用:河北省盐山中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
10 . 天然气的主要成分为CH4,一般还含有C2H6等烃类,重要的燃料和化工原料。乙烷在一定条件可发生如下反应:C2H6(g)→C2H4(g)+H2(g) ∆H,相关物质的燃烧热数据如下表所示:
下列说法不正确的是
| 物质 | C2H6(g) | C2H4(g) | H2(g) |
| 燃烧热∆H/(kJ/mol) | -1560 | -1411 | -286 |
| A.燃烧热指在101kpa时,1mol纯物质完全燃烧生成指定产物时所放出的热量 |
| B.∆H=-137kJ/mol |
| C.提高该反应平衡转化率的方法有升高温度、减小压强 |
D.容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=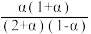 ×p(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数) ×p(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数) |
您最近一年使用:0次



