解题方法
1 . 将 转化为
转化为 ,其主要反应如下:
,其主要反应如下:
碳氯化:
直接氯化:
在 ,将
,将 以物质的量比
以物质的量比 进行反应。体系中气体的平衡分压
进行反应。体系中气体的平衡分压 随温度变化如题图所示。
随温度变化如题图所示。

已知:用气体物质的分压代替浓度计算得到的平衡常数称为分压平衡常数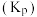 。下列说法正确的是
。下列说法正确的是
 转化为
转化为 ,其主要反应如下:
,其主要反应如下:碳氯化:

直接氯化:

在
 ,将
,将 以物质的量比
以物质的量比 进行反应。体系中气体的平衡分压
进行反应。体系中气体的平衡分压 随温度变化如题图所示。
随温度变化如题图所示。
已知:用气体物质的分压代替浓度计算得到的平衡常数称为分压平衡常数
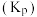 。下列说法正确的是
。下列说法正确的是A.反应 |
| B.碳氯化的反应趋势远小于直接氯化 |
C. 时,反应 时,反应 的分压平衡常数 的分压平衡常数 |
D.生产中采用 进行的原因是提高 进行的原因是提高 的转化率 的转化率 |
您最近一年使用:0次
名校
2 . 氢能是一种重要能源,氢气的制备与储存是研究热点。
Ⅰ.一种电热化学循环制氢的方法如图所示。熔融电解质成分为 。
。

(1)500℃时, 能与熔融电解质发生反应:
能与熔融电解质发生反应: +CO2↑,“电化学还原”步骤中,阴极的电极反应式为
+CO2↑,“电化学还原”步骤中,阴极的电极反应式为___________ 。
Ⅱ.储氢的研究包括材料吸氢和脱氢的过程。 和
和 都是氢容量(单位质量储氢材料储存
都是氢容量(单位质量储氢材料储存 的质量)较大的储氢材料。
的质量)较大的储氢材料。
(2) 、
、 及两者混合制成的复合储氢材料脱氢反应的热化学方程式如下:
及两者混合制成的复合储氢材料脱氢反应的热化学方程式如下:



① 的原因是
的原因是___________ 。
②储氢材料脱氢的能量变化如图所示。三种材料中脱氢焓[ (脱氢)]最小的是
(脱氢)]最小的是___________ (填“ ”、“
”、“ ”或“复合储氢材料”)。
”或“复合储氢材料”)。

(3)Ti元素有+2、+3、+4等多种价态。向 中添加适量Ti元素后可以加快其释放
中添加适量Ti元素后可以加快其释放 的速率,其机理示意图如图所示。
的速率,其机理示意图如图所示。

①图中 表示的微粒是
表示的微粒是___________ (用微粒符号表示)。
② 释放
释放 速率加快的机理可描述为:
速率加快的机理可描述为:___________ 、 、
、___________ (用方程式表示反应机理)。
Ⅰ.一种电热化学循环制氢的方法如图所示。熔融电解质成分为
 。
。
(1)500℃时,
 能与熔融电解质发生反应:
能与熔融电解质发生反应: +CO2↑,“电化学还原”步骤中,阴极的电极反应式为
+CO2↑,“电化学还原”步骤中,阴极的电极反应式为Ⅱ.储氢的研究包括材料吸氢和脱氢的过程。
 和
和 都是氢容量(单位质量储氢材料储存
都是氢容量(单位质量储氢材料储存 的质量)较大的储氢材料。
的质量)较大的储氢材料。(2)
 、
、 及两者混合制成的复合储氢材料脱氢反应的热化学方程式如下:
及两者混合制成的复合储氢材料脱氢反应的热化学方程式如下:


①
 的原因是
的原因是②储氢材料脱氢的能量变化如图所示。三种材料中脱氢焓[
 (脱氢)]最小的是
(脱氢)]最小的是 ”、“
”、“ ”或“复合储氢材料”)。
”或“复合储氢材料”)。
(3)Ti元素有+2、+3、+4等多种价态。向
 中添加适量Ti元素后可以加快其释放
中添加适量Ti元素后可以加快其释放 的速率,其机理示意图如图所示。
的速率,其机理示意图如图所示。
①图中
 表示的微粒是
表示的微粒是②
 释放
释放 速率加快的机理可描述为:
速率加快的机理可描述为: 、
、
您最近一年使用:0次
3 . 碘与氢气反应的热化学方程式是
①
②
下列说法正确的是
①

②

下列说法正确的是
| A.①的产物比②的产物稳定 |
B. |
| C.②的反应物总能量比①的反应物总能量低 |
D.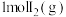 中通入 中通入 ,发生反应时放热9.48kJ ,发生反应时放热9.48kJ |
您最近一年使用:0次
4 . 一定条件下,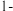 苯基丙炔(
苯基丙炔( )可与
)可与 发生催化加成,反应如下:
发生催化加成,反应如下:不正确 的是
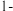 苯基丙炔(
苯基丙炔( )可与
)可与 发生催化加成,反应如下:
发生催化加成,反应如下:
| A.反应焓变:反应I>反应Ⅱ |
| B.反应活化能:反应I<反应Ⅱ |
C.增加 浓度可增加平衡时产物Ⅱ和产物I的比例 浓度可增加平衡时产物Ⅱ和产物I的比例 |
| D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ |
您最近一年使用:0次
2023-06-21更新
|
7515次组卷
|
28卷引用:江苏省扬州中学2023-2024学年高三上学期10月月考化学试题
江苏省扬州中学2023-2024学年高三上学期10月月考化学试题江苏省海安高级中学2023-2024学年高三上学期11月月考化学试题2023年高考浙江卷化学真题(6月)(已下线)2023年高考浙江卷化学真题(6月)变式题(选择题11-16)(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第23讲化学反应与热能(已下线)第26讲化学反应速率及影响因素(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)辽宁省东北育才学校2023-2024学年高二上学期第一次月考化学试题(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷浙江省杭州第二中学2023-2024学年高二上学期期中考试化学试题山东省实验中学2023-2024学年高三上学期11月二诊化学试题(已下线)题型06 反应热的判断及计算-2024年高考化学答题技巧与模板构建陕西省西安中学2023-2024学年高三(实验版)上学期12月练考理科综合试题(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题03 化学平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)题型12 化学平衡图表分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)06-2023新东方高二上期中考化学10-2023新东方高二上期中考化学湖南省岳阳市第一中学2023-2024学年高三下学期开学化学试题湖北省沙市中学2023-2024学年高三下学期3月月考化学试题浙江省余姚中学2023-2024学年高二下学期3月质量检测化学试题2024届南昌市第十九中学高三下学期模拟预测化学试题江西省南昌市八一中学2024届高三下学期三模测试化学试题
解题方法
5 . 回收利用含硫化合物有利于节约资源、保护环境。
(1)一种由含 的烟气回收硫磺的工艺为:将一部分含
的烟气回收硫磺的工艺为:将一部分含 的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到单质硫
的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到单质硫 ,该工艺中涉及反应为:
,该工艺中涉及反应为:
反应1: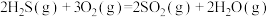

反应2: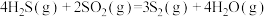
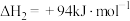
反应3: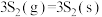
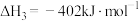
①反应
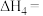
________ 。
②如果上述反应均能完全进行,为提高硫磺的产率,该工艺中需要控制反应1和反应2的烟气的体积比是________ 。
(2)一种以 为原料,循环吸收烟气中
为原料,循环吸收烟气中 的物质转化关系如下,写出转化中由
的物质转化关系如下,写出转化中由 制
制 同时生成硫酸铵的化学反应方程式:
同时生成硫酸铵的化学反应方程式:________ 。

(3)一种以 为催化剂载体、
为催化剂载体、 为催化剂的
为催化剂的 还原烟气中
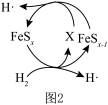
还原烟气中 制S的反应机理如题图1和题图2所示:
制S的反应机理如题图1和题图2所示:
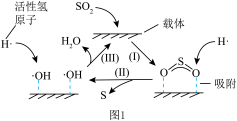
①图1中所示转化可以描述为 分解为活性氢原子,
分解为活性氢原子,________ 。
②图2中X的电子式为________ 。
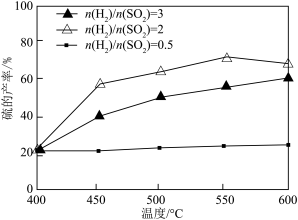
③其他条件一定,改变起始时 与
与 的比例,反应相同时间,测得S的产率与温度和
的比例,反应相同时间,测得S的产率与温度和 比值的关系如题图所示,500℃时,
比值的关系如题图所示,500℃时, 比值为3时硫的产率小于比值为2时的原因是
比值为3时硫的产率小于比值为2时的原因是________ 。
(1)一种由含
 的烟气回收硫磺的工艺为:将一部分含
的烟气回收硫磺的工艺为:将一部分含 的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到单质硫
的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到单质硫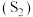 ,该工艺中涉及反应为:
,该工艺中涉及反应为:反应1:
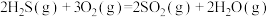

反应2:
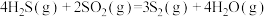
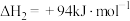
反应3:
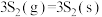
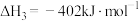
①反应

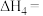
②如果上述反应均能完全进行,为提高硫磺的产率,该工艺中需要控制反应1和反应2的烟气的体积比是
(2)一种以
 为原料,循环吸收烟气中
为原料,循环吸收烟气中 的物质转化关系如下,写出转化中由
的物质转化关系如下,写出转化中由 制
制 同时生成硫酸铵的化学反应方程式:
同时生成硫酸铵的化学反应方程式:
(3)一种以
 为催化剂载体、
为催化剂载体、 为催化剂的
为催化剂的 还原烟气中
还原烟气中 制S的反应机理如题图1和题图2所示:
制S的反应机理如题图1和题图2所示:

①图1中所示转化可以描述为
 分解为活性氢原子,
分解为活性氢原子,②图2中X的电子式为
③其他条件一定,改变起始时
 与
与 的比例,反应相同时间,测得S的产率与温度和
的比例,反应相同时间,测得S的产率与温度和 比值的关系如题图所示,500℃时,
比值的关系如题图所示,500℃时, 比值为3时硫的产率小于比值为2时的原因是
比值为3时硫的产率小于比值为2时的原因是
您最近一年使用:0次
6 . 通过反应Ι:CO2(g)+3H2(g) CH3OH(g)+H2O(g)可以实现CO2捕获并资源化利用。密闭容器中,反应物起始物质的量比
CH3OH(g)+H2O(g)可以实现CO2捕获并资源化利用。密闭容器中,反应物起始物质的量比 =3时,在不同条件下(分别在温度为250℃下压强变化和在压强为5×105Pa下温度变化)达到平衡时CH3OH物质的量分数变化如下图所示,主要反应如下:
=3时,在不同条件下(分别在温度为250℃下压强变化和在压强为5×105Pa下温度变化)达到平衡时CH3OH物质的量分数变化如下图所示,主要反应如下:
反应II:CO2(g)+H2(g) CO(g)+H2O(g)ΔH2=+42.5kJ·mol-1
CO(g)+H2O(g)ΔH2=+42.5kJ·mol-1
反应Ⅲ:CO(g)+2H2(g) CH3OH(g)ΔH3=—90.7kJ·mol-1
CH3OH(g)ΔH3=—90.7kJ·mol-1

下列说法正确的是
 CH3OH(g)+H2O(g)可以实现CO2捕获并资源化利用。密闭容器中,反应物起始物质的量比
CH3OH(g)+H2O(g)可以实现CO2捕获并资源化利用。密闭容器中,反应物起始物质的量比 =3时,在不同条件下(分别在温度为250℃下压强变化和在压强为5×105Pa下温度变化)达到平衡时CH3OH物质的量分数变化如下图所示,主要反应如下:
=3时,在不同条件下(分别在温度为250℃下压强变化和在压强为5×105Pa下温度变化)达到平衡时CH3OH物质的量分数变化如下图所示,主要反应如下:反应II:CO2(g)+H2(g)
 CO(g)+H2O(g)ΔH2=+42.5kJ·mol-1
CO(g)+H2O(g)ΔH2=+42.5kJ·mol-1反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g)ΔH3=—90.7kJ·mol-1
CH3OH(g)ΔH3=—90.7kJ·mol-1
下列说法正确的是
| A.反应Ι的ΔH1=+48.2kJ·mol-1 |
| B.曲线②表示CH3OH的物质的量分数随压强的变化 |
C.一定温度下,增大 的比值,可提高CO2平衡转化率 的比值,可提高CO2平衡转化率 |
D.在5×105Pa、250℃、起始 =3条件下,使用高效催化剂,能使CH3OH物质的量分数从X点达到Y点 =3条件下,使用高效催化剂,能使CH3OH物质的量分数从X点达到Y点 |
您最近一年使用:0次
名校
7 . 近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。
(1)Deacon直接氧化法可按下列催化过程进行:
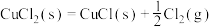
 kJ⋅mol
kJ⋅mol

 kJ⋅mol
kJ⋅mol

 kJ⋅mol
kJ⋅mol
则 的
的
_______ kJ⋅mol 。
。
(2)工业上可通过天然气跟水蒸气反应制取 :
: ,有关反应的能量变化如下图所示,则该反应的
,有关反应的能量变化如下图所示,则该反应的
_______ (用含a、b、c的式子表示)。

(3)二氧化碳加氢制甲醇的总反应可表示为: 。该反应一般认为通过如下步骤来实现:
。该反应一般认为通过如下步骤来实现:
①
 kJ·mol
kJ·mol
②
 kJ·mol
kJ·mol
总反应的
_______ kJ⋅mol ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是_______ (填标号),判断的理由是_______ 。

(1)Deacon直接氧化法可按下列催化过程进行:
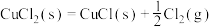
 kJ⋅mol
kJ⋅mol

 kJ⋅mol
kJ⋅mol

 kJ⋅mol
kJ⋅mol
则
 的
的
 。
。(2)工业上可通过天然气跟水蒸气反应制取
 :
: ,有关反应的能量变化如下图所示,则该反应的
,有关反应的能量变化如下图所示,则该反应的

(3)二氧化碳加氢制甲醇的总反应可表示为:
 。该反应一般认为通过如下步骤来实现:
。该反应一般认为通过如下步骤来实现:①

 kJ·mol
kJ·mol
②

 kJ·mol
kJ·mol
总反应的

 ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
您最近一年使用:0次
2023-06-20更新
|
239次组卷
|
3卷引用:江苏省南京航空航天大学苏州附属中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
8 . 氮的化合物是重要的化工原料,其转化一直是化学研究的热点。
(1)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:
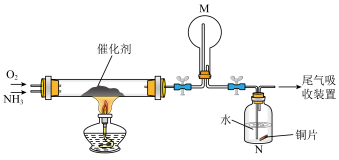
①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为___________ 。
②一段时间后,观察到装置M中有白烟生成,该白烟成分是___________ (写化学式)。
(2)选择性催化还原法(SCR)工艺是以NH3 为还原剂,在催化剂作用下选择性地与NOx发生氧化还原反应生成无害化的N2和H2O。
已知:4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H1=-905.8 kJ/mol
N2(g)+ O2(g)=2NO(g) △H2 = +180 kJ/mol
则NH3与NO反应的热化学方程式为:___________ 。
(3)可用ClO2将氮氧化物转化成 。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为___________ 。
(4)纳米铁粉可去除水体中的 。
。
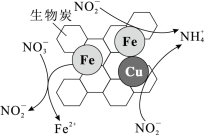
①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是___________ 。
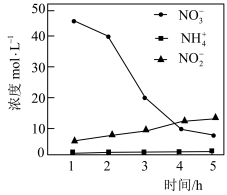
②控制其他条件不变,用纳米铁粉还原水体中的 ,测得溶液中含氮物质(
,测得溶液中含氮物质( 、
、 、
、 )浓度随时间变化如图所示。与初始溶液中
)浓度随时间变化如图所示。与初始溶液中 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质( 、
、 、
、 )总浓度减小,原因是
)总浓度减小,原因是___________ 。
(1)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:

①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为
②一段时间后,观察到装置M中有白烟生成,该白烟成分是
(2)选择性催化还原法(SCR)工艺是以NH3 为还原剂,在催化剂作用下选择性地与NOx发生氧化还原反应生成无害化的N2和H2O。
已知:4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H1=-905.8 kJ/mol
N2(g)+ O2(g)=2NO(g) △H2 = +180 kJ/mol
则NH3与NO反应的热化学方程式为:
(3)可用ClO2将氮氧化物转化成
 。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为(4)纳米铁粉可去除水体中的
 。
。①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中
 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是
②控制其他条件不变,用纳米铁粉还原水体中的
 ,测得溶液中含氮物质(
,测得溶液中含氮物质( 、
、 、
、 )浓度随时间变化如图所示。与初始溶液中
)浓度随时间变化如图所示。与初始溶液中 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质( 、
、 、
、 )总浓度减小,原因是
)总浓度减小,原因是
您最近一年使用:0次
9 . 研发二氧化碳利用技术、降低空气中二氧化碳含量成为研究热点。
(1)减少碳排放的方法有很多,CO2转化成有机化合物可有效实现碳循环,如下反应:
a.
b.
c.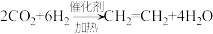
上述反应中原子利用率最高的是_____ (填编号)。
(2) 在固体催化表面加氢合成甲烷过程中发生以下两个反应:
在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应: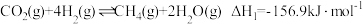
副反应:
已知: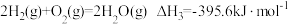 ,
,
则 燃烧的热化学方程式
燃烧的热化学方程式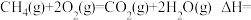
_____ 。
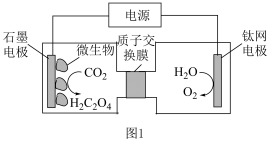
(3)利用电化学方法通过微生物电催化将 有效地转化为
有效地转化为 ,装置如图1所示。阴极区电极反应式为
,装置如图1所示。阴极区电极反应式为_____ ;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因是_____ 。
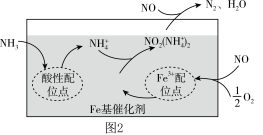
(4)研究脱除烟气中的 是环境保护、促进社会可持续发展的重要课题。有氧条件下,在
是环境保护、促进社会可持续发展的重要课题。有氧条件下,在 基催化剂表面,
基催化剂表面, 还原
还原 的反应机理如图2所示,该过程可描述为
的反应机理如图2所示,该过程可描述为_____ 。
(5)近年来,低温等离子技术是在高压放电下,O2产生 自由基,
自由基, 自由基将NO氧化为NO2后,再用Na2CO3溶液吸收,达到消除NO的目的。实验室将模拟气(N2、O2、NO)以一定流速通入低温等离子体装置,实验装置如图3所示。
自由基将NO氧化为NO2后,再用Na2CO3溶液吸收,达到消除NO的目的。实验室将模拟气(N2、O2、NO)以一定流速通入低温等离子体装置,实验装置如图3所示。
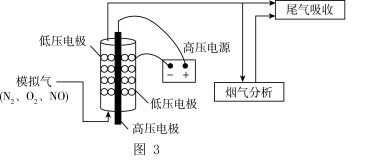
①等离子体技术在低温条件下可提高 的转化率,原因是
的转化率,原因是_____ 。
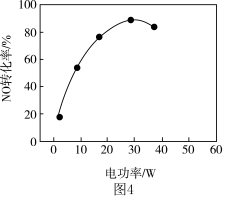
②其他条件相同,等离子体的电功率与 的转化率关系如图4所示,当电功率大于
的转化率关系如图4所示,当电功率大于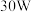 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是_____ 。
(1)减少碳排放的方法有很多,CO2转化成有机化合物可有效实现碳循环,如下反应:
a.

b.

c.
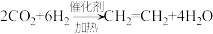
上述反应中原子利用率最高的是
(2)
 在固体催化表面加氢合成甲烷过程中发生以下两个反应:
在固体催化表面加氢合成甲烷过程中发生以下两个反应:主反应:
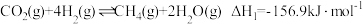
副反应:

已知:
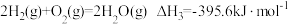 ,
,则
 燃烧的热化学方程式
燃烧的热化学方程式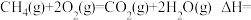
(3)利用电化学方法通过微生物电催化将
 有效地转化为
有效地转化为 ,装置如图1所示。阴极区电极反应式为
,装置如图1所示。阴极区电极反应式为

(4)研究脱除烟气中的
 是环境保护、促进社会可持续发展的重要课题。有氧条件下,在
是环境保护、促进社会可持续发展的重要课题。有氧条件下,在 基催化剂表面,
基催化剂表面, 还原
还原 的反应机理如图2所示,该过程可描述为
的反应机理如图2所示,该过程可描述为(5)近年来,低温等离子技术是在高压放电下,O2产生
 自由基,
自由基, 自由基将NO氧化为NO2后,再用Na2CO3溶液吸收,达到消除NO的目的。实验室将模拟气(N2、O2、NO)以一定流速通入低温等离子体装置,实验装置如图3所示。
自由基将NO氧化为NO2后,再用Na2CO3溶液吸收,达到消除NO的目的。实验室将模拟气(N2、O2、NO)以一定流速通入低温等离子体装置,实验装置如图3所示。

①等离子体技术在低温条件下可提高
 的转化率,原因是
的转化率,原因是②其他条件相同,等离子体的电功率与
 的转化率关系如图4所示,当电功率大于
的转化率关系如图4所示,当电功率大于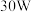 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是
您最近一年使用:0次
2023-06-14更新
|
835次组卷
|
4卷引用:江苏省盐城中学2023届高三第二次模拟考试(4月)化学试题
解题方法
10 . 利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
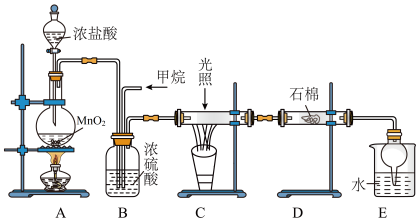
(1)A中制取Cl2反应的化学方程式是_______ 。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体;③_______ 。
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_______ 。
(4)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值为_______ 。
(5)常温常压下,1.6g甲烷完全燃烧生成二氧化碳和水放出89.03kJ热量,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H =_______ kJ·mol-1
(6)图是某种甲烷燃料电池原理示意图:
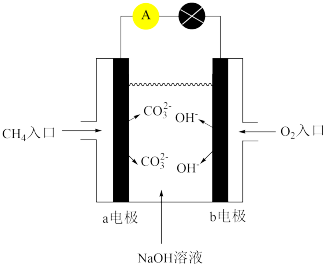
①电池的正极是_______ (填“a”或“b”)电极。
②电池工作一段时间后电解质溶液中c(OH-)_______ (填”增大”“减小”或“不变”)。

(1)A中制取Cl2反应的化学方程式是
(2)B装置有三种功能:①控制气流速度;②均匀混合气体;③
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:
(4)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值为
(5)常温常压下,1.6g甲烷完全燃烧生成二氧化碳和水放出89.03kJ热量,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H =
(6)图是某种甲烷燃料电池原理示意图:

①电池的正极是
②电池工作一段时间后电解质溶液中c(OH-)
您最近一年使用:0次



