名校
解题方法
1 . 生产、生活中产生的废水、废气是环境污染的重要源头。在环境治理方面人们可利用I2O5和Na2SO3等化工产品实现对废水和废气的治理。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为________ 。
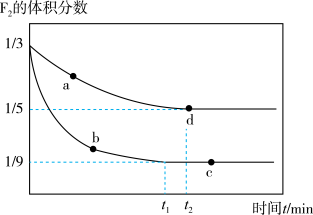
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g) 5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
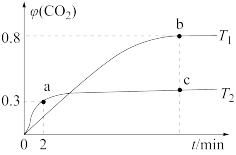
①温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=________ 。
②b点时CO的转化率为__________ ,化学反应的平衡常数K=_______ (填表达式)。
③反应:I2O5(s)+5CO(g) 5CO2(g)+I2(s)的ΔH
5CO2(g)+I2(s)的ΔH______ 0(填“>”“<”或“=”)。
④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________ (填“向左”“向右”或“不”)移动。
⑤下列现象,可以表示上述反应达到平衡状态的是________ (填字母)。
A.容器内的压强不再变化
B.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
C.混合气的密度不再变化
D.混合气的平均相对分子质量不再变化
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:①Na2SO3(aq)+Cl2(g)+H2O(l) =Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol−1
②Cl2(g)+H2O(l) =HCl(aq)+HClO(aq) ΔH2=b kJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:___________ 。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g)
 5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
①温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=
②b点时CO的转化率为
③反应:I2O5(s)+5CO(g)
 5CO2(g)+I2(s)的ΔH
5CO2(g)+I2(s)的ΔH④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡
⑤下列现象,可以表示上述反应达到平衡状态的是
A.容器内的压强不再变化
B.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
C.混合气的密度不再变化
D.混合气的平均相对分子质量不再变化
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:①Na2SO3(aq)+Cl2(g)+H2O(l) =Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol−1
②Cl2(g)+H2O(l) =HCl(aq)+HClO(aq) ΔH2=b kJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:
您最近一年使用:0次
2020-11-25更新
|
164次组卷
|
6卷引用:湖南省衡阳市26中2017-2018学年高二上学期期中考试化学试题
2 . 生产生活中排放的废气废水有一定量的氨氮化合物,必须通过处理后达到国家规定的排放标准再排放,以下为两种处理氨氮化合物的方法。
Ⅰ.催化氧化法:某学习小组模拟氨气的催化氧化,向恒温恒容密闭容器内充入4mol 和3mol
和3mol ,在加热和催化剂的作用下存在如下反应;
,在加热和催化剂的作用下存在如下反应;
反应①(主);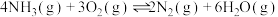
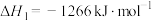
反应②(副):
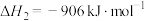
反应③(副):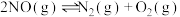

(1)反应③NO在催化剂作用下分解,也是一种消除污染的方法,其 为
为___________  。
。
(2)下列说法正确的是___________ (填标号)。
a.反应①在任何温度下均能自发进行
b.混合气体的密度不变说明体系已达到平衡
c.在实际中,需采用高压氧化,以利于提高 的生成量
的生成量
(3)体系平衡时, 的物质的量为amol,
的物质的量为amol, 的物质的量为bmol。此时,
的物质的量为bmol。此时, 的物质的量为
的物质的量为___________ mol(用含a、b的代数式表示,下同),反应③的平衡常数K=___________ 。
Ⅱ.三维电极法:它是在传统的电解槽两电极之间填充粒状或碎屑状材料,填充的粒子电极表面能带电,成为新的一极(第三极)。如图为用三维电极法处理氨氮废水的原理图,石墨板作为阴、阳极,自制活性炭为填充材料,电解一定浓度的 、
、 与NaCl的酸性混合溶液来进行模拟。
与NaCl的酸性混合溶液来进行模拟。

(4)电解时,阳极的电极反应式为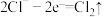 、
、___________ 。
(5)该装置可以生成大量氧化性更强的·OH,写出·OH去除 的离子方程式:
的离子方程式:______________________ 。
(6)相比于传统的二维电极反应系统,三维电极有哪些优点?试述其优点:___________ (答出一种,合理即可)。
Ⅰ.催化氧化法:某学习小组模拟氨气的催化氧化,向恒温恒容密闭容器内充入4mol
 和3mol
和3mol ,在加热和催化剂的作用下存在如下反应;
,在加热和催化剂的作用下存在如下反应;反应①(主);
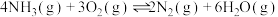
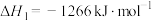
反应②(副):

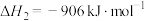
反应③(副):
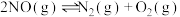

(1)反应③NO在催化剂作用下分解,也是一种消除污染的方法,其
 为
为 。
。(2)下列说法正确的是
a.反应①在任何温度下均能自发进行
b.混合气体的密度不变说明体系已达到平衡
c.在实际中,需采用高压氧化,以利于提高
 的生成量
的生成量(3)体系平衡时,
 的物质的量为amol,
的物质的量为amol, 的物质的量为bmol。此时,
的物质的量为bmol。此时, 的物质的量为
的物质的量为Ⅱ.三维电极法:它是在传统的电解槽两电极之间填充粒状或碎屑状材料,填充的粒子电极表面能带电,成为新的一极(第三极)。如图为用三维电极法处理氨氮废水的原理图,石墨板作为阴、阳极,自制活性炭为填充材料,电解一定浓度的
 、
、 与NaCl的酸性混合溶液来进行模拟。
与NaCl的酸性混合溶液来进行模拟。
(4)电解时,阳极的电极反应式为
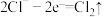 、
、(5)该装置可以生成大量氧化性更强的·OH,写出·OH去除
 的离子方程式:
的离子方程式:(6)相比于传统的二维电极反应系统,三维电极有哪些优点?试述其优点:
您最近一年使用:0次
名校
解题方法
3 . (1)①Na2CO3俗称纯碱,其水溶液呈碱性,原因是________________________ (用离子方程式解释);
②常温下,0.050 0 mol/L硫酸溶液的pH=__________ ;
③用0.010 0 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为__________ (填“蓝色”或“浅红色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=__________ kJ/mol;
②已知:C(石墨,s)===C(金刚石,s) ΔH>0,则稳定性石墨比金刚石________ (填“强”或“弱”)。
(3)在某恒容密闭容器中进行可逆反应FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH>0,平衡常数表达式为K= 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________ (填“正反应”或“逆反应”)方向移动;
②若降低温度,平衡常数K__________ (填“增大”“减小”或“不变”);
③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________ (填“达到”或“未达到”)平衡状态。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
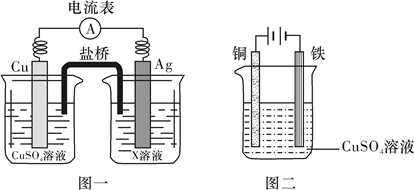
①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液是__________ (填“CuSO4”或“AgNO3”)溶液;
②图二装置在铁件上镀铜,铁作阴极,则阴极上的电极反应式是__________________________ 。
②常温下,0.050 0 mol/L硫酸溶液的pH=
③用0.010 0 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为
(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=
②已知:C(石墨,s)===C(金刚石,s) ΔH>0,则稳定性石墨比金刚石
(3)在某恒容密闭容器中进行可逆反应FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH>0,平衡常数表达式为K=
 。
。①反应达到平衡后,向容器中通入CO,化学平衡向
②若降低温度,平衡常数K
③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。

①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液是
②图二装置在铁件上镀铜,铁作阴极,则阴极上的电极反应式是
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题
(1)①甲烷可用于生产合成气,反应为:
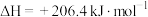 ,已知几种物质中化学键的键能如下表所示:则a=
,已知几种物质中化学键的键能如下表所示:则a=___________ 。
②科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:

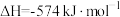


则甲烷直接将 还原为
还原为 的热化学方程式为
的热化学方程式为___________ 。
(2)铁在一定条件下可与 反应,
反应,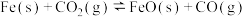 。向2 L恒容密闭容器中加入还原性铁粉并充入一定量的
。向2 L恒容密闭容器中加入还原性铁粉并充入一定量的 气体,恒温条件下,反应过程中的气体浓度随时间变化如图所示。
气体,恒温条件下,反应过程中的气体浓度随时间变化如图所示。
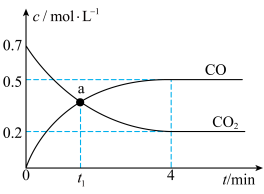
①下列条件的改变能使上述反应的化学反应速率降低的是___________ (填字母)。
a.降低反应温度 b.充入He气 c.充入 d.用铁块代替铁粉
d.用铁块代替铁粉
②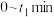 内,用
内,用 表示的反应速率为
表示的反应速率为___________ (用含 的表达式表示)。
的表达式表示)。
③下列描述中能说明上述反应已达到化学平衡状态的是___________ (填字母)。
a.
b.容器中混合气体的密度不随时间而变化
c.容器中混合气体的压强不随时间而变化
d.单位时间内生成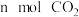 的同时消耗
的同时消耗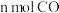
e.容器中混合气体的平均相对分子质量不随时间而变化
(3)小苏打溶液中除了 的电离平衡外,还存在的平衡有
的电离平衡外,还存在的平衡有___________ (用离子方程式表示)。根据小苏打溶液的酸碱性,可知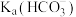
___________  (填“>”、“<”或“=”)。向小苏打溶液中加入氯化铁溶液,相关反应的离子方程式为
(填“>”、“<”或“=”)。向小苏打溶液中加入氯化铁溶液,相关反应的离子方程式为___________ 。
(1)①甲烷可用于生产合成气,反应为:

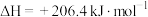 ,已知几种物质中化学键的键能如下表所示:则a=
,已知几种物质中化学键的键能如下表所示:则a=| 化学键 |  |  |  |  |
键能/( ) ) | 436 | 465 | a | 1076 |

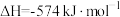


则甲烷直接将
 还原为
还原为 的热化学方程式为
的热化学方程式为(2)铁在一定条件下可与
 反应,
反应,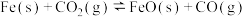 。向2 L恒容密闭容器中加入还原性铁粉并充入一定量的
。向2 L恒容密闭容器中加入还原性铁粉并充入一定量的 气体,恒温条件下,反应过程中的气体浓度随时间变化如图所示。
气体,恒温条件下,反应过程中的气体浓度随时间变化如图所示。
①下列条件的改变能使上述反应的化学反应速率降低的是
a.降低反应温度 b.充入He气 c.充入
 d.用铁块代替铁粉
d.用铁块代替铁粉②
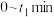 内,用
内,用 表示的反应速率为
表示的反应速率为 的表达式表示)。
的表达式表示)。③下列描述中能说明上述反应已达到化学平衡状态的是
a.

b.容器中混合气体的密度不随时间而变化
c.容器中混合气体的压强不随时间而变化
d.单位时间内生成
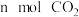 的同时消耗
的同时消耗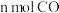
e.容器中混合气体的平均相对分子质量不随时间而变化
(3)小苏打溶液中除了
 的电离平衡外,还存在的平衡有
的电离平衡外,还存在的平衡有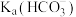
 (填“>”、“<”或“=”)。向小苏打溶液中加入氯化铁溶液,相关反应的离子方程式为
(填“>”、“<”或“=”)。向小苏打溶液中加入氯化铁溶液,相关反应的离子方程式为
您最近一年使用:0次
5 . 异丁烯是一种重要的化工原料,主要用于制备甲基叔丁基醚、丁基橡胶、甲基丙烯腈等。将异丁烷脱氢制备异丁烯,可提高异丁烷的附加值,具有良好的经济与社会效益。回答下列问题。
(1)利用下列燃烧热数据,计算异丁烷直接脱氢生成异丁烯反应的∆H:
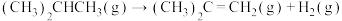 ∆H=
∆H=____________ kJ·mol-1。
(2)在恒温853K、恒压100kPa条件下,初始反应气体组成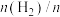 (异丁烷)或
(异丁烷)或 (异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
(异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。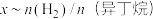 为曲线
为曲线_________ (填“M”或“N”),催化剂易被副反应产生的加聚产物__________ (填写结构简式)影响而失活。
(3)有人提出在恒温恒压条件下加入适量空气,采用异丁烷氧化脱氢的方法制备异丁烯。比较异丁烷直接脱氢制备异丁烯,从平衡产率角度分析该方法的优点是_____________ ,若生产过程中加入的空气过多,产生的主要问题是_____________ 。
(4)有人提出加入适量CO2,采用MgFe2O4催化CO2氧化异丁烷脱氢的方法制备异丁烯。催化过程中,反应物异丁烷、CO2先各自被催化剂上的不同位点吸附。催化剂中电负性较大的金属_____________ (填元素符号)是酸性位点;而电负性较小的金属是碱性位点,吸附________________ (填“异丁烷”或“CO2”)。
(1)利用下列燃烧热数据,计算异丁烷直接脱氢生成异丁烯反应的∆H:
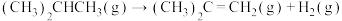 ∆H=
∆H=| 物质 | 异丁烷(g) | 异丁烯(g) | 氢气(g) |
| 燃烧热/(kJ·mol-1) | 2868 | 2700 | 286 |
(2)在恒温853K、恒压100kPa条件下,初始反应气体组成
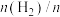 (异丁烷)或
(异丁烷)或 (异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
(异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
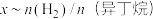 为曲线
为曲线(3)有人提出在恒温恒压条件下加入适量空气,采用异丁烷氧化脱氢的方法制备异丁烯。比较异丁烷直接脱氢制备异丁烯,从平衡产率角度分析该方法的优点是
(4)有人提出加入适量CO2,采用MgFe2O4催化CO2氧化异丁烷脱氢的方法制备异丁烯。催化过程中,反应物异丁烷、CO2先各自被催化剂上的不同位点吸附。催化剂中电负性较大的金属
您最近一年使用:0次
2024-03-22更新
|
108次组卷
|
2卷引用:湖南省衡阳市衡阳县第一中学2023-2024学年高二下学期4月期中考试化学试题
名校
6 . 研究一个化学反应时,往往需要关注反应进行的方向、快慢,反应的限度以及反应的能量变化。下面是Na2CO3等常见物质所涉及的性质和反应,请按要求填空:
(1)已知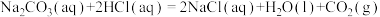
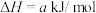
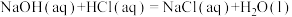
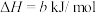
二氧化碳气体通入足量氢氧化钠溶液发生的反应为___________ 反应(填“放热”或“吸热”),其热化学方程式为___________ ( 用含a和b的代数式表示)。
用含a和b的代数式表示)。
(2)Na2CO3和盐酸反应生成CO2的速率非常大,其根本原因是___________ ,为降低反应速率,可采取的措施是___________ 。(任写两点)
(3)向滴有酚酞的Na2CO3溶液中,逐滴滴加盐酸,当溶液恰好为无色时,溶液呈___________ (填“酸性”“碱性”或“中性”),该无色溶液的电荷守恒式可表示为___________ 。(忽略酚酞对溶液中离子的影响)
(4)向Na2CO3溶液中加少量BaSO4固体,发生的离子反应方程式为___________ 。已知: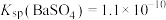 ,
,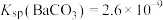 。
。
(1)已知
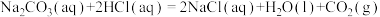
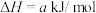
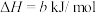
二氧化碳气体通入足量氢氧化钠溶液发生的反应为
 用含a和b的代数式表示)。
用含a和b的代数式表示)。(2)Na2CO3和盐酸反应生成CO2的速率非常大,其根本原因是
(3)向滴有酚酞的Na2CO3溶液中,逐滴滴加盐酸,当溶液恰好为无色时,溶液呈
(4)向Na2CO3溶液中加少量BaSO4固体,发生的离子反应方程式为
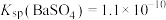 ,
,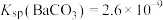 。
。
您最近一年使用:0次
2023-11-09更新
|
126次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
7 . 当今世界多国相继规划了碳达峰碳中和的时间节点。因此研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。已知:
①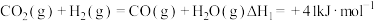
②
③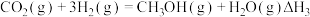
回答下列问题:
(1)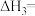
___________ 。
(2)在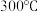 恒压密闭容器中,加入
恒压密闭容器中,加入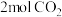 和
和 ,发生上述反应。反应达平衡时,
,发生上述反应。反应达平衡时, 的转化率为
的转化率为 ,容器体积减小
,容器体积减小 ,则反应①的平衡常数
,则反应①的平衡常数
___________ 。
(3)一定条件下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 (假设只发生反应③),相同时间内
(假设只发生反应③),相同时间内 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:
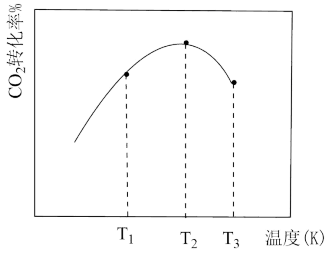
①a点为图象中最高点,a点的转化率比c点高的原因是___________ 。
②平衡时测得生成甲醇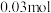 ,保持温度不变再通入
,保持温度不变再通入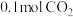 和
和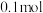 水蒸气,此时v(正)
水蒸气,此时v(正)___________ v(逆)(填“>”,“<”,“=”)。
(4)捕碳技术(主要指捕获 )在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是___________。
)在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是___________。
(5)工业生产尾气中的 捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至
捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至 后用氨水吸收过量的
后用氨水吸收过量的 。所得溶液显
。所得溶液显___________ (填“酸性”、“碱性”或“中性”)。烟气需冷却至 左右的可能原因是
左右的可能原因是___________ 。
已知: 的
的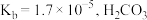 的
的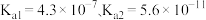 。
。
二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。已知:
①
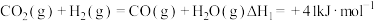
②

③
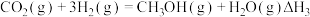
回答下列问题:
(1)
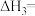
(2)在
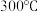 恒压密闭容器中,加入
恒压密闭容器中,加入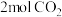 和
和 ,发生上述反应。反应达平衡时,
,发生上述反应。反应达平衡时, 的转化率为
的转化率为 ,容器体积减小
,容器体积减小 ,则反应①的平衡常数
,则反应①的平衡常数
(3)一定条件下,向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和 (假设只发生反应③),相同时间内
(假设只发生反应③),相同时间内 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:
①a点为图象中最高点,a点的转化率比c点高的原因是
②平衡时测得生成甲醇
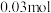 ,保持温度不变再通入
,保持温度不变再通入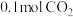 和
和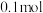 水蒸气,此时v(正)
水蒸气,此时v(正)(4)捕碳技术(主要指捕获
 )在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是___________。
)在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是___________。A. | B. | C. | D. |
 捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至
捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至 后用氨水吸收过量的
后用氨水吸收过量的 。所得溶液显
。所得溶液显 左右的可能原因是
左右的可能原因是已知:
 的
的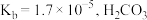 的
的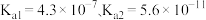 。
。
您最近一年使用:0次
2022-01-14更新
|
229次组卷
|
4卷引用:湖南省长沙市长沙县、望城区、浏阳市2021-2022学年高二上学期期末调研考试化学试题
解题方法
8 . 天然气净化和煤燃烧过程中会产生 、
、 等污染物,将其吸收和转化是保护环境和资源利用的有效措施。请回答下列问题:
等污染物,将其吸收和转化是保护环境和资源利用的有效措施。请回答下列问题:
(1)已知:氧化还原反应可拆分为氧化、还原两个半反应,电极电势分别表示为 和
和 ,电势差
,电势差 ,如
,如 的
的 ;两组电对的电势差越大,反应的自发程度越大。
;两组电对的电势差越大,反应的自发程度越大。
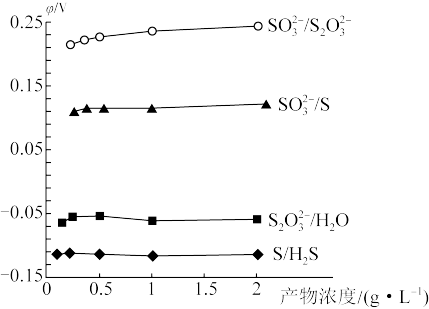
①含硫微粒各电对的电极电势与产物浓度的关系如图所示,将体系中自发程度最大的反应记为 ,反应
,反应 的离子方程式为
的离子方程式为_______ 。
②已知反应 为放热反应,当有
为放热反应,当有 发生反应
发生反应 时,释放的能量为
时,释放的能量为_______  (用含字母的代数式表示)。
(用含字母的代数式表示)。
已知各微粒的相对能量如下表:
(2) 高温裂解转化为
高温裂解转化为 和硫蒸气:
和硫蒸气:
 。
。
①在恒温恒容密闭容器中,能说明该反应已达平衡状态的是_______ (填字母)。
A.混合气体的密度不再改变 B. 容器中总压强不再改变
C.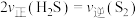 D.
D.  不再改变
不再改变
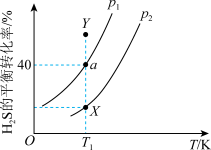
②在不同压强下, 的平衡转化率随温度变化曲线如图所示:则图中
的平衡转化率随温度变化曲线如图所示:则图中
_______ (填“ ”“
”“ ”或“
”或“ ”)
”) ;在
;在 、
、 不变的条件下,要使
不变的条件下,要使 的平衡转化率由
的平衡转化率由 点达到
点达到 点,改变的外界条件可以是
点,改变的外界条件可以是_______ ;反应温度为 、总压强为
、总压强为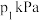 时,该反应的平衡常数
时,该反应的平衡常数
_______ (分压=总压×物质的量分数)。
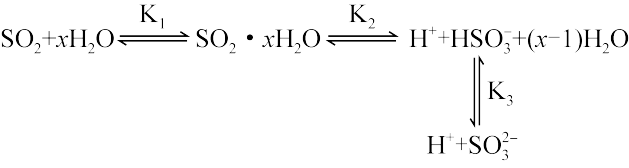
(3) 易溶于水,
易溶于水, 的水溶液中存在下列平衡:
的水溶液中存在下列平衡:
其中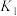 、
、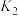 、
、 为各步的平衡常数,且
为各步的平衡常数,且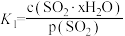 [
[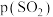 表示
表示 的平衡压强]。
的平衡压强]。
①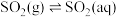 的焓变
的焓变
_______ (填“ ”或“
”或“ ”)0;当
”)0;当 的平衡压强为p时,测得
的平衡压强为p时,测得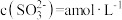 ,则溶液中
,则溶液中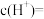
_______  (用含p、a、
(用含p、a、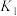 、
、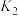 、
、 的式子表示,忽略
的式子表示,忽略 的电离)。
的电离)。
②工业上常用氨水吸收 ,将
,将 转化为
转化为 或
或 ,常温下,
,常温下, 溶液呈
溶液呈_______ (填“酸性”“碱性”或“中性”)(已知:常温下, 的
的 ,
, 的
的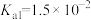 ,
,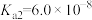 )。
)。
 、
、 等污染物,将其吸收和转化是保护环境和资源利用的有效措施。请回答下列问题:
等污染物,将其吸收和转化是保护环境和资源利用的有效措施。请回答下列问题:(1)已知:氧化还原反应可拆分为氧化、还原两个半反应,电极电势分别表示为
 和
和 ,电势差
,电势差 ,如
,如 的
的 ;两组电对的电势差越大,反应的自发程度越大。
;两组电对的电势差越大,反应的自发程度越大。①含硫微粒各电对的电极电势与产物浓度的关系如图所示,将体系中自发程度最大的反应记为
 ,反应
,反应 的离子方程式为
的离子方程式为
②已知反应
 为放热反应,当有
为放热反应,当有 发生反应
发生反应 时,释放的能量为
时,释放的能量为 (用含字母的代数式表示)。
(用含字母的代数式表示)。已知各微粒的相对能量如下表:
| 微粒 | 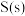 | 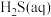 | 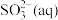 | 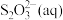 | 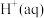 | 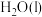 |
相对能量/( ) ) | 0 | a | b | c | d | e |
 高温裂解转化为
高温裂解转化为 和硫蒸气:
和硫蒸气:
 。
。①在恒温恒容密闭容器中,能说明该反应已达平衡状态的是
A.混合气体的密度不再改变 B. 容器中总压强不再改变
C.
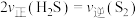 D.
D.  不再改变
不再改变②在不同压强下,
 的平衡转化率随温度变化曲线如图所示:则图中
的平衡转化率随温度变化曲线如图所示:则图中
 ”“
”“ ”或“
”或“ ”)
”) ;在
;在 、
、 不变的条件下,要使
不变的条件下,要使 的平衡转化率由
的平衡转化率由 点达到
点达到 点,改变的外界条件可以是
点,改变的外界条件可以是 、总压强为
、总压强为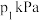 时,该反应的平衡常数
时,该反应的平衡常数

(3)
 易溶于水,
易溶于水, 的水溶液中存在下列平衡:
的水溶液中存在下列平衡:
其中
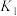 、
、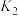 、
、 为各步的平衡常数,且
为各步的平衡常数,且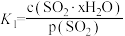 [
[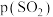 表示
表示 的平衡压强]。
的平衡压强]。①
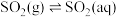 的焓变
的焓变
 ”或“
”或“ ”)0;当
”)0;当 的平衡压强为p时,测得
的平衡压强为p时,测得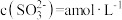 ,则溶液中
,则溶液中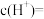
 (用含p、a、
(用含p、a、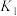 、
、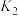 、
、 的式子表示,忽略
的式子表示,忽略 的电离)。
的电离)。②工业上常用氨水吸收
 ,将
,将 转化为
转化为 或
或 ,常温下,
,常温下, 溶液呈
溶液呈 的
的 ,
, 的
的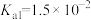 ,
,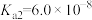 )。
)。
您最近一年使用:0次
解题方法
9 . 氟气化学性质十分活泼,具有很强的氧化性,工业上氟气常用作火箭燃料的氧化剂、卤化氟的原料、冷冻剂等。回答下列问题:
(1)已知2F2+Na2SO4=2NaF+SO2F2+O2,针对该反应的下列有关说法正确的有______ (填字母标号)。
a.SO2F2既是氧化产物又是还原产物
b.生成42 g NaF时则该反应转移1 mol电子
c.F2的氧化性强于O2
d.既有极性键、非极性键的断裂,又有极性键、非极性键的形成
(2)下图是发射卫星时用肼(N2H4)作燃料,用NO2作氧化剂,两者反应生成N2、水蒸气和用F2作氧化剂,两者反应生成N2、HF的反应原理。

通过计算,可知原理(I)和原理(II)氧化气态肼生成氮气的热化学方程式分别为______ 、______ ,消耗等量的N2H4时释放能量较多的是_______ (填“原理(I)”或“原理(II)”)。
(3)在绝热的某刚性容器中置入1 mol F2和3 mol ClF3,发生反应:F2(g)+ClF(g) ClF3(g) △H。下列说法中能够判断该反应一定处于平衡状态的有
ClF3(g) △H。下列说法中能够判断该反应一定处于平衡状态的有_______ (填字母标号)。
a.F2(g)与ClF(g)体积之比恒定不变 b.F2(g)与ClF3(g)速率之比恒定不变
c.容器中温度恒定不变 d.混合物中Cl元素质量分数恒定不变
(4)在K℃下,分别将0.20 mol F2、0.40 mol ClF充入2 L和1 L的2个刚性容器中,发生反应:F2(g)+ClF(g) ClF3(g) △H。实验测得F2的体积分数随时间变化如图所示:
ClF3(g) △H。实验测得F2的体积分数随时间变化如图所示:
①针对F2,若仅从浓度而言,则va(逆)、vb(正)、vc(正)、vd(逆)大小顺序为_________ 。
②反应进行到d点时,反应速率v(F2)=______ mol/(L·min)。
③c点处,F2的平衡转化率α=_______ %,d点处,平衡常数Kc=________ 。
④若升高温度,在2 L的容器中,平衡后ClF的体积分数为0.8,该反应的△H_____ 0(填“>”“ <”或“=”),F2的平衡转化率α_______ (填“增大”“减小”或“不变”)。
(1)已知2F2+Na2SO4=2NaF+SO2F2+O2,针对该反应的下列有关说法正确的有
a.SO2F2既是氧化产物又是还原产物
b.生成42 g NaF时则该反应转移1 mol电子
c.F2的氧化性强于O2
d.既有极性键、非极性键的断裂,又有极性键、非极性键的形成
(2)下图是发射卫星时用肼(N2H4)作燃料,用NO2作氧化剂,两者反应生成N2、水蒸气和用F2作氧化剂,两者反应生成N2、HF的反应原理。

通过计算,可知原理(I)和原理(II)氧化气态肼生成氮气的热化学方程式分别为
(3)在绝热的某刚性容器中置入1 mol F2和3 mol ClF3,发生反应:F2(g)+ClF(g)
 ClF3(g) △H。下列说法中能够判断该反应一定处于平衡状态的有
ClF3(g) △H。下列说法中能够判断该反应一定处于平衡状态的有a.F2(g)与ClF(g)体积之比恒定不变 b.F2(g)与ClF3(g)速率之比恒定不变
c.容器中温度恒定不变 d.混合物中Cl元素质量分数恒定不变
(4)在K℃下,分别将0.20 mol F2、0.40 mol ClF充入2 L和1 L的2个刚性容器中,发生反应:F2(g)+ClF(g)
 ClF3(g) △H。实验测得F2的体积分数随时间变化如图所示:
ClF3(g) △H。实验测得F2的体积分数随时间变化如图所示:
①针对F2,若仅从浓度而言,则va(逆)、vb(正)、vc(正)、vd(逆)大小顺序为
②反应进行到d点时,反应速率v(F2)=
③c点处,F2的平衡转化率α=
④若升高温度,在2 L的容器中,平衡后ClF的体积分数为0.8,该反应的△H
您最近一年使用:0次
10 . 十九大报告提出“要像对待生命一样对待生态环境”,对硫、氮、碳元素形成的有毒有害气体进行处理成为科学研究热点。请回答下列问题:
Ⅰ.氮元素的化合物种类繁多,研究氮氧化物的反应机理对于消除污染有重要指导作用。
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH1=-196.6 kJ·mol-1
2SO3(g) ΔH1=-196.6 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH2=-113.0 kJ·mol-1
则NO2氧化SO2的热化学方程式为___________ 。
(2)利用现代传感技术探究压强对2NO2 (g) N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。

①B、E两点对应的正反应速率大小为vB_____ vE(填“>” 或“<”)。
②E、F、H三点对应气体的平均相对分子质量最大的点为_____ (填字母序号)。
(3)可用下图装置将雾霾中的NO、SO2转化为(NH4)2SO4,则阴极的电极反应式为_________ 。

Ⅱ.利用CO2制取甲醛可以缓解温室效应,反应方程式为CO2(g)+2H2(g) HCHO(g)+H2O(g)。请回答下列问题:
HCHO(g)+H2O(g)。请回答下列问题:
(4)T1℃时,将体积比为1: 2的CO2和H2混合气体充入恒容密闭容器中,每隔一定时间测得容器内气体压强如表所示:
①已知:vp(B)= 。前10 min,用H2的压强变化表示该反应的平均反应速率为
。前10 min,用H2的压强变化表示该反应的平均反应速率为__________ kPa∙min-1。
②T1℃时,反应的平衡常数Kp=______ kPa-1(Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数;结果保留三位有效数字)。
Ⅰ.氮元素的化合物种类繁多,研究氮氧化物的反应机理对于消除污染有重要指导作用。
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。
已知:2SO2(g)+O2(g)
 2SO3(g) ΔH1=-196.6 kJ·mol-1
2SO3(g) ΔH1=-196.6 kJ·mol-12NO(g)+O2(g)=2NO2(g) ΔH2=-113.0 kJ·mol-1
则NO2氧化SO2的热化学方程式为
(2)利用现代传感技术探究压强对2NO2 (g)
 N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。
①B、E两点对应的正反应速率大小为vB
②E、F、H三点对应气体的平均相对分子质量最大的点为
(3)可用下图装置将雾霾中的NO、SO2转化为(NH4)2SO4,则阴极的电极反应式为

Ⅱ.利用CO2制取甲醛可以缓解温室效应,反应方程式为CO2(g)+2H2(g)
 HCHO(g)+H2O(g)。请回答下列问题:
HCHO(g)+H2O(g)。请回答下列问题:(4)T1℃时,将体积比为1: 2的CO2和H2混合气体充入恒容密闭容器中,每隔一定时间测得容器内气体压强如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
①已知:vp(B)=
 。前10 min,用H2的压强变化表示该反应的平均反应速率为
。前10 min,用H2的压强变化表示该反应的平均反应速率为②T1℃时,反应的平衡常数Kp=
您最近一年使用:0次



